Введение. Несмотря на то что радикальная цистэктомия является общепризнанным стандартом лечения инвазивного рака мочевого пузыря, это сложное объемное вмешательство характеризуется довольной высокой (90-дневной) летальностью [1, 2]. За последнее десятилетие выросло число клиник, внедривших лапароскопические варианты этой непростой операции [3–5]. Основными побудительными мотивами к этому считются уменьшение общей травматичности вмешательства и, следовательно, значительное снижение кровопотери, потребности в анальгетиках и общего числа осложнений [4, 6]. Однако лапароскопическая радикальная цистэктомия (ЛРЦ) все еще остается технически сложной и довольно продолжительной операцией [3, 4, 7–9]. Клипирование мочеточников при мобилизации мочевого пузыря сопровождается относительно длительным блокированием почек и риском транзиторного снижения клубочковой фильтрации (КФ). При этом предсуществующее снижение функции почек отмечается почти у трети пациентов [2,10].
Целью настоящего исследования было провести сравнительную оценку применения разработанной собственной методики ЛРЦ с поздним пересечением мочеточников и традиционной техники.
Материалы и методы. В исследование вошли 50 пациентов (36 мужчин, 14 женщин, средний возраст – 64 [47–77] года) с мышечно-инвазивным раком мочевого пузыря, которым с апреля 2013 по январь 2017 г. в нашем центре была выполнена ЛРЦ. Из них 25 пациентам ЛРЦ выполнена по стандартной, ранее описанной методике [11] (первая группа) и 25 – с использованием техники позднего пересечения мочеточников (вторая группа). Во всех случаях операции выполнены полностью интракорпорально без конверсии (табл. 1).

Статистический анализ проведен с использованием критерия Шапиро–Уилка при оценке нормальности распределения признака. Для сравнения групп использовали t-критерий Стьюдента для несвязанных совокупностей.
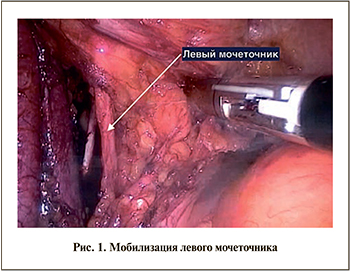
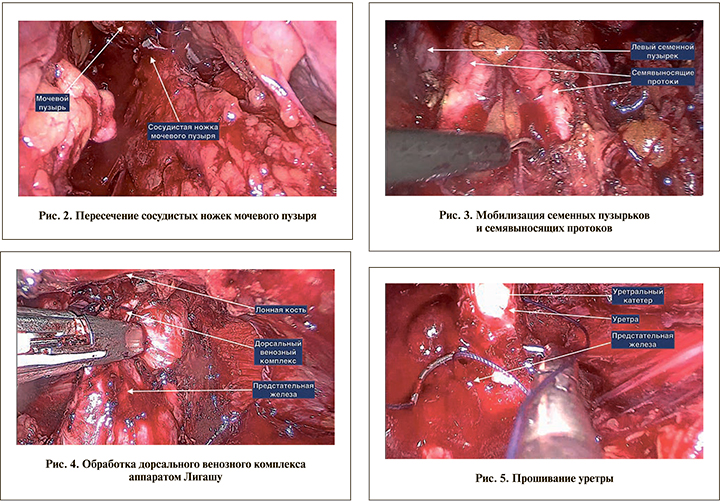
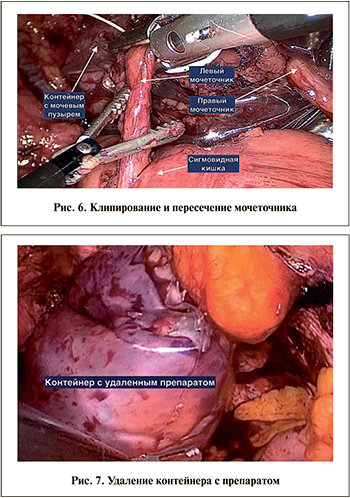
Методика ЛРЦ. Во всех случаях операцию начинали с пункции брюшной полости иглой Вериша и формирования карбоксиперитонеума 12 мм рт.ст. После введения первого троакара (обычно в области пупка) и лапароскопа дополнительно устанавливали четыре рабочих порта: 12 мм слева и справа на 2–3 см каудальнее пупка по краю прямой мышцы живота, еще два 5 мм порта на 2–3 см латеральнее предыдущих – по линии, соединившей передний край гребня подвздошной кости и пупок. Пациента переводили в положение Транделенбурга 15–20. Последовательность и технические особенности выполнения последующих этапов операции по традиционной и предлагаемой методике ЛРЦ приведены в табл. 2.

При определении показаний к уретрэктомии у мужчин последнюю выполняли одномоментно тем же надлонным или отсроченно промежностным доступом.
После операции все пациенты проходили плановое обследование через 1, 3, 6, 12, 18, 24 мес., затем ежегодно.

Результаты. Все вмешательства завершены полностью лапароскопически без конверсии в открытую операцию. Не отмечено статистически значимых различий между группами по средней продолжительности операции, объему кровопотери, продолжительности госпитализации (табл. 3). Обе группы сопоставимы по числу пациентов с различными pTNM-стадиями и соотношению степеней дифференцировки рака.
 Серьезные интраоперационные осложнения, ранение прямой кишки, возникли у двух пациентов (по одному из каждой группы). В обоих случаях дефекты были успешно ушиты во время вмешательства и не оказали влияния на послеоперационное течение. Послеоперационные осложнения, потребовавшие хирургической коррекции, развились у двух пациентов в группе стандартной методики и двух – в группе ЛРЦ с поздним пересечением мочеточников. В первой группе у одного пациента возникла динамическая кишечная непроходимость, устраненная лапароскопически (репозиция петли тонкой кишки, ушивание окна в брыжейке), у второго развилась стриктура уретероилеоанастомоза, гидронефроз. Аналогичное осложнение отмечено у пациента второй группы. Обоим пациентам выполнены перкутанная нефростомия и антеградное стентирование мочеточника. У одной больной второй группы на фоне раневой инфекции имела место несостоятельность швов культи влагалища с эвентрацией пряди большого сальника. Была проведена санация, локальная резекция сальника, наложены вторичные швы на рану.
Серьезные интраоперационные осложнения, ранение прямой кишки, возникли у двух пациентов (по одному из каждой группы). В обоих случаях дефекты были успешно ушиты во время вмешательства и не оказали влияния на послеоперационное течение. Послеоперационные осложнения, потребовавшие хирургической коррекции, развились у двух пациентов в группе стандартной методики и двух – в группе ЛРЦ с поздним пересечением мочеточников. В первой группе у одного пациента возникла динамическая кишечная непроходимость, устраненная лапароскопически (репозиция петли тонкой кишки, ушивание окна в брыжейке), у второго развилась стриктура уретероилеоанастомоза, гидронефроз. Аналогичное осложнение отмечено у пациента второй группы. Обоим пациентам выполнены перкутанная нефростомия и антеградное стентирование мочеточника. У одной больной второй группы на фоне раневой инфекции имела место несостоятельность швов культи влагалища с эвентрацией пряди большого сальника. Была проведена санация, локальная резекция сальника, наложены вторичные швы на рану.
Средний уровень креатинина в плазме крови на 2-е послеоперационные сутки оказался достоверно выше (171,6 и 147,7 мкмоль/л) у пациентов группы стандартной ЛРЦ, а величина КФ – достоверно ниже (58 и 72 мл/мин×1,72 м2), чем у пациентов после ЛРЦ с поздним пересечением мочеточников.
Метастазы в лимфатические узлы выявлены у пяти пациентов первой и трех пациентов второй групп. У одного пациента первой группы (рТ4) обнаружен положительный хирургический край. Прогрессирование заболевания имело место у четырех пациентов первой группы (у двух – отдаленные метастазы, у двух – продолженный рост), и у двух – второй группы (отдаленные метастазы). По одному пациенту первой и второй групп умерли от прогрессирования заболевания (соответственно через 15 и 34 мес. после операции).
 Средний срок наблюдения в группе ЛРЦ с поздним пересечением мочеточников составил 25,6 (12–39) мес. и оказался достоверно короче, чем в группе пациентов с ЛРЦ по стандартной методике, – 33,2 (18–48) мес. Это связано с относительно недавним внедрением описанной техники операции.
Средний срок наблюдения в группе ЛРЦ с поздним пересечением мочеточников составил 25,6 (12–39) мес. и оказался достоверно короче, чем в группе пациентов с ЛРЦ по стандартной методике, – 33,2 (18–48) мес. Это связано с относительно недавним внедрением описанной техники операции.
Обсуждение. Радикальная цистэктомия как у мужчин, так и у женщин является комплексным и объемным вмешательством, подразумевающим интенсивный контакт с магистральными сосудами, нервными сплетениями, лимфатической системой, корнем брыжейки, подвздошной кишкой и другими структурами. Это во многом объясняет довольно высокий уровень послеоперационных осложнений и существенную 90-дневную летальность. К дополнительным факторам риска относятся распространенная стадия заболевания (>Т3), сопутствующие заболевания сердечно-сосудистой системы и органов дыхания, снижение функции почек [2, 13].
Предсуществующие изменения почек отмечаются примерно у 30% кандидатов на радикальную цистэктомию [2, 10]. Их наличие значительно увеличивает риск транзиторного снижения функции в ближайшем и развития хронической почечной недостаточности – в отдаленном периодах после операции.
При стандартном алгоритме выполнения радикальной цистэктомии мочеточники клипируют и пересекают в начале мобилизации мочевого пузыря. Проксимальные концы открывают непосредственно перед формированием анастомоза с кондуитом или резервуаром, т.е. в конце операции. При таком подходе имеет место довольно длительная ретенция коллекторной системы почек, сопровождающаяся существенным повышением внутрипочечного давления и транзиторным снижением клубочковой фильтрации. При наличии предсуществующих изменений почек, а также выраженной инфекции мочевых путей это повышает риск развития серьезных осложнений [12].
В связи с этим в случаях присутствия указанных компрометирующих факторов при выполнении радикальной цистэктомии открытым доступом иногда прибегают к интубации и дренированию проксимальных концов мочеточников сразу после их пересечения. Концы интубаторов соединяют со стерильной емкостью вне операционной раны.
Использование лапароскопического доступа значительно снижает травматичность операции и позволяет существенно уменьшить кровопотерю, ускорить восстановление пациента, снизить количество общесоматических осложнений, сократить сроки госпитализации и период возвращения к повседневной активности, не ухудшая функциональных и онкологических результатов [7, 9, 14, 15]. Однако постоянная инсуффляция углекислого газа в брюшную полость сопровождается определенными метаболическими нарушениями, прежде всего газового состава крови и кислотно-щелочного равновесия. Коррекция этих изменений происходит за счет вентиляции легких (управляемой) и выделительной функции почек. Клиппирование мочеточников в начале операции ЛРЦ не только сопровождается риском повреждения компрометированных почек, но и может стать причиной дополнительных анестезиологических проблем.
Дренирование коллекторной системы почек интубаторами на начальных этапах лапароскопической операции с выведением дренажных трубок через один из портов или отдельные проколы сопряжено с выраженными техническими неудобствами. Пересечение мочеточников без клиппирования проксимальных концов с временным дренированием мочи в брюшную полость также сопровождается метаболическими нарушениями за счет высокой транспортной функции брюшины, в том числе может приводить к критической гиперкалиемии. Кроме того, длительный контакт мочи с висцеральной брюшиной может провоцировать воспаление и в дальнейшем – спаечный процесс [16].
Оптимальным решением при выполнении ЛРЦ может стать максимально продолжительное естественное дренирование мочи в мочевой пузырь. Это возможно при использовании описанной выше методики «позднего пересечения мочеточников». Важными положительными моментами такого подхода служат не только профилактика системных метаболических нарушений и воспалительных изменений брюшины, но, что, возможно, важнее, предотвращение диссеминации переходно-клеточного рака по брюшине. Конечно, для подтверждения преимуществ предложенной методики требуется длительный период наблюдения.
Тем не менее мы констатировали достоверно меньший средний уровень креатинина плазмы на 2-е послеоперационные сутки у пациентов после выполнения модифицированной методики по сравнению со стандартной ЛРЦ (171,6 и 147,7 мкмоль/л), тогда как величина клубочковой фильтрации, наоборот, оказалась достоверно выше (68 и 82 мл/мин×1,72 м2). Показанные преимущества имеют особое значение для пациентов со сниженной функцией почек, единственной почкой и для пациентов с сопутствующими компрометирующими почки заболеваниями.
Средний объем кровопотери в группах (285 и 275 мл соответственно) существенно не различался. Частота возникновения серьезных послеоперационных осложнений, потребовавших оперативного вмешательства, была одинаковой (по два в каждой группе). Полученные нами данные оказались сопоставимыми со значениями, приведенными в большинстве исследований [17–19].
Средняя продолжительность госпитализации была несколько меньше после выполнения цистэктомии с поздним пересечением мочеточников (11,8 и 12,4 дня соответственно), однако различия не были статистически значимыми.
Заключение. Лапароскопическая радикальная цистэктомия с поздним пересечением мочеточников позволяет предотвращать длительный контакт брюшины с гиперосмолярной и не всегда стерильной мочой, тем самым существенно уменьшать факторы воспаления и вероятность развития склеротических изменений и спаечного процесса в брюшной полости.
Предложенный метод снижает риск развития периоперационной нефропатии и имеет существенные преимущества у пациентов с компрометированными почками (единственная функционирующая почка, гидронефроз, сахарный диабет, почечная недостаточность, предшествующая химиотерапия и т.д.)
Необходимы дальнейшие наблюдения для сравнения отдаленных онкологических результатов модифицированной и стандартной методик ЛРЦ.



