Введение. Согласно современным данным, среди бактериальных инфекций у детей инфекция мочевыводящих путей (ИМВП) занимает второе место по частоте после инфекции верхних дыхательных путей. Распространенность инфекции мочевой системы составляет 10–18 случаев на 1000 детского населения: в период новорожденности – 1,4–2,4%, у детей дошкольного возраста – 0,5 %, в препубертатном периоде – 0,1 %. В структуре заболеваний органов мочевой системы пиелонефрит занимает первое место, составив 60–65 % нефрологической патологии [1].
По данным статистики, в России за последние годы отмечен рост заболеваний мочевой системы в 2, у подростков — в 2,8 раза. Следует особо отметить, что сочетание воспалительных заболеваний мочевыводящих путей и гениталий у девочек составляет 25–71% [2].
Инфекция мочевыводящих путей (ИМП) – инфекционно-воспалительный процесс в различных отделах мочевой системы без указания уровня поражения, включает пиелонефрит (ПН), цистит, уретрит и асимптоматическую бактериурию.
Пиелонефрит – это неспецифическое инфекционновоспалительное заболевание почек с преимущественным поражением чашечно-лоханочной системы и тубулоинтерстициальной ткани. Частота ПН зависит от пола ребенка, его возраста. В первые месяцы жизни частота встречаемости ПН среди мальчиков и девочек примерно одинакова, в дальнейшем чаще встречается ПН у девочек: к 1-му году частота ПН у девочек больше в 4, к 3 годам – в 10 раз. На первом году ПН встречается намного чаще, чем в старшей возрастной группе: считается, что в грудном возрасте заболевает столько же детей, сколько в последующие 14 лет жизни вместе взятые [3].
Наиболее часто при ПН при проведении бактериологического исследования мочи высевается E. coli (по данным различных авторов, от 40 до 90% случаев), Klebsiella pneumonie (7–20%), Proteus mirabilis (9–16%), St.aureus (5–14%) и др. Некоторые особенности имеет состав высеваемой флоры при хроническом течении ПН. Повышается роль микробных ассоциаций, наличие которых рассматривается и как один из факторов хронизации инфекционного процесса при ПН. В 2 раза реже диагностически значимая бактериурия выявляется при хроническом процессе, чем при остром. Кроме этого увеличивается доля грамположительной флоры, чаще обнаруживаются L-формы бактерий [4].
Ведущая роль E. coli и других представителей семейства Enterobacteriacae в развитии пиелонефрита обусловлена наличием у них вирулентных (способность проникать в макроорганизм) и патогенных свойств (способность вызывать патологический процесс). Адгезия бактерий с помощью фимбрий – первое и наиболее важное звено в патогенезе пиелонефрита, так как лишенные адгезивной способности микроорганизмы не могут вызывать инфекционный процесс. Помимо фимбрий вирулентность кишечной палочки обусловлена наличием жгутиков [5].
Выделяют несколько факторов риска, определяющих предрасположенность к возникновению ИМВП.
Наиболее значимые факторы риска развития ИМВП у детей:
- пиелонефрит беременных;
- наличие хронических инфекций у матери, особенно урогенитальных заболеваний; воспалительные заболевания у девочек (вульвиты, вульвовагиниты);
- патологическое течение беременности (особенно гестозы);
- наличие почечной патологии в роду;
- наличие нарушений обмена веществ у родителей и ближайших родственников;
- профессиональные вредности у матери во время беременности.
Последние четыре причины могут приводить к неправильной дифференцировке почечной ткани и аномалиям развития органов мочевой системы, что в последующем может способствовать инфицированию мочевой системы [6].
Эффективность лечения пиелонефрита у детей во многом зависит от своевременности назначения и правильности выбора антимикробной терапии.
Важным условием следует считать бактериологическое исследование мочи, проведенное больному до начала терапии. Одним из основных диагностических критериев ИМВП (а иногда и единственным) является характерный мочевой синдром в виде лейкоцитурии преимущественно нейтрофильного типа и бактериурии (при выявлении лейкоцитурии более 25 в 1 мкл или более 10–15 в поле зрения и бактериурии более 100 тыс. микробных ЕД/мл при бактериологическом исследовании мочи диагноз инфекции мочевыводящих путей рекомендуется считать наиболее вероятным) [7, 8].
Антибиотикотерапию следует сразу начинать после сбора мочи для посева, особенно если анализ мочи подозрителен и/или клинические данные соответствуют острой фазе пиелонефрита. В исследованиях показано, что быстрое начало эмпирической системной антибиотикотерапии препаратами широкого спектра действия снижает риск осложнений, в первую очередь формирования нефросклероза [9, 10]. Особенность течения пиелонефрита у детей заключается в том, что как только интерстиций почки вовлекается в воспалительный процесс, сроки начала приема антибиотиков не снижают риска образования склеротических рубцов в почечной ткани [11].
Таким образом, дети с симптомами интоксикации (фебрильная лихорадка, боль в поясничной области) должны незамедлительно получать антибактериальную терапию, а до 2 мес. жизни – только в условиях стационара [11]. При тяжелом течении пиелонефрита и детям раннего возраста рекомендуется внутривенная антибактериальная терапия, по крайней мере от 48 до 72 ч или до тех пор, пока у ребенка на наступит клиническое улучшение (отсутствие лихорадки в течение 24 ч). Регулярное последующее исследование мочи на бактериурию не рекомендуется, так как в подавляющем большинстве случаев посевы после 24 ч антибиотикотерапии неинформативны [12].
Согласно Федеральным клиническим рекомендациям «Инфекции мочевыводящих путей у детей» от 2021 г, в лечении острого пиелонефрита применяются следующие препараты: Амоксициллин+клавулановая кислота по 90 мг/ кг/сут. 3 раза в сутки в течение 10–14 дней; Цефтриаксон по 50–80 мг/кг/сут. 3 раза в сутки 10–14 дней; Цефотаксим по 150 мг/кг/сут. 2–4 раза в сутки в течение 10–14 дней; Цефазолин по 50 мг/кг/сут. 3 раза в сутки в течение 10–14 дней [13].
В случаях непрерывно (или часто) рецидивирующего пиелонефрита (более 2 раз за последние 6 мес.), а также рецидивирующего пиелонефрита, протекающего на фоне пузырно-мочеточникового рефлюкса и/или цистита, рекомендуется поддерживающая терапия, в рамках которой может быть рекомендован длительный прием растительных уросептиков (в течение 1–6 мес.) [14].
В комплексной терапии инфекций мочевыводящих путей, а также для профилактики и предотвращения рецидивов широко применяются препараты, содержащие в своем составе экстракт клюквы и D-маннозу. В плодах клюквы содержатся два вещества: фруктоза и проантоцианидин, которые связываются с белками на фимбриях E. coli, эффективно подавляя адгезию бактерий на эпителиальной выстилке мочевыводящих путей [15]. D-манноза – вещество растительного происхождения, практически не расщепляется в организме: после всасывания в неизменном виде попадает в мочевой пузырь, где связывается с нитями (пилями) бактерий и мешает им прикрепиться к клеткам мочевого пузыря. В результате бактерии вместе с мочой покидают организм. Доказано, что ежедневный прием 420 мг D-маннозы в сочетании с растительными экстрактами эффективен в комплексной терапии и профилактике цистита. Входит в Европейские клинические рекомендации с 2015 г. [13].
В нашей стране доступна БАД к пище Цистениум-II (производство компании Аквион, Россия) в форме таблеток, содержащая экстракт плодов клюквы (Vaccinium oxycoccos), D-маннозу, витамин С.
БАД Цистениум-II хорошо зарекомендовал себя в комплексном лечении хронических воспалительных заболеваний мочевой системы, так как активные вещества, входящие в состав БАД, обладают не только противовоспалительным и антибактериальным, но и нефропротективным, мочегонным и спазмолитическим действиями.
Цистениум-II принимают по 1 таблетке 2 раза в день во время еды. Рекомендованный курс приема – 2 нед. При необходимости курс лечения может быть продолжен. Комплекс биологически активных веществ, входящих в состав БАД Цистениум-II, разрешен беременным и детям старше 7 лет [16].
Цель исследования: оценить эффективность БАД Цистениум-II для группы детей с 7 до 14 лет в комплексной терапии острого и хронического рецидивирующего пиелонефрита в фазе обострения.
Материалы и методы. Было отобрано 2 группы пациентов (детей в возрасте от 7 до 14 лет, средний возраст – 11,6±2,1 года).
Клиническую группу составили 30 пациентов (средний возраст – 12,1±1,8 года) с диагнозом «острый или хронический рецидивирующий пиелонефрит в стадии обострения». У всех пациентов отсутствовала обструкция верхних мочевыводящих путей. Также у всех пациентов обязательно были исключены гнойно-деструктивные изменения почечной ткани. При этом в рамках клинической группы в исследовании приняли участие 6 пациентов (из 30), у которых ранее диагностирован пузырно-мочеточниковый рефлюкс (ПМР). Семь пациентов включены в исследование с впервые выявленным острым пиелонефритом, у остальных участников диагностировано обострение хронического процесса, а у 4 пациентов данной группы (все с ранее диагностированным ПМР) отмечен второй рецидив острого пиелонефрита за последние полгода. По данным бактериологических исследований мочи, основным выявленным уропатогеном у пациентов клинической группы была Escherichia coli (22 пациентов), у четырех – Staphylococcus (St. saprophyticus, St. epidermidis, St. Aureus), у двоих – Streptococcus faecalis и еще у двоих – Proteus mirabilis. Важно отметить, что у 12 пациентов (среди которых 4 пациента с ПМР) высеяна комбинация кишечной палочки и других микроорганизмов.
Пациенты клинической группы получали комплексное лечение с использованием БАД Цистениум-II. Исследуемый препарат принимался по 1 таблетке 2 раза в день во время еды в течение 14 дней. После окончания курса антибактериального лечения дети клинической группы продолжали прием исследуемой БАД еще в течение 14 дней в качестве противорецидивной профилактики пиелонефрита.
Контрольную группу составили также 30 пациентов (от 7 до 14 лет, средний возраст – 11,2±1,7 года), получавших только классическую антибактериальную терапию. У всех пациентов контрольной группы также отсутствовал обструктивный компонент, исключены гнойно-деструктивные изменения почечной ткани. В рамках контрольной группы в исследование были включены 4 (из 30) пациента, у которых ранее диагностирован пузырно-мочеточниковый рефлюкс (ПМР). Десять пациентов включены в исследование с впервые выявленным острым пиелонефритом, у остальных участников диагностировано обострение хронического процесса, у 3 пациентов данной группы (двое из них с диагностированным ранее ПМР) отмечен второй рецидив острого пиелонефрита за последние полгода. Основным выявленным уропатогеном у пациентов конт-рольной группы по результатам бактериологических исследований мочи также была Escherichia coli (24 пациента), у троих – Staphylococcus (St. saprophyticus, St. epidermidis, St. Aureus), еще у троих – Streptococcus faecalis и у одного пациента – Proteus mirabilis. Как и в контрольной группе, значимое количество (10 человек) пациентов имели смешанную флору (среди которых двое с ПМР).
В ходе наблюдательного исследования оценивались переносимость и эффективность БАД Цистениум-II, динамика выраженности дизурии, болевого синдрома, риск повторных обострений пиелонефрита, состояние лабораторных и инструментальных показателей на разных сроках лечения и профилактики.
Для оценки изменения состояния детей обеих групп в ходе терапии проводили анализ выраженности дизурии, болевого синдрома. Нами использован опросник (визуально-аналоговая шкала боли) – это вертикально расположенная шкала количественной оценки боли. Детей просили положить пальцы на ту высоту шкалы, с которой они ассоциируют свои болевые ощущения. Верхушка шкалы (10 баллов) означает «очень-очень сильная боль», основание (0 баллов) – «вообще нет боли» [17].
Дизайн исследования состоял из визита включения, контрольных визитов на 3-й, 7, 14-й день лечения, а также спустя 1 и 6 мес. от начала терапии.
Результаты лечения (состояние пациента, наличие болевого синдрома, дизурии, повышения температуры тела) оценивали на 3-й, 7, 14-й день наблюдения, через 1 и 6 мес.после начала лечения. Общий анализ мочи (ОАМ), а также общий и биохимический анализы крови выполнялись на визите включения, на 7-й, 14-й день наблюдения, через 1 и 6 мес. от начала лечения, бактериологическое исследование мочи на флору проводили до начала и по окончании антибактериальной терапии на визите включения и на 14-й день наблюдения, а также спустя 1 и 6 мес. после начала лечения.
Кроме мониторинга общего состояния, болевого синдрома, лабораторных исследований, пациентам клинических и контрольной групп на визите включения, а также в рамках динамического наблюдения (14-й день терапии, 1 и 6 мес. от начала терапии) выполнялось ультразвуковое исследование почек для исключения острого гнойного процесса и состояния чашечно-лоханочной системы почек.
Отдаленные результаты оценивали через 1 и 6 мес. от начала комплексной терапии.
Для пациентов критериями включения стали:
- Верифицированный диагноз (острый и хронический рецидивирующий пиелонефрит в фазе обострения) у пациентов в возрасте 7–14 лет;
- Пациенты, чьи родители или законные представители, подписали информированное согласие на участие в программе.
Критерии невключения:
- Наличие серьезных сопутствующих заболеваний у детей (тяжелые аллергические реакции или анамнестические сведения о тяжелых нежелательных реакциях на лекарственные препараты, например отек Квинке; заболевания печени в активной стадии; почечная недостаточность по клиническим показателям; острые состояния; гиперчувствительность к компонентам препарата; злокачественные новообразования);
- Наличие противопоказаний к применению БАД Цистениум-I.
Критерии исключения:
- Появление серьезного нежелательного явления;
- Решение пациента или его законного представителя выбыть из программы;
- Низкая (ниже 80%) приверженность пациента к назначаемому лечению, выражающаяся в неприменении тестируемого препарата или неоправданное отсутствие на контрольных визитах.
Обработка полученных данных проводилась методом статистического анализа на основе проверки нормальности распределения количественных признаков с помощью оценки коэффициентов асимметрии, эксцесса выборки и критерия Пирсона χ2; проверки равенства дисперсий с помощью критериев Фишера и Кохрэна. Количественные переменные описывали следующими статистическими методами: число валидных случаев, среднее арифметическое значение (М), стандартное отклонение от среднего арифметического значения (σ). Качественные переменные описывали абсолютными и относительными частотами (процентами). Величина р определялась с точностью до 3-го знака после запятой, для обработки полученных данных использовалась компьютерная программа Statistica 6.0.
Критическое значение уровня значимости принималось равным 5% (р≤0,05). Для оценки динамики изменения данных, выраженных количественными показателями, использовали методы статистического анализа: непарный t-критерий Стьюдента, непараметрические критерии Манна–Уитни.
Результаты. Большинство (29) пациентов клинической группы и 26 пациентов контрольной группы отмечали значительное улучшение во время контрольного визита через 3 дня: уменьшалась степень выраженности болевого синдрома, купировалась дизурия (табл. 1, 2). Четырем пациентам контрольной и одному клинической групп проведена коррекция основной (антибактериальной терапии) в связи с сохранением болевого синдрома и фебрильной лихорадки.
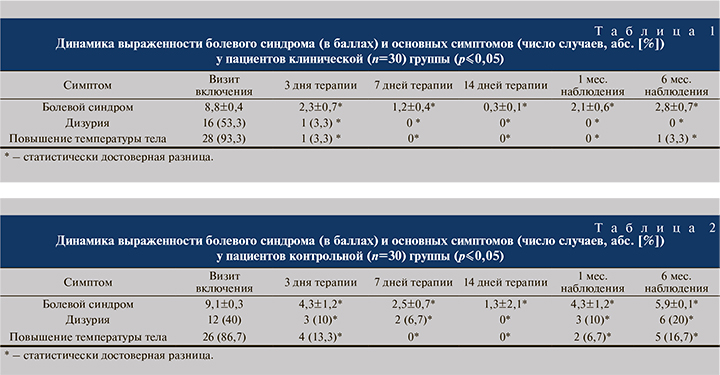
К третьему визиту (7-е сутки терапии) у всех пациентов обеих групп нормализовались показатели температуры, у подавляющего большинства (28 контрольной и все пациенты клинической группы) купировались болевой синдром и явления дизурии.
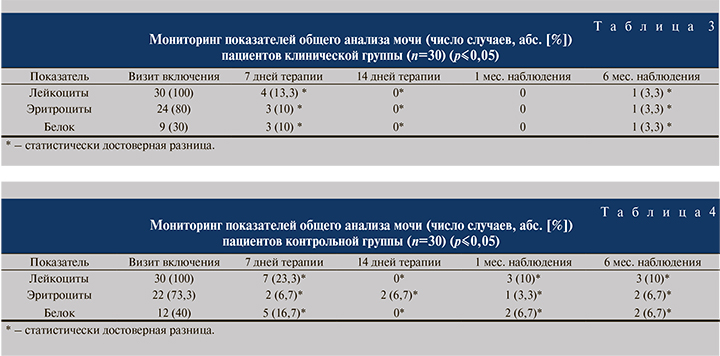
Основные показатели ОАМ (лейкоциты, эритроциты, белок) нормализовались у 26 (86,7%) пациентов клинической и у 23 (76,7%) контрольной групп на 7-й день после начала лечения, по окончании основной терапии (через 14 дней) нормальные клинические показатели (отсутствие лейкоцитурии, эритроцитурии, протеинурии) отмечены у всех пациентов клинической группы и у 28 (93,3%) – контрольной. Однако спустя месяц наблюдения в контрольной группе вновь диагностированы изменения основных показателей ОАМ (лейкоциты, эритроциты, белок в моче) у 3 (10%) пациентов, из них 2 пациента с ранее диагностированным ПМР (при дальнейшем бактериологическом исследовании мочи у этих пациентов высеяны Escherichia coli, Proteus mirabilis) и еще у 3 (10%) детей (один из которых пациент с ПМР) спустя 6 мес. от начала терапии (при посевах мочи диагностированы Escherichia coli, Staphylococcus epidermidis, Streptococcus faecalis, Proteus mirabilis). В то время как в клинической группе за месяц наблюдения у всех пациентов отмечены нормальные показатели клинического анализа мочи (отсутствие лейкоцитурии, эритроцитурии, протеинурии) и лишь у 1 (3,3%) в ОАМ вновь выявлена лейкоцитурия, увеличение количества эритроцитов и белка к 6-му месяцу от начала терапии (при дальнейшем бактериологическом исследовании мочи выявлен Streptococcus faecalis, это пациент с ранее выявленным ПМР) (табл. 3, 4). Таким образом, использование в комплексной противомикробной терапии БАД Цистениум-II обеспечивает дополнительный противовоспалительный и симптоматический эффект, который сохраняется и после прекращения активной антибактериальной терапии. Кроме того, оказалось, что прием Цистениума-II дает устойчивый противорецидивный эффект, о чем свидетельствует отсутствие клинических и лабораторных проявлений пиелонефрита через 1 мес. от начала лечения у всех пациентов клинической группы. Лишь у 1 (3,3%) больного, несмотря на достигнутый ранее положительный эффект, повторно развилось обострение пиелонефрита за 6 мес. наблюдения; в контрольной группе признаки рецидива заболевания диагностированы у 3 (10%) пациентов уже за 1-й месяц наблюдения и еще у 3 (всего 6 рецидивов за весь срок наблюдения – 20%, трое из них с ранее выявленным ПМР) к 6-му месяцу от начала терапии.
Результаты бактериологического исследования мочи спустя 6 мес. от начала лечения свидетельствуют о более высокой эффективности антибактериальной терапии в комбинации с использованием БАД Цистениум-II (96,7%) в отличие от контрольной группы (80%). Лишь у 1 пациента (с ранее выявленным ПМР) за 6 мес. наблюдения в клинической группе диагностирована бактериурия в клинически значимом титре (более 103 КОЕ/мл), в то время как в группе контроля за 6 мес. от начала терапии выявлено 6 случаев клинически значимой бактериурии (табл. 5 и 6).


Отмечена хорошая переносимость Цистениума-II детьми.
Обсуждение. Согласно полученным результатам, использование БАД Цистениум-II детьми с 7 лет в комплексной терапии острого пиелонефрита, а также обострения хронического пиелонефрита способствовало поддержанию достигнутого ранее эффекта и дополнительно повысило эффективность инициальной терапии. Эти данные свидетельствуют о высокой общей терапевтической эффективности комплексной терапии с использованием БАД Цистениум-II спустя 6 мес. от начала лечения (рецидив у 1 пациента) в отличие от контрольной группы (рецидив у 6 пациентов).
Основные показатели ОАМ (лейкоциты, эритроциты, белок) нормализовались у 26 (86,7%) пациентов клинической группы и у 23 (76,7%) контрольной через 7 дней терапии после начала терапии, по окончании основной терапии нормальные (14 дней) клинические показатели отмечены у всех пациентов клинической группы и у 28 (93,3%) – контрольной. Однако спустя месяц наблюдения в контрольной группе вновь диагностированы изменения основных показателей ОАМ (лейкоциты, эритроциты, белок в моче) у 3 (10%) пациентов, из них у 2 пациентов с ранее диагностированным ПМР и еще у 3 (10%; один из которых страдает ПМР) спустя 6 мес. от начала терапии. В то время как в клинической группе за месяц наблюдения у всех пациентов отмечены нормальные показатели клинического анализа мочи (отсутствие лейкоцитурии, эритроцитурии, протеинурии) и лишь у 1 (3,3%) пациента в ОАМ вновь выявлена лейкоцитурия, увеличение количества эритроцитов и белка к 6-му месяцу от начала терапии (это пациент с ранее выявленным ПМР).
Положительные результаты применения БАД ЦистениумII получены и в отношении эрадикации возбудителя согласно проведенным посевам мочи на флору после окончания курса антибиотикотерапии и в рамках динамического наблюдения.
Применение БАД Цистениум-II (производство компании Аквион, Россия) за счет входящих в состав D-маннозы (450 мг), экстракта плодов клюквы (обладающего стандартизированной активностью [36 мг проантоцианидинов] 500 мг) и витамина С (60 мг) может способствовать противовоспалительному, ангиопротективному, противо-отечному и антиадгезивному эффектам [18, 19]. D-манноза и проантацианидины прямо воздействуют на основной уропатоген – кишечную палочку (E. coli), не позволяя ей прикрепиться к уротелию и запустить воспалительную реакцию. Антиадгезивное действие D-маннозы (блокирование фимбрий 1-го типа) при цистите и других ИМП эффективно дополняется проантоцианинами клюквы, так как E. coli имеют P-фимбрии (37,2%) и фимбрии 1-го типа (62,8%) [20]. Витамин С повышает сопротивляемость организма инфекциям, способствует регенерации и заживлению эпителия мочевого пузыря, создает кислую среду, подавляющую жизнедеятельность патогенных бактерий, нейтрализует свободные радикалы, повышенное количество которых сопровождает процессы воспаления.
Все это делает целесообразным применение БАД Цистениум-II детьми с целью профилактики обострения хронического пиелонефрита после достигнутого клинического улучшения, а также для повышения эффективности курса инициальной комплексной терапии, особенно в тех случаях, когда острый процесс вызван кишечной палочкой.
Таким образом, применение БАД Цистениум-II позволило уменьшить количество рецидивов обострения пиелонефрита у детей за 6 мес. наблюдения и, возможно, снизило частоту хронизации пиелонефрита после перенесенного острого процесса. Однако последнее предположение требует проверки в специальном катамнестическом исследовании.
Выводы
1. Результаты проведенного исследования свидетельствуют о высокой терапевтической эффективности БАД Цистениум-II, которая составила в клинической группе больных 96,7% относительно контрольной группы (80%).
2. Получены данные как клинической, так и бактериологической эффективности БАД, а также отсутствие побочных эффектов, что подтверждает целесообразность широкого клинического применения Цистениума-II для комплексного лечения острого и обострения хронического пиелонефрита у детей старше 7 лет.



