Введение. По данным отчета GLOBOCAN (2018), представленного Международным агентством по исследованию рака (IARC), в 2018 г. в мире зарегистрировано почти 1,3 млн новых случаев рака предстательной железы (РПЖ), а также 359 тыс. смертельных исходов, ассоциированных с РПЖ, что ставит данную патологию соответственно на вторую и пятую позиции в общемировой структуре онкологической заболеваемости и смертности мужского населения [1, 2]. Более чем в половине (105 из 185) стран мира, в частности в Северной и Южной Америке, Северной и Западной Европе, Австралии и Новой Зеландии, а также на значительной части Африканского континента РПЖ является самым частым злокачественным новообразованием у мужчин [1].
Рост заболеваемости в значительной степени обусловлен более широким внедрением системы своевременного выявления РПЖ с обязательным определением простатического специфического антигена (ПСА), что в свою очередь привело к повышению частоты регистрации локализованных форм заболевания – до 55,2% среди вновь выявленных больных [3–5].
Улучшение ранней диагностики и повышение внимания к качеству жизни пациентов на фоне побочных эффектов радикальной простатэктомии [6] стимулируют поиск менее инвазивных методов лечения, среди которых особого внимания заслуживает абляция предстательной железы (ПЖ) высокоинтенсивным фокусированным ультразвуком (HIFU). Ее основные преимущества – высокие показатели 5-летней безрецидивной выживаемости при лечении локализованных форм РПЖ (66–78%), а также возможность повторного применения в случае возникновения локального рецидива [6, 7]. Растет популярность мультимодального подхода, когда в дополнение к малоинвазивному вмешательству используется неоадьювантная гормональная терапия [8, 9].
Метод HIFU-терапии основан на распространении механических волн с частотой выше 20 тыс. Гц рассеянными пучками с фокусировкой в заданной зоне. Высокоэнергетический ультразвук обладает уникальной способностью проникать в здоровые ткани, не повреждая их, однако при фокусировке линзой эмиттера на небольшом участке в течение 1 с происходит мгновенное повышение температуры до 90°C, достаточной для развития коагуляционного некроза. Энергия ультразвуковых колебаний приводит к термическим и механическим повреждениям, а также к деструкции клеток за счет эффекта кавитации [10].
На сегодняшний день сформулированы преимущества метода HIFU, определены основные морфологические изменения, отражены результаты проспективных исследований, освещены проблемы, связанные с данной методикой лечения РПЖ [11–14].
Одной из нерешенных задач служит ранняя диагностика локального рецидива после HIFU. Это обусловлено недостаточной доступностью позиционно-эмиссионной томографии (ПЭТ-КТ), которая позволяет их выявлять, что требует поиска новых методов диагностики [15].
Цель исследования: изучить клинико-морфологические и микроциркуляторные критерии эффективности лечения и прогноза локального рецидива после HIFU.
Материалы и методы. На базе урологического отделения Отделенческой клинической больницы ст. Барнаул ОАО РЖД (клиническая база кафедры урологии и андрологии с курсами специализированной хирургии ФГБОУ ВО «Алтайский государственный медицинский университет») за 2011–2018 гг. проведено комплексное обследование и лечение 240 пациентов с РПЖ. Все исследования проведены с разрешения Комитета по биомедицинской этике.
Во всех случаях диагноз РПЖ верифицирован морфологически (стадия Т2а-сN0M0). Всем пациентам до HIFU-терапии с целью исключения метастазов провели магнитно-резонансную томографию органов малого таза, радионуклидное сканирование костей скелета.
С целью уменьшения объема ПЖ и увеличения радикальности лечения, удаления петрификатов и профилактики инфравезикальной обструкции всем пациентам за 5–7 дней до HIFU-терапии провели ТУРП.
Сеанс HIFU проводили под спинальной анестезией по стандартной методике на аппарате «Ablatherm» (EDAP TMS S.A., Франция).
Измерение уровня общего ПСА в сыворотке крови осуществлено с помощью системы ARCHITECTi. Признаком биохимического рецидива считали прирост показателя более чем на 2 нг/мл относительно надира [16, 17].
Трансректальное ультразвуковое исследование проведено на аппарате Acuson «S 2000» (Siemens, Германия). Оценивались объем ПЖ, структура и кровоток.
Микроциркуляцию в ткани ПЖ оценивали по разработанной нами методике с использованием лазерной допплеровской флоуметрии (ЛДФ) [18]. Она основана на использовании биологически активных точек проекции простаты, находящихся на одинаковом расстоянии между анальным отверстием и корнем мошонки по средней линии [19].
Использовали аппарат ЛАКК-02 (НПП «ЛАЗМА», Россия). Зонд-датчик устанавливали перпендикулярно кожи промежности, время записи составило 2 мин. Обработку кривых с использованием программного обеспечения осуществляли после каждого исследования. Определяли показатель микроциркуляции (ПМ), характеризующий поток эритроцитов в единицу времени через единицу объема ткани (в перф. ед.), среднеквадратическое отклонение (СКО, перф. ед.), отражающее временную изменчивость микроциркуляции, а также коэффициент вариации (KВ=СКО/ПМ×100%), характеризующий вазомоторную активность микрососудов [20, 21].
Первое контрольное обследование выполнено через 1 мес. после HIFU, потом каждые 3 мес. на протяжении 3 лет.
Патоморфологическое исследование проведено на материале первичных и послеоперационных образцов, полученных при мультифокальной биопсии и ТУРП. Контрольные биопсии выполнены трансректальным доступом из 12 точек в сроки 6, 12 , 24 и 36 мес.
Статистический анализ результатов проведен с помощью программы STATISTICA версии 12.0 компании StatSoft, Inc (США), графическое представление данных – при помощи программ STATISTICA и Microsoft Excel 2016. Проверку гипотезы о нормальности распределения и равенстве выборочных дисперсий осуществили с использованием критериев Шапиро–Уилка и Левена.
Для относительных величин значения представлены в виде процентного соотношения, для каждой из непрерывных величин в зависимости от типа распределения – в виде среднего арифметического и стандартного отклонения (M±σ).
Для анализа таблиц сопряженности применен точный критерий Фишера или критерий χ2 Пирсона. С целью сравнения двух независимых групп по количественному признаку использован t-критерий Стьюдента или непараметрический U-критерий Манна–Уитни. Для сравнения связанных выборок использовали парный t-критерий Стьюдента или непараметрический T-критерий Вилкоксона.
Коррелятивные взаимоотношения оценивали с помощью критериев Пирсона и Спирмена. Различия в сравниваемых группах считали статистически значимыми при p<0,05.
Для обоснования результатов исследования при оценке выживаемости пациентов использованы традиционные в онкологии критерии. Нами применен анализ общей и безрецидивной выживаемости.
Результаты. HIFU выполнена 240 пациентам с РПЖ в возрасте от 51 года до 82 лет (средний возраст – 67,4±1,0 год). Среднее время процедуры составило 116,5±23,4 (61–168) мин, продолжительность послеоперационного койко-дня – 9,4±0,4 (8–14) сут. Продолжительность наблюдения за пациентами варьировалась от 9 до 52 мес., составив в среднем 32,3±13,1 мес. Стадия Т2а диагностирована у 94 (39,1%) пациентов, Т2b – у 81 (33,7%), Т2с – у 65 (27%).
В зависимости от группы риска развития рецидива пациенты распределились следующим образом. В группу низкого риска (индекс Глисона <6, ПСА<10 нг/мл) вошли 102 пациента, в группу среднего риска (индекс Глисона – 6–7, ПСА – 10–20 нг/мл) – 86 и в группу высокого риска (индекс Глисона >7, ПСА >20 нг/мл) – 52 пациента.
Проведен анализ динамики концентрации ПСА в течение 3 лет после HIFU-терапии в зависимости от онкологического риска (табл. 1).
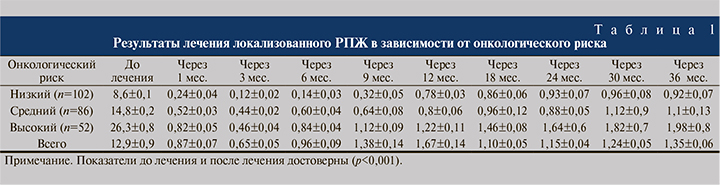
Результаты ПСА на всех сроках после операции достоверно отличались от исходных значений. Cнижение показателя ПСА до 0,5 нг/мл и ниже отмечено у 74% пациентов. Стабильный уровень ПСА в течение 3 лет констатирован в 76% наблюдений. Показатели уровня ПСА различались в зависимости группы онкологического риска (табл. 1).
В группе низкого риска количество отрицательных биопсий составило 89,6%; в группах среднего и высокого рисков – 72,2 и 69,4% соответственно (табл. 2).
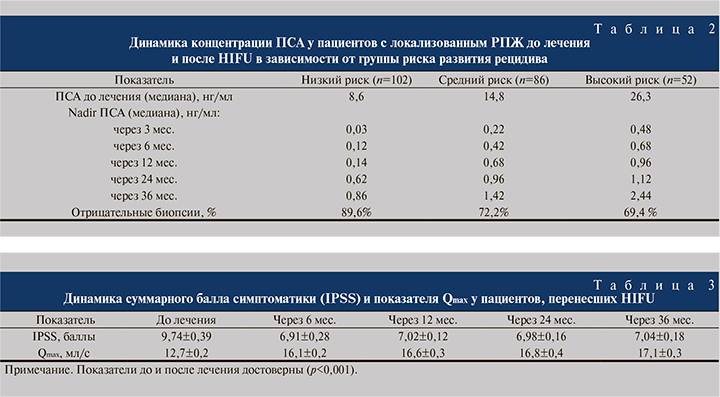
Как видно из табл. 2, наилучшие результаты лечения РПЖ наблюдали в группе низкого онкологического риска. Повторный сеанс HIFU проведен 19 пациентам, 5, 6 и 8 – групп низкого, среднего и высокого рисков соответственно. Одиннадцати пациентам с признаками прогрессирования заболевания была назначена антиандрогенная терапия в режиме монотерапии или максимальной андрогенной блокады.
У всех пациентов после HIFU отмечено значительное снижение объема ПЖ. Наименьший объем ПЖ наблюдали через 12 мес. после проведения HIFU.
Значительное снижение объема ПЖ имело место уже через 1 мес. после лечения, и тенденция к снижению объема сохранялась в течение всего периода наблюдения.
Уменьшение размеров ПЖ сопровождалось уменьшением выраженности инфравезикальной обструкции и симптомов, что подтверждалось результатами урофлоуметрии (Qmax) и суммой баллов по шкале IPSS. Поскольку процедура HIFU сопровождается термическим воздействием на ткань ПЖ, уретру и часть шейки мочевого пузыря, вызывающим отек тканей, оценку выраженности симптомов нижних мочевыводящих путей провели не ранее чем через 6 мес. после лечения (табл. 3).
Показатели IPSS и Qmax после операции достоверно отличались от исходных значений. Заметное улучшение состояния, сопровождавшееся снижением суммарного балла по IPSS и увеличением Qmax, констатировали уже через 6 мес. после сеанса HIFU.
Анализ безрецидивной выживаемости после HIFU-терапии показал, что по прошествии 3 и более лет 77% пациентов живут без признаков рецидивов (рис. 1).
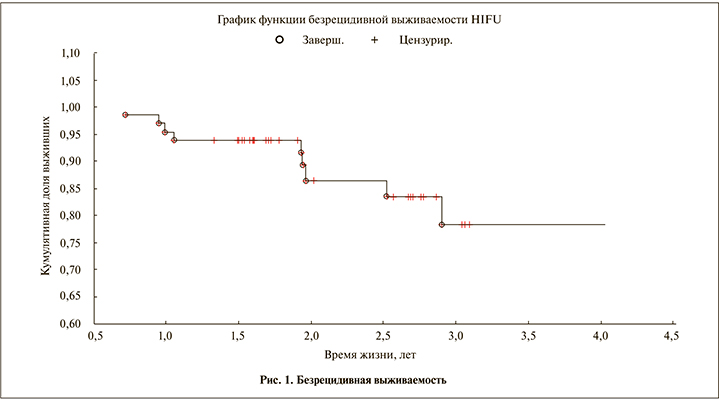
Проведенный статистический анализ выявил наличие корреляционной зависимости безрецидивной выживаемости пациентов от уровня предоперационного ПСА (г=0,63, р<0,02).
Показатель общей выживаемости за 3 года составил 83% (рис. 2).
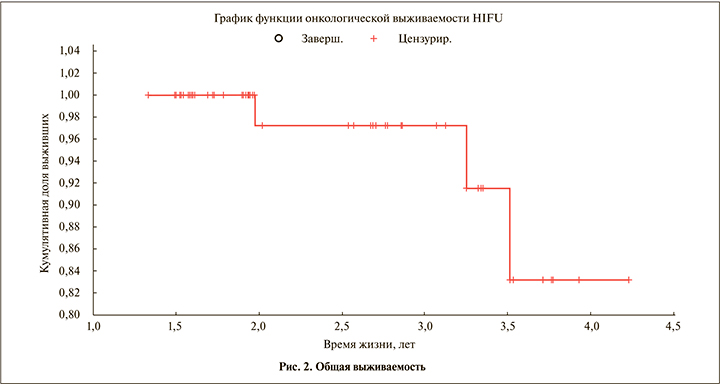
Полученные показатели общей и безрецидивной выживаемости позволяют говорить о довольно высокой эффективности HIFU-терапии больных локализованным РПЖ.
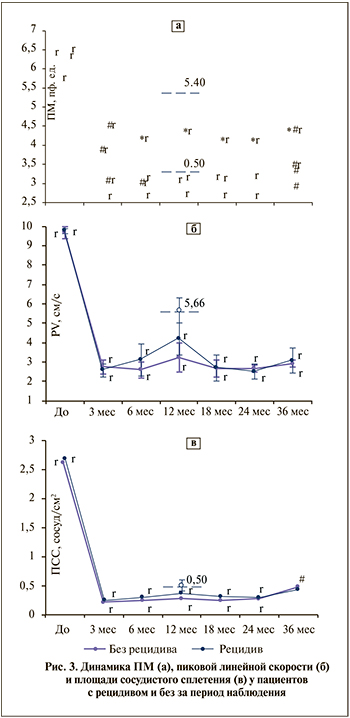 Показатели микроциркуляции. При анализе ЛДФ-грамм до сеанса HIFU у пациентов с РПЖ выявлено значительное снижение основных параметров микрокровотока в точке проекции органа.
Показатели микроциркуляции. При анализе ЛДФ-грамм до сеанса HIFU у пациентов с РПЖ выявлено значительное снижение основных параметров микрокровотока в точке проекции органа.
Через 3 мес. после сеанса HIFU наблюдали резкое снижение основных параметров микрокровотока (в 1,4–1,7 раза) при сохранении значительной вариабельности индивидуальных значений (рис. 3). Отмечено существенное снижение микроциркуляции после HIFU у пациентов с рецидивом и без, причем в наибольшей степени они касались ПМ, в связи с чем данный показатель был выбран для сравнительного анализа.
У пациентов без рецидива с 6-месячного срока фиксировали минимальные значения ПМ с небольшим постепенным ростом к концу периода мониторинга. У большинства пациентов с выявленным в последующем рецидивом основные параметры микроциркуляции после первичного снижения в определенный момент времени значительно возросли; начиная с 6-го месяца средние значения ПМ достоверно превзошли соответствующие показатели пациентов без рецидива.
Максимальный рост и наибольшие различия зафиксированы через 12±3 мес. после HIFU-терапии, совпав по времени с регистрацией 46% рецидивов РПЖ, при этом среднее значение ПМ в срок, предшествовавший выявлению рецидива (5,40±0,92 перф. ед.), значительно превосходило данные послеоперационного мониторинга всех пациентов (p<0,001) (см. рис. 4, а).
Ранее проведенное исследование показало, что улучшение микроциркуляции в ПЖ сопряжено с высоким риском рецидивирования. Патент № 2658460 [22]. Как следует из диаграмм, пациенты с выявленным через год рецидивом имели увеличение показателей ЛДФ уже через 3 мес. после лечения. В дальнейшем данные показатели прогрессивно увеличивались.
Патоморфологические признаки рецидива РПЖ. При косвенной оценке объема опухоли в материале мультифокальной биопсии ПЖ медианное значение относительной доли позитивных биопсийных столбиков у пациентов с рецидивом составило 66,7% и достоверно превышало соответствующее значение у пациентов без рецидива (20,0%; p=0,002).
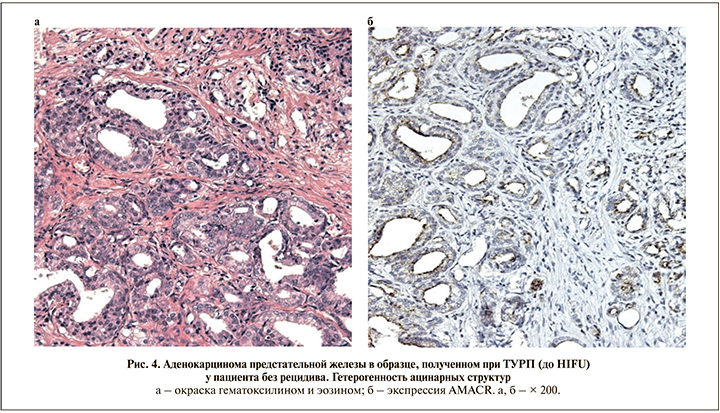
Установлено, что у большинства (81%) пациентов без рецидива доля положительных образцов в дооперационном материале не превышала 40% (≤4 столбиков при 12-точечной биопсии), в то время как наличие рецидива в 80% случаев было ассоциировано с более высокими значениями данного показателя. Доля положительных образцов у пациентов с рецидивом была достоверно выше, чем доля образцов у пациентов без рецидива.
У большинства (87,5%) пациентов без рецидива в первичном материале выявлена умеренно дифференцированная аденокарцинома (≤3+4 балла по шкале Глисона), наблюдения с общей суммой 7 (4+3) баллов составили лишь 12,5% (рис. 4). У пациентов с рецидивом доля менее дифференцированных форм (4+3, 8 и 9) была значительно выше – 60% в сумме (p<0,01). При анализе гистологических характеристик основного компонента опухоли в образцах без рецидива доминировали мелкоацинарные структуры (83,3% РПЖ-позитивных образцов), во многих наблюдениях характеризовавшиеся гетерогенностью архитектурных и цитологических параметров. В оставшихся случаях на первый план выходили плохо сформированные железы 4-й градации.
В случаях с рецидивом доля мелкоацинарных структур как основного компонента снижалась (37,7%), более чем в половине биоптатов (62,3%) на первый план выходили плохо сформированные и слившиеся железы, а также криброзные комплексы (рис. 5). Последние отмечены в 16,9% биоптатов в качестве ведущего компонента и еще в 6,5% – в качестве вторичного, при этом в материале пациентов без рецидива они полностью отсутствовали (p<0,001). Таким образом, в наших наблюдениях даже небольшое содержание криброзных элементов было в 100% случаев сопряжено с развитием местного рецидива после HIFU-терапии.
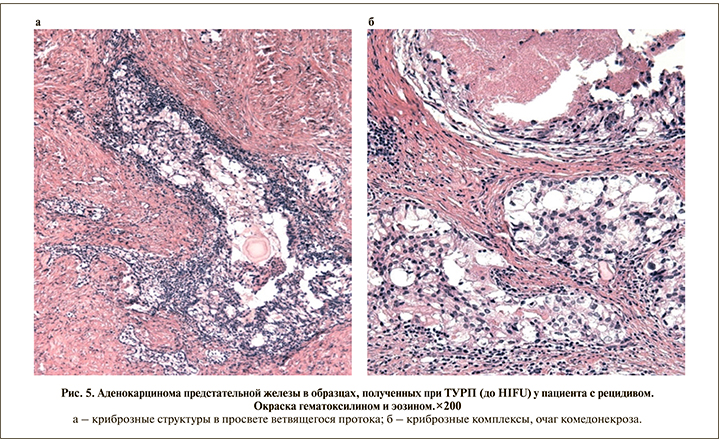
Среди других гистологических маркеров неблагоприятного прогноза, встречавшихся в первичном материале в единичных случаях, но всегда сопровождавшихся рецидивированием РПЖ после лечения, необходимо упомянуть внутрипротоковую карциному простаты, диагностированную в 5% образцов, а также периневральную инвазию (6,5%). В 10,4% случаев отмечены элементы пенисто-клеточной аденокарциномы, которая относится к редким формам РПЖ с промежуточным или высокоагрессивным течением.
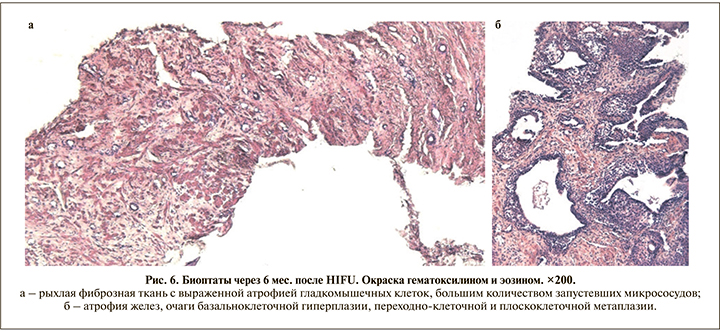
Основу биоптатов после HIFU без рецидивов составляет фиброваскулярная ткань с небольшим количеством желез преимущественно атрофического типа, в ряде случаев – с выраженной базальноклеточной гиперплазией, очагами или крупными полями некротизированных бесструктурных масс, умеренной диффузной и выраженной очаговой лимфогистиоцитарной инфильтрацией, атрофией и редукцией элементов гладкомышечного каркаса (рис. 6).
Обсуждение. Данное исследование демонстрирует положительное воздействие HIFU в лечении пациентов с локализованным РПЖ. Отсутствие массы побочных эффектов, короткий период госпитализации и высокая эффективность позволяют считать HIFU-терапию альтернативным методом лечения [23].
Прогноз лечения зависит от степени онкологического риска, который устанавливается по данным обследования. Чем меньше агрессия опухоли и ее распространенность в простате, тем лучше результаты лечения методом HIFU [24].
Как показал анализ результатов мониторинга, повышение послеоперационных уровней ПСА, показателей ЛДФ в точке проекции ПЖ в период 6–36 мес. после ультразвукового воздействия сопряжено с существенным увеличением вероятности выявления рецидива РПЖ при морфологическом исследовании.
К существенным факторам, определившим вероятность сохранения опухолевых клеток после воздействия HIFU, относятся особенности самой опухоли. Прогрессирование РПЖ ассоциировано с высокими показателями ее объема, выявлением менее дифференцированных форм, наличием криброзных комплексов. Значимая ассоциация между присутствием крибриформных структур и развитием рецидива подтверждает современные данные об особом прогностическом значении криброзного подтипа аденокарциномы ПЖ [24] и указывает на целесообразность его специального учета для выделения пациентов с повышенным риском прогрессирования.
Роль опухоль-ассоциированного ангиогенеза в прогрессировании РПЖ остается предметом дискуссий [25, 26]. По нашим данным, численная плотность микрососудов первичной опухоли не коррелирует со степенью ее дифференцировки и отрицательно ассоциирована с выявлением рецидива после сеанса HIFU. Это может указывать на то, что более васкуляризованные опухоли, рост которых в большей степени зависит от микроциркуляторных факторов, характеризуются и большей чувствительностью к обусловленным HIFU нарушениям микрогемодинамики.
Существует мнение, будто разрушение сосудов при воздействии HIFU может играть значительную роль в процессах вторичного повреждения опухолевых клеток [27]. У пациентов без рецидива на фоне резкого уменьшения объема неопухолевых желез численная плотность микрососудов в их зоне, а также параметры ЛДФ значительно снижались по сравнению с исходными показателями. Сохранение и даже усиление микроциркуляции в зоне неопухолевой паренхимы в случаях с рецидивом могут быть связанными как с недостаточной эффективностью абляции, так и с проангиогенным действием резидуальных неопластических элементов и ассоциированных с ними реактивных процессов.
Заключение. Таким образом, HIFU-терапия считается эффективным методом лечения, с помощью которого удается добиваться некроза ПЖ с минимальным повреждающим воздействием на окружающие ткани. В настоящем исследовании наилучшие результаты были достигнуты пациентами группы низкого онкологического риска.
Ультразвуковая абляция приводит к резкому снижению основных параметров микроциркуляции. Метод ЛДФ позволяет выявлять изменения основных параметров микроциркуляции уже на ранних сроках после HIFU и прогнозировать развитие рецидива РПЖ.
По данным комплексного патоморфологического анализа, воздействие фокусированного ультразвука на ткань ПЖ приводит к массивному коагуляционному некрозу и запуску мозаично протекающих деструктивных и регенераторных процессов, в исходе которых большая часть пролеченной зоны замещается пролиферирующей фиброзной тканью, при этом отмечается полный регресс опухоли или уменьшение числа позитивных столбиков.
Прогрессирование РПЖ после HIFU-терапии значимо ассоциировано с морфологическими характеристиками первичных биоптатов – высокими показателями объема опухоли и объемной плотностью опухолевых структур, выявлением менее дифференцированных форм с суммой Глисона ≥4+3, наличием криброзных комплексов.
По данным клинико-функционального анализа, повышение концентрации ПСА, показателя микроциркуляции и пиковой линейной скорости кровотока сопряжено с существенным увеличением вероятности выявления рецидива РПЖ при морфологическом исследовании.



