Эректильная дисфункция (ЭД) – это распространенное заболевание, которым в Российской Федерации страдают около 48,9% мужчин в возрасте 20–77 лет [1].
История фаллоэндопротезивания насчитывает более 80 лет, немалый вклад в ее развитие внесли советские урологи [2, 3]. Так, в 1936 г. профессор Н. А. Богораз впервые в мире осуществил имплантацию реберного хряща в ранее сформированный из кожи живота неофаллос для придания ему достаточной ригидности [4]. Первое эндопротезирование синтетическим материалом в Советской России выполнено в 1963 г. В. Калнберзом, который использовал уникальные Х-образные силиконовые имплантаты, изготовленные по собственной авторской методике [5].
Имплантация фаллопротеза – это хорошо зарекомендовавший себя метод лечения эректильной дисфункции с высокими показателями удовлетворенности как среди пациентов, так и среди их партнеров [6]. Также показано, что среди пациентов, перенесших радикальную простатэктомию, те, кому впоследствии был имплантирован фаллопротез, обладали менее выраженной тревожностью по сравнению с теми, кому фаллопротезирование не выполнялось [7]. Показания к имплантации: неэффективность медикаментозной терапии, невозможность ее применения в связи с наличием противопоказаний, а также желание пациента. К наиболее частым осложнениям имплантации фаллопротеза относятся перипротезная инфекция и механическая неисправность имплантата. Менее частые осложнения включают проксимальную и дистальную перфорацию кавернозных тел, кроссовер, повреждение уретры, мочевого пузыря, крупных сосудов; гипермобильность головки, образование гематомы мошонки, эрозия компонентов протеза, некроз головки полового члена. В совокупности об осложнениях сообщается менее чем в 5% случаев, отчасти из-за стандартизации хирургической техники и улучшения конструкции устройств [8].
Трехкомпонентный фаллопротез, который включает цилиндры, помпу и резервуар, показывает наивысший уровень удовлетворенности со стороны пациентов и в настоящее время наиболее широко используем. При фаллопротезировании через пеноскротальный и инфрапубикальный доступы установка резервуара выполняется вслепую, что для неопытного хирурга может оказаться непростым и стрессовым этапом операции. Как показал Henry et al. в своем исследовании на трупах [9], наружное паховое кольцо находится всего в 2,5–4,0 см от наружной подвздошной вены, в 5,3–8,0 см от опорожненного мочевого пузыря и в 2–4 см от наполненного мочевого пузыря. Ранение крупных сосудов является тяжелым и жизнеугрожающим осложнением, которое требует незамедлительных и слаженных действий операционной бригады.
Мы представляем клиническое наблюдение интраоперационного ранения подвздошных сосудов во время имплантации трехкомпонентного фаллопротеза, а также последовавшей за этим цепью событий.
Клиническое наблюдение
Пациент 58 лет, перенесший в 2019 г. лапароскопическую радикальную простатэктомию с тазовой лимфаденэктомией без сохранения нервных пучков, обратился в нашу клинику в мае 2021 г. в связи с сохранением жалоб на отсутствие эрекции после операции. Из анамнеза также известно, что пациент около 30 лет назад перенес аппендэктомию, страдает хроническим гастритом и язвенной болезнью 12-перстной кишки в стадии ремиссии.
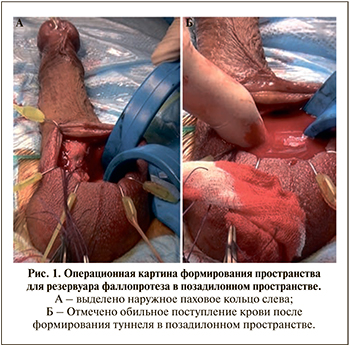
В апреле 2021 г. после проведения принятой в клинике предоперационной подготовки пациент поступил для имплантации трехкомпонентного фаллопротеза AMS-700 LGX IhibiZone. Выбранный доступ – пеноскротальный. Выполнены корпоротомии, бужирование и измерение длины кавернозных тел. Подготовлены компоненты фаллопротеза. С учетом наличия келоидного рубца в правой подвздошной области после перенесенной открытой аппендэктомии принято решение об установке резервуара в левую подвздошную область. После предварительного опорожнения мочевого пузыря тупым путем при помощи носового зеркала (nasal speculum) в области левого наружного пахового кольца со второй попытки ввиду ее выраженного уплотнения перфорирована поперечная фасция и сформирован туннель в позадилонном пространстве (рис. 1А). При этом отмечено поступление темной крови из выполненного туннеля (рис. 1В). Кровотечение остановлено тугим тампонированием. С целью ревизии, остановки кровотечения и открытой установки резервуара выполнен разрез в левой паховой области. При удалении тампонов и пальцевой ревизии отмечено обильное поступление венозной крови через наружный паховый канал. Кровотечение остановлено тугим тампонированием, прижатием. Доступ к паховой области продлен вверх путем выполнения параректальной лапаротомии слева. В левой подвздошной области отмечен выраженный рубцовый процесс после ранее перенесенной простатэктомии. После выделения наружной подвздошной вены перед местом ее впадения в бедренный канал визуализирован дефект стенки по передней поверхности около 7 мм. С учетом опыта сосудистой хирургии (кавотомия при тромбэктомии, ушивание ранений подвздошных сосудов при открытой тазовой лимфаденэктомии) оперирующим хирургом принято решение о самостоятельном ушивании дефекта вены. На вену наложено два зажима типа «бульдог» дистальнее и проксимальнее дефекта. Дефект вены герметично ушит непрерывным швом пролен 5/0. Диаметр вены сужен на 25%. Паравезикально в брюшную полость установлен резервуар фаллопротеза, заполнен стерильным физиологическим раствором. Выполнена имплантация цилиндров в кавернозные тела, в мошонку установлена помпа. Соединены патрубки резервуара и помпы. Установлен дренаж в брюшную полость к зоне ушивания подвздошных сосудов. С целью профилактики грыжеобразования предбрюшинно установлен сетчатый имплант. Объем кровопотери составил 200 мл.
В тот же день при дуплексном сканировании выявлен окклюзивный тромбоз вен левой нижней конечности. При сканировании легких: КТ-картина двусторонней долевой и сегментарной тромбоэмболии легочных артерий (ТЭЛА). Индекс тяжести ТЭЛА – класс PESI 1, менее 65 баллов. Назначена постоянная инфузия раствора гепарина натрия в дозе 1500 ЕД в час, на фоне которой через несколько часов отмечена диффузная кровоточивость, образование гематом мошонки, передней брюшной стенки. Объем отделяемого по дренажу за 1-е сутки составил 500 мл.
На следующий день пациенту выполнена имплантация кавафильтра ниже устьев почечных вен, замена антикоагулянтной терапии на эноксапарин натрия 0,8 мл 2 раза в сутки. В связи с развитием острой постгеморрагической анемии и явлений гипокоагуляции пациенту проведена трансфузия двух доз эритроцитарной взвеси и двух доз свежезамороженной плазмы. Дренаж удален на 5-е сутки. На фоне положительной динамики в виде реканализации тромбоза вен и КТ-картины разрешения тробмоэмболии легочных артерий пациент выписан на 12-е сутки после операции в удовлетворительном состоянии.
Спустя месяц пациент вновь обратился в клинику с жалобами на общую слабость, тошноту, повышение температуры тела до 39,2оС. При осмотре явных признаков перипротезной инфекции обнаружено не было. При дообследовании выявлено расширение чашечно-лоханочной системы слева и верхней и средней третей левого мочеточника (рис. 2). Клиническая картина расценена как обструктивный пиелонефрит слева. Причиной обструкции послужила гематома, образовавшаяся вокруг баллона фаллопротеза. Пациенту выполнена установка внутреннего мочеточникового стента слева и назначена антибактериальная терапия.
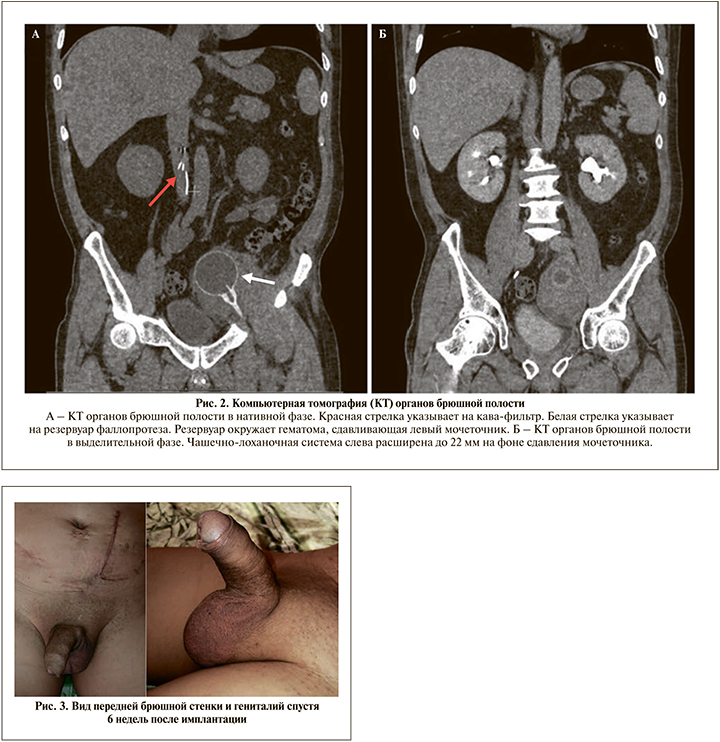
Через 3 мес. при повторном обследовании в августе 2021 г. размеры гематомы значительно уменьшились, принято решение об удалении мочеточникового стента. После удаления стента, расширения чашечно-лоханочной системы боли в поясничной области не наблюдалось.
Фаллопротез был активирован через 6 нед. после имплантации (рис. 3). Стоит отметить, что вышеописанные события не повлияли на функционирование устройства и спустя 8 мес. после имплантации пациент остался доволен результатом.
Специфические неинфекционные осложнения, связанные с установкой резервуара фаллопротеза, включают формирование грыжи резервуара, его пальпируемость, утечку жидкости, эрозию мочевого пузыря и аутоинфляцию. Интраоперационно существует риск перфорации мочевого пузыря, ранения сосудов, а также непреднамеренной установки резервуара в брюшную полость. Частота осложнений, связанных с имплантацией резервуара, по данным разных авторов, колеблется от 0,4 до 3,2% [10].
Сосудистые осложнения фаллопротезирования достаточно редки, в литературе представлено шесть случаев сдавления подвздошных сосудов резервуаром с последующим развитием отека нижней конечности [11–17], а также одно наблюдение ранения наружной поверхностной половой вены [11].
Не только установка, но и удаление резервуара в случаях механической неисправности или инфекции ассоциированы с риском ранения крупных сосудов и жизнеугрожающим кровотечением [11]. В отсутствие признаков перипротезной инфекции с целью минимизации риска осложнений применима тактика «drain and retain» – опорожнить резервуар и оставить его в позадилонном пространстве не удаляя [18]. Lane et al. провели ретроспективный анализ 115 пациентов, перенесших радикальную простатэктомию, которым впоследствии был имплантирован трехкомпонентный фаллопротез с установкой резервуара в позадилонное пространство традиционным способом – через пеноскротальный доступ. Не было отмечено ни одного интраоперационного осложнения, в том числе ранения мочевого пузыря и крупных сосудов. Таким образом, радикальная простатэктомия в анамнезе сама по себе не повышает риска осложнений, связанных с установкой резервуара, и не является противопоказанием к стандартной технике имплантации резервуара фаллопротеза [19].
Противопоказанием к слепой установке резервуара было предложено считать перенесенную в анамнезе радикальную цистэктомию, двустороннюю пластику паховых грыж с использованием сетчатого импланта, трансплантацию почки, а также выраженные фибротические изменения позадилонного пространства, возникающие вследствие затека в области уретро-везикального анастомоза [14]. С целью минимизации риска осложнений, связанных с традиционной установкой резервуара в Ретциево пространство, предложено несколько вариантов эктопической установки резервуара.
Под эктопической установкой подразумевается размещение резервуара фаллопротеза за пределами позадилонного пространства. Первые данные об эктопической установке в 1981 г. представил Riemenschneider, который описал размещение резервуара между брюшиной и мускулатурой брюшной стенки через дополнительный разрез передней брюшной стенки [20]. В 1990-х гг. профессор Шрайтер из Германии популяризировал установку резервуара фаллопротеза в брюшную полость. Гидравлические фаллопротезы в те годы не имели затворного клапана. Вокруг резервуара, размещенного в брюшной полости, не формируется капсула, поэтому методика Шрайтера позволяла избегать случаев аутоинфляции, которые встречались при размещении резервуаров в традиционном месте. Несмотря на то что его данные никогда не публиковались, техника Шрайтера была принята практически всеми немецкими имплантологами и использовалась в течение многих лет [21]. В 2010 г. Hartman et al. опубликовали работу, в которой предложили имплантировать резервуар латерально в забрюшинном пространстве через дополнительный доступ над передней верхней подвздошной остью [22]. По данным авторов, у 31 пациента группы латеральной забрюшинной имплантации резервуара не было как интраоперационных, так и послеоперационных осложнений при медиане наблюдения около 2 лет.
С появлением новых клапанных механизмов фаллопротезов и низкопрофильных резервуаров эктопическая установка резервуара приобрела большую популярность за последнее десятилетие. В 2011 г. Perito и Wilson описали эктопическое размещение резервуара через инфрапубикальный доступ, при котором при помощи носового зеркала (nasal speculum) формируется пространство либо кзади, либо кпереди от поперечной фасции [23]. В 2014 г. Stember et al. предоставили анализ данных 2686 пациентов, прооперированных при помощи этой техники [24]. В группе пациентов с резервуаром, имплантированным кзади от поперечной фасции (n=2239), у 2 (0,09%) пациентов интраоперационно произошло ранение мочевого пузыря, у 2 (0,09%) сразу после операции наблюдался стойкий кашель и развилась грыжа резервуара, у 21 (0,94%) пациента развилась инфекция имплантата, потребовавшая его удаления. В группе пациентов с резервуаром, имплантированным кпереди от поперечной фасции (n=447), 2 (0,45%) пациентам, обеспокоенным пальпируемым резервуаром, потребовалось проведение ревизионной операции. Еще 15 (3,4%) пациентов ощущали резервуар в раннем послеоперационном периоде, но были удовлетворены им спустя 6 мес. и не обращались за дополнительной коррекцией. У 6 (1,34%) пациентов образовалась грыжа резервуара в паховый канал. Им была проведена дополнительная операция по перемещению резервуара выше вдоль брюшной стенки. У 6 (1,34%) пациентов развилась инфекция имплантата, потребовавшая его удаления. Впоследствии авторы модифицировали свою технику, накладывая викриловый шов для закрытия входа в резервуарное пространство, что призвано снижать риск образования грыжи баллона [24].
Поместив резервуар на 15–20 см выше наружного пахового кольца, Morey впервые применил технику высокой подмышечной установки резервуара [25]. Резервуар располагается под брюшком прямой мышцы живота, что уменьшает пальпируемость баллона и ассоциировано с высокой удовлетворенностью пациентов на уровне 96% [26].
Garber et al. недавно предоставили данные 50 пациентов, перенесших имплантацию фаллопротеза с преднамеренной установкой резервуара под наружную косую мышцу живота. Резервуары были размещены через пеноскротальный доступ, через паховое кольцо с использованием легочного зажима Ферстера для создания пространства выше и латеральнее семенного канатика. В течение периода наблюдения 6,6 мес. из осложнений, связанных с резервуаром, отмечена только незначительная пальпируемость резервуара у 1 (2%) пациента [27]. Та же группа авторов описала подкожное размещение резервуара у пациентов с ожирением, телосложение которых препятствовало доступу к паховому каналу для размещения резервуара в позадилонное пространство или высоко под прямую мышцу живота. Восемь пациентов перенесли подкожную имплантации резервуара без сопутствующих механических неисправностей или формирования грыж [28].
Представленное нами клиническое наблюдение иллюстрирует редкое, но крайне опасное осложнение, с которым может столкнуться любой уролог, занимающийся фаллопротезированием. Продемонстрированы возможные последствия данного осложнения как в раннем, так и в более отдаленном послеоперационном периодах. Однако именно готовность к встрече с такими осложнениями, знания анатомии, современных протезов и альтернативных методик имплантации, а также слаженная работа в команде служат залогом успешного исхода любой операции.



