Введение. Термином «гиперактивный мочевой пузырь» (ГМП) обозначают симптомокомплекс, проявляющийся императивными позывами на мочеиспускание, с ургентным недержанием мочи или без него и обычно сопровождающийся учащением мочеиспускания и ноктурией [1]. ГМП занимает одно из наиболее важных мест в ряду всех дисфункций нижних мочевыводящих путей. Значимость ГМП определяется как ее высокой частотой, так и существенным ухудшением качества жизни больных. При этом ГМП влияет на все стороны жизни человека – социальную, семейную, профессиональную и сексуальную [2, 3]. Степень снижения качества жизни зависит от выраженности симптоматики ГМП, в частности наличия ургентного недержания мочи [3].
Большинство исследователей оценивают распространенность ГМП в пределах 15–20% среди всех взрослых [4, 5]. Частота ГМП выше у женщин и увеличивается с возрастом [4, 6]. Результаты эпидемиологического исследования [7] показали, что в России распространенность ГМП среди мужчин составляет 18%, среди женщин – 28%.
Большая встречаемость ГМП и оказываемое отрицательное влияние на качество жизни обусловливают то значительное внимание, которое уделяют ему не только урологи, но и врачи других специальностей. Ведущую роль в лечении пациентов с ГМП играет медикаментозная терапия [8]. За последние 40 лет для лечения ГМП предложено значительное количество лекарственных средств, в основном относящихся к группе М-холиноблокаторов. Несмотря на то что в последние годы в клинической практике активно используются препараты других групп, в частности β3-адреномиметики [9], антихолинергическая терапия остается основной в лечении больных ГМП [10–12]. Эффект М-холиноблокаторов обусловлен блокированием М-холинорецепторов, находящихся в мочевом пузыре. Всего идентифицировано 5 субтипов М-холинорецепторов, два из которых находятся в мочевом пузыре: М2- и М3-субтипы в соотношении 3 : 1 [13]. Несмотря на преобладание в мочевом пузыре М2-холинорецепторов, доказано, что именно М3-холинорецепторы опосредуют сокращение детрузора [13]. М-холинорецепторы располагаются также в ганглиях, секреторных железах, миокарде, гладких мышцах. Поскольку на сегодняшний день отсутствуют абсолютно селективные к мочевому пузырю М-холиноблокаторы, прием этих препаратов может приводить к развитию нежелательных явлений, обусловленных генерализованной блокадой мускариновых рецепторов. Самым часто встречающимся побочным эффектом М-холинолитической терапии является сухость во рту, реже наблюдаются запоры, тошнота, диарея, головокружение, сонливость и нарушение зрения. Эти побочные эффекты носят дозозависимый характер и прекращаются без каких-либо последствий после окончания лечения [14, 15].
Одним из современных антихолинергических препаратов для лечения ГМП является имидафенацин. Препарат показал in vitro высокий аффинитет к М3- и М1-холинорецепторам и большую селективность к мочевому пузырю, чем к слюнным железам [16]. Имидафенацин быстро абсорбируется и экскретируется после перорального применения с мочой более чем на 65% [17]. Блокируя М-холинорецепторы, имидафенацин снижает сократительную активность детрузора, кроме того, он способен ингибировать механосенситивную афферентную активность С-волокон мочевого пузыря, уменьшая таким образом его чувствительность [18].
К настоящему времени получены результаты 22 клинических исследований применения имидафенацина в лечении ГМП (14 исследований I фазы, 2 исследования II фазы, 5 исследований III фазы и 1 исследование IV фазы), которые проводились в Нидерландах, Японии, Великобритании, Южной Корее, и описываемое нами исследование в России.
В работе [19] показано, что эффект имидафенцина дозозависим, а лучшее соотношение эффективности и безопасности наблюдается при назначении дозы 0,2 мг в сутки. В других исследованиях установлено, что в отношении улучшения симптоматики ГМП имидафенацин не уступает широко применяемым в настоящее время М-холиноблокаторам, при этом превосходя многие из них по переносимости лечения [20–23]. Назначение имидафенацина повышало эффективность лечения мужчин с симптомами нижних мочевыводящих путей вследствие доброкачественной гиперплазии предстательной железы (ДГПЖ) без ухудшения переносимости терапии [24, 25]. Установлено, что имидафенацин не влияет на когнитивную функцию пациентов, в том числе при длительном применении, поэтому может назначаться пожилым больным и пациентам с нарушением ментального статуса [26].
Целью настоящего исследования стало сравнение эффективности и безопасности имидафенацина и толтеродина при лечении пациентов с ГМП.
Материалы и методы. Проведено многоцентровое открытое рандомизированное сравнительное клиническое исследование III фазы по применению нового антимускаринового препарата имидафенацин для лечения ГМП. Исследование выполнено в 2017 г. в 12 урологических центрах Российской Федерации. В качестве препарата сравнения использовали антихолинергический препарат толтеродин. Исследование проведено в соответствии с этическими принципами Хельсинкской декларации Всемирной медицинской ассоциации (2013), трехсторонним соглашением по Надлежащей клинической практике (ICH GCP) и регламентировано действующим законодательством РФ.
В исследование включали больных обоего пола в возрасте от 18 до 65 лет с ГМП продолжительностью не менее 3 мес., подписавших информированное согласие на участие в клиническом исследовании, у которых, по данным дневников мочеиспускания, было не менее 5 эпизодов ургентного недержания мочи в 1 нед., более 8 мочеиспусканий в сутки, не менее одного императивного позыва на мочеиспускание в сутки, а оценка по результатам заполнения опросника для оценки симптомов гиперактивного мочевого пузыря (OAB Awareness Tool) составила 8 баллов или более.
Критерии исключения:
- наличие в анамнезе гиперчувствительности или подозрение на гиперчувствительность к толтеродину или имидафенацину;
- структурная патология мочевого пузыря, включая рак мочевого пузыря, камни мочевого пузыря, интерстициальный цистит;
- объем остаточной мочи 100 мл и более по данным УЗИ мочевого пузыря;
- стрессовое недержание мочи;
- оперативные вмешательства на мочевом пузыре, предстательной железе или уретре в течение предшествовавших 6 мес.;
- гинекологические заболевания в острой фазе, в том числе эндометриоз, миома матки размером более 3 см;
- рак предстательной железы;
- заболевания предстательной железы с клинически значимым нарушением уродинамики;
- воспалительные заболевания почек, мочевыводящих путей и предстательной железы;
- прием лекарственных препаратов, влияющих на функцию мочевыводящих путей, менее чем за 1 мес. до начала лечения;
- закрытоугольная форма глаукомы;
- наличие противопоказаний к антихолинергической терапии;
- ботулинотерапия ГМП в анамнезе;
- уровень ПСА выше 4 нг/мл;
- болезнь Паркинсона и другие неврологические заболевания, влияющие на функцию нижних мочевыводящих путей;
- почечная, печеночная недостаточность, гипертиреоидизм, сердечно-сосудистая недостаточность и другие состояния, препятствующие участию в исследовании;
- беременность и/или кормление грудью.
Всего в настоящее исследование скринированы 327 больных, из которых рандомизированы 300. Четверо пациентов были исключены из статистического анализа (1 пациент прекратил участие в исследовании после рандомизации и до начала терапии, 3 пациента были исключены из анализа по причине нарушения протокола исследования). Таким образом, в настоящем клиническом исследовании проведен анализ результатов лечения 296 больных (245 женщин и 51 мужчина). Все пациенты путем рандомизации были распределены на 2 группы. В 1-ю (n=148) вошли 124 (83,8%) женщины и 24 (16,2%) мужчины, их средний возраст составил 47,2±13,5 лет. Вторую группу (n=148) составили 121 (81,8%) женщина и 27 (18,2%) мужчин, средний возраст – 46,6±13,5 лет. Группы были сопоставимыми по возрасту, полу и значимым сопутствующим и перенесенным заболеваниям.
Пациенты 1-й группы получали имидафенацин внутрь по 1 таблетке (0,1 мг) 2 раза в сут. (суточная доза – 0,2 мг). Во 2-й группе назначали препарат сравнения М-холиноблокатор толтеродин внутрь по 1 таблетке (2 мг) также дважды в сутки (суточная доза – 4 мг). Продолжительность лечения составила 12 нед. Протоколом исследования для каждого больного было предусмотрено 6 посещений лечащего врача – скрининговый визит (7 дней до начала лечения), визит рандомизации, 2-я, 4-я, 8-я и 12-я недели лечения. Для оценки соответствия критериям включения и выявления критериев исключения на скрининговом визите всем больным выполняли клинический и биохимический анализы крови, серологическое исследование для выявления маркеров ВИЧ, гепатитов В и С, общий анализ мочи, УЗИ почек и мочевого пузыря с определением объема остаточной мочи, ЭКГ, анализ крови на ПСА (у мужчин) и тест на беременность (у женщин), проводили кашлевой тест. Эффективность проводимого лечения оценивали на основании анализа дневников мочеиспускания и опросников OAB Awareness Tool и EQ-5D. Дневники мочеиспускания больные заполняли в течение 7 сут. до очередного визита (за исключением скринингового) и регистрировали частоту мочеиспускания, императивных позывов и ургентного недержания мочи в дневное и ночное время. Опросники OAB Awareness Tool, которые позволяют оценить выраженность симптоматики ГМП, больные заполняли на каждом визите, а анкеты качества жизни EQ-5D – на визитах рандомизации и 12-я неделе лечения. В качестве первичного критерия эффективности лечения рассматривали изменение среднесуточного количества эпизодов мочеиспускания по прошествии 12 нед. лечения по сравнению с показателем на начало лечения. Вторичными критериями эффективности лечения были изменение среднесуточного, среднедневного (7.00–23.00) и средненочного (23.00–7.00) количества эпизодов ургентного недержания мочи к 2-й, 4-й, 8-й и 12-й неделям по сравнению с визитом начала лечения, изменение среднего количества эпизодов ургентного недержания мочи в неделю по прошествии 12 нед. по сравнению с визитом начала лечения, изменения среднего среднесуточного количества эпизодов мочеиспускания к 2-й, 4-й и 8-й неделям по сравнению с исходным показателем, изменения оценки симптомов ГМП по шкале OAB Awareness Tool на визитах 2-й, 4-й, 8-й и 12-й недель по сравнению с исходным значением и изменения уровня оценки качества жизни по опроснику EQ-5D на визите 12-й недели по сравнению с визитом начала лечения.
Оценку безопасности применения исследуемых препаратов проводили на основании частоты развития нежелательных явлений (НЯ), в том числе приведших к прекращению лечения/выбытию из исследования, изменению объема остаточной мочи по данным УЗИ, изменению лабораторных показателей и параметров ЭКГ. Объем остаточной мочи оценивали на каждом визите, лабораторные исследования и ЭКГ выполняли до начала лечения и после его окончания.
Для обработки и анализа материалов исследования были использованы общепринятые методы параметрической и непараметрической статистики. Все переменные эффективности и безопасности были обобщены с помощью описательной статистики. При этом непрерывные переменные анализировались с использованием количества непропущенных наблюдений, среднего, стандартного отклонения или стандартной ошибки, минимума, медианы, максимума, а категориальные переменные – абсолютной и относительной частоты. Основные показатели эффективности лечения – изменения частоты мочеиспускания и среднего числа эпизодов недержания в сут. в процессе лечения по сравнению с исходным – оценивали с помощью стратифицированного ковариационного анализа рангов (ANCOVA) для каждой разницы в парах в соответствующих группах лечения.
Результаты. Анализ результатов исследования показал эффективность назначения имидафенацина и толтеродина пациентам с ГМП. Среднесуточная частота мочеиспускания у больных 1-й и 2-й группп к 12-й неделе лечения оказалась достоверно ниже, чем до его начала (см. табл. 1). При этом выраженность снижения частоты мочеиспускания у пациентов обеих групп не различалась: не было отмечено различий в уменьшении интенсивности поллакиурии между больными 1-й и 2-й групп к 2-й (р=0,14; F=2,25), 4-й (р=0,34; F=0,99), 8-й (р=0,95; F=0,001) и 12-й (p=0,56, F=0,006) неделям лечения.

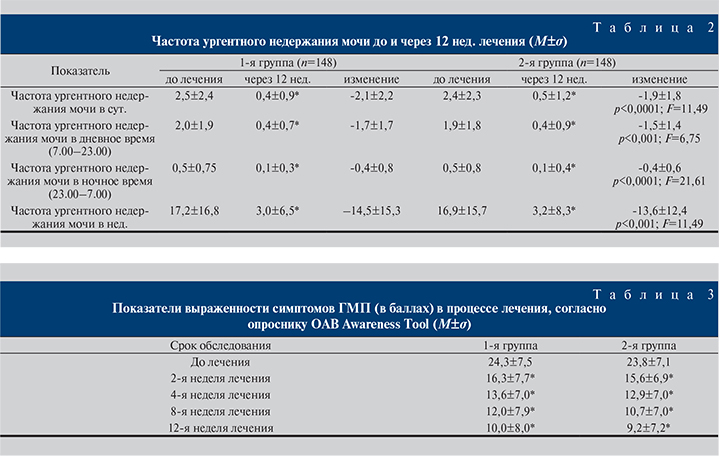
Как в 1-й, так и во 2-й группе лечение сопровождалось снижением частоты ургентного недержания мочи (см. табл. 2). В обеих группах к 12-й неделе лечения наблюдалось статистически значимое (p<0,001) снижение по сравнению с показателем до лечения среднесуточной частоты ургентного недержания мочи, частоты ургентного недержания мочи отдельно в дневное и ночное время, а также частоты ургентного недержания мочи в неделю. Однако степень снижения частоты ургентного недержания мочи у больных 1-й группы оказалась статистически значимо выше. Так, у пациентов 1-й группы выявлено более выраженное снижение по сравнению с больными 2-й группы среднесуточного количества эпизодов ургентного недержания мочи к 2-й (р<0,0001, F=16,49), 4-й (р=0,0236, F=5,18), 8-й (р<0,0001, F=17,92) и 12-й (p<0,0001, F=11,49) неделям лечения по сравнению с визитом начала терапии. Подобная тенденция отмечена для изменения частоты ургентного недержания мочи в дневное время (к 2-й неделе, p=0,0018, F=9,87; к 8-й, p=0,0449, F=4,06 и к 12-й неделям, p<0,001, F=6,75), в ночное время (к 2-й неделе, p=0,0004, F=12,69; к 4-й, p<0,0001, F=21,94; к 8-й, p<0,0001, F=38,78 и к 12-й неделям, p<0,0001, F=21,61). При анализе изменения частоты ургентного недержания мочи в нед. до и после окончания лечения также отмечено более выраженное снижение частоты этого показателя у пациентов, принимавших имидафенацин, по сравнению с больными, получавшими толтеродин (см. табл. 2).
При анализе результатов анкетирования по опроснику OAB Awareness Tool отмечено значимое снижение суммы баллов у пациентов обеих групп, причем это снижение оказалось статистически значимым уже к 2-й неделе лечения (см. табл. 3). При этом динамика показателя у пациентов 1-й и 2-й групп оказалась сопоставимой: по прошествии 12 нед. лечения среднее значение суммарного балла опросника OAB Awareness Tool снизилось на 14,2±8,5 в 1-й группе и на 14,5±8,0 – во 2-й (р>0,1).
Аналогичная динамика отмечена при оценке общего состояния здоровья по анкете EQ-5D (см. табл. 4). Полученные данные свидетельствуют об улучшении общего состояния здоровья и качества жизни пациентов обеих групп. При этом различий в степени изменений показателей анкеты EQ-5D между группами не выявлено (p>0,1). Переносимость лечения в обеих группах признана удовлетворительной. Всего было зарегистрировано 417 НЯ у 142 (48,0%) из 296 пролеченных больных. Подавляющее большинство НЯ (361, 86,6%) было легкой степени тяжести. Не было зарегистрировано ни одного серьезного НЯ.

Частота НЯ у пациентов 1-й и 2-й групп была схожей (см. табл. 5). Так, НЯ были отмечены у 70 (47,2%) больных 1-й группы и 72 (48,6%) – 2-й (p>0,5).
Наиболее частыми НЯ, связанными с приемом препаратов, были сухость во рту, тошнота, запор, диарея, головная боль и головокружение (см. табл. 5). Большинство НЯ разрешилось самостоятельно, ни в одном случае не требовали изменения дозы препарата или прекращения лечения. Важно отметить, что в процессе применения исследуемых препаратов мы не выявили значимых изменений лабораторных показателей, параметров ЭКГ и увеличения остаточной мочи.

Обсуждение. Анализ результатов исследования продемонстрировал клиническую эффективность препарата имидафенацин в уменьшении выраженности симптомов ГМП. Имидафенацин не в меньшей степени снижает частоту мочеиспускания по сравнению с хорошо известным препаратом толтеродин. При этом отмечена статистически значимая более высокая эффективность имидафенацина в отношении уменьшения количества эпизодов недержания мочи за сут., отдельно в дневное время и за нед. по сравнению с препаратом сравнения. Оба препарата имеют схожий профиль безопасности и переносимости.
Заключение. Учитывая результаты проведенного исследования, показавшие высокую эффективность и хорошую переносимость имидофенацина при лечении больных с ГМП, есть основания полагать, что появление нового лекарственного средства на российском рынке будет способствовать расширению возможностей в лечении таких больных.



