Введение. Гиперактивный мочевой пузырь (ГМП) – симптомокомплекс, включающий ургентные позывы к мочеиспусканию с эпизодами недержания мочи или без них, обычно сопровождающийся учащенным мочеиспусканием и ноктурией, в отсутствие доказанной инфекции мочевыводящих путей или очевидной органической патологии [1]. ГМП, вызванный установленными неврологическими нарушениями, относится к нейрогенным дисфункциям.
Нейрогенный гиперактивный мочевой пузырь развивается у пациентов с уровнем поражения центральной нервной системы выше ствола мозга, например больных с цереброваскулярной болезнью, деменцией, опухолями и травмами головного мозга, болезнью Паркинсона, церебральным параличом, рассеянным склерозом, а также при супрасакральных поражениях спинного мозга у пациентов с позвоночно-спинномозговой травмой, миелодисплазией, рассеянным склерозом и другими заболеваниями [2, 3].
Симптомы ГМП чрезвычайно распространены в популяции [4]. По данным исследования EPIC (2006), включившего более 19 тыс. участников, их испытывают 11,8% мужчин и женщин [5]. В возрастной группе старше 40 лет распространенность проявлений гиперактивного мочевого пузыря достигает 35,6% (EpiLUTS, 20 тыс. участников, 2011) [6]. Тем не менее причины развития ГМП в отсутствие неврологических нарушений остаются неизвестными. Потенциальными этиологическими факторами могут быть возрастные изменения детрузора, инфравезикальная обструкция, анатомические изменения положения мочеиспускательного канала, дефицит эстрогенов и др. [1, 7].
В основе симптомов ургентности, характерных для ГМП, лежит непроизвольное сокращение, или «гиперактивность», детрузора в фазу накопления мочи. Гиперактивность может быть объективно зарегистрированной при цистометрии наполнения в процессе комплексного уродинамического исследования (КУДИ) как спонтанное повышение детрузорного давления [8].
Клиническая картина гиперактивного мочевого пузыря далеко не всегда подтверждается выявлением непроизвольных сокращений детрузора в ходе уродинамического исследования. Согласно литературным данным, у 30–46% больных имеет место гиперактивный мочевой пузырь без детрузорной гиперактивности, так называемый сенсорный ГМП [9].
С учетом неоднородности пациентов с симптомами ГМП целью настоящего исследования стало выявление особенностей гиперактивности детрузора как уродинамического феномена в зависимости от этиологии нарушений мочеиспускания.
Материалы и методы. В исследование вошли 283 (61% женщин и 39% мужчин) пациента в возрасте от 18 до 82 лет (49,2±13,5), проходивших комплексное уродинамическое исследование на базе Свердловской областной клинической больницы № 1 в 2017–2020 гг. по поводу нейрогенного гиперактивного мочевого пузыря (n=197), идиопатического гиперактивного мочевого пузыря (ГМП) (n=41), лучевого цистита вне обострения (n=8) и синдрома хронической тазовой боли (СХТБ) (n=37). Критериями исключения были факторы, определявшие органический характер нарушений: доброкачественная гиперплазия предстательной железы, стриктура уретры, аномалии развития мочеполовой системы, выраженный пролапс тазовых органов у женщин.
Характеристика пациентов в зависимости от этиологии нарушений мочеиспускания представлена в табл. 1. У всех пациентов на момент исследования отсутствовали лабораторные признаки инфекции мочевыводящих путей.

КУДИ выполнялось с использованием уродинамической системы Triton (Laborie medical technologies) в соответствии с требованиями Международного общества по удержанию мочи (ICS) [10] и включало ретроградную цистометрию медленного наполнения (25 мл/мин) в положении сидя, исследование «давление–поток», профилометрию уретры, электромиографию мышц тазового дна.
При анализе графиков, отчетов и заключений, полученных в ходе уродинамических исследований, учитывали объем наполнения мочевого пузыря, при котором возникали первый, нормальный и сильный позывы к мочеиспусканию, максимальную цистометрическую емкость, наличие гиперактивности детрузора, объем мочевого пузыря, при котором возникало первое непроизвольное сокращение детрузора, максимальную амплитуду детрузорного давления при непроизвольном сокращении (гиперактивности), наличие ургентного недержания мочи.
Статистическую обработку данных осуществляли с помощью программного пакета SPSS 23.0 for Windows. Оценку статистической значимости различий проводили по t-критерию Стьюдента. Различия считались достоверными при р<0,05. Диагностическая значимость отклонений уродинамических параметров определялась по данным ROC-анализа. Для определения эффективности теста использовали показатель AUC (Area Under Curve).
Результаты. Среди неврологически здоровых пациентов, направленных на уродинамическое исследование с диагнозом «гиперактивный мочевой пузырь», гиперактивность детрузора в ходе цистометрии наполнения была выявлена в 63,4% случаев наблюдений, ургентное недержание мочи – в 12,2%. Максимальная цистометрическая емкость мочевого пузыря при идиопатической детрузорной гиперактивности составила 322±113 мл. У 38% больных была отмечена повышенная чувствительность мочевого пузыря при стабильном детрузоре и сохраненной емкости (453±56 мл; р=0,045).
Большая часть пациентов с синдромом хронической тазовой боли (85%) также продемонстрировали повышенную чувствительность мочевого пузыря, при этом гиперактивность детрузора была выявлена только у 2,7%. Различную уродинамическое картину имели пациенты с клиникой синдрома болезненного мочевого пузыря (интерстициального цистита) и другими вариантами СХТБ. У всех пациентов с проявлениями СБМП/интерстициального цистита наполнение мочевого пузыря в ходе цистометрии сопровождалось усилением боли в области мочевого пузыря, функциональная емкость была снижена до 185±113 мл (р=0,007), во всех случаях наполнение прекращали в связи с выраженной болью внизу живота или мочеиспускательном канале. Больные с другими типами СХТБ даже при наличии повышенной чувствительности мочевого пузыря могли накопить достаточный объем жидкости, цистометрическая емкость равнялась 427±84 мл (р=0,007).
Для лучевого цистита типичным было сочетание повышенной чувствительности мочевого пузыря (100%) и гиперактивности детрузора (75%) со снижением функциональной емкости и болевым синдромом, а также функциональной инфравезикальной обструкцией.
Частота выявления гиперактивности детрузора у больных нейрогенным мочевым пузырем варьировалась от 25 до 100%, ургентного недержания мочи от 8,3 до 75% в зависимости от этиологии НДНМП (табл. 2). При этом у пациентов с НДНМП, клинически имевших симптомы накопления, гиперактивность детрузора была диагностирована в подавляющем большинстве случаев (92,4%).

Наибольшая амплитуда детрузорной гиперактивности была отмечена в группе пациентов с повреждением спинного мозга (43,5±51,4 см Н2О), она достоверно превышала аналогичный показатель для пациентов с идиопатическими нарушениями (11,6±5,8; p=0,038), рассеянным склерозом (19,2±12,5; р=0,006), периферической полинейропатией (12,6±8,1; р=0,047), ВИЧ-инфекцией (9,6±7,5; р=0,027).
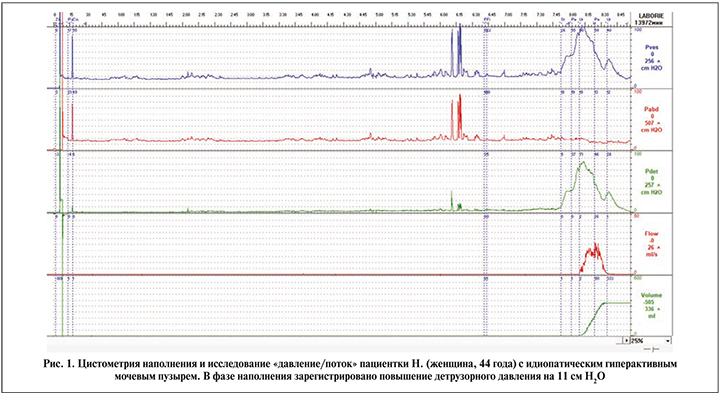
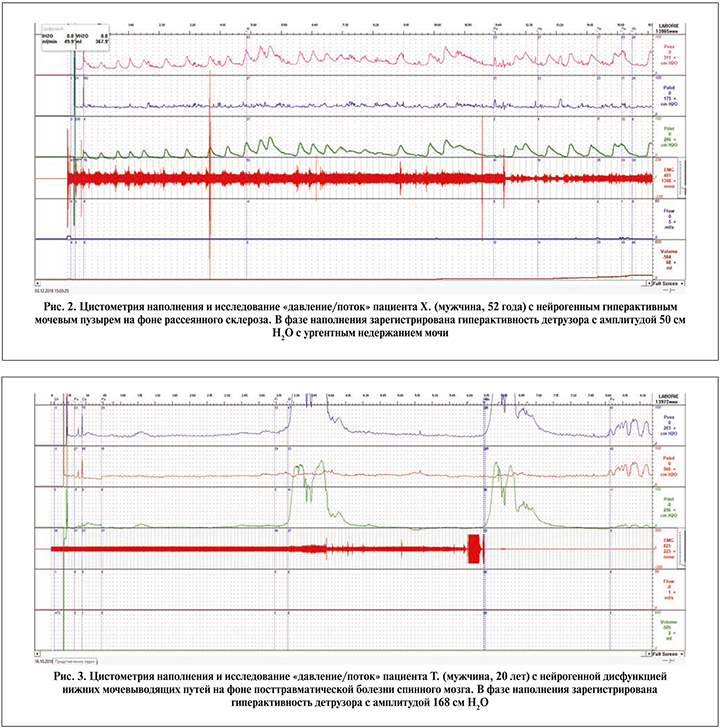
На рис. 1–3 представлены примеры графиков, полученных в ходе комплексного уродинамического исследования пациентов с идиопатическим ГМП (рис. 1) и нейрогенной детрузорной гиперактивностью (рис. 2, 3). Максимальная амплитуда непроизвольных сокращений детрузора в группе пациентов с нейрогенным мочевым пузырем равнялась в среднем 25,76±26,21 см Н2О и была достоверно выше, чем при идиопатических функциональных нарушениях: 10,1±3,4 Н2О (р=0,003).
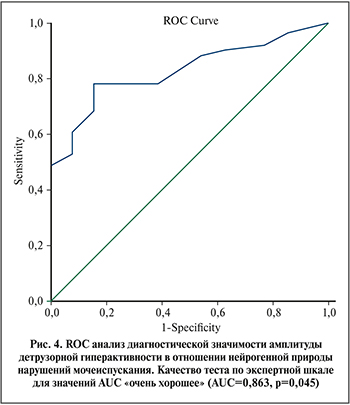
Как показал ROC-анализ (рис. 4), амплитуда повышения внутрипузырного давления в момент непроизвольного сокращения имеет высокую предсказательную способность в отношении нейрогенной природы гиперактивности вне зависимости от неврологического диагноза (AUC=0,863; p=0,045). Детрузорное давление более 9,5 см Н20 имеет чувствительность, равную 88%, относительно нейрогенного характера нарушений. Специфичность при этом низкая и равна 54%.
 Среди 10 пациентов, исходно направленных на КУДИ с диагнозом «идиопатичекий гиперактивный мочевой пузырь» и имеющих гиперактивность детрузора с амплитудой более 9,5 см Н20, углубленное неврологическое обследование в последующем позволило диагностировать рассеянный склероз в 1 наблюдении, периферическую полинейропатию в 2, дегенеративно-дистрофические заболевания позвоночника в 3 и цереброваскулярную болезнь у 1 больного.
Среди 10 пациентов, исходно направленных на КУДИ с диагнозом «идиопатичекий гиперактивный мочевой пузырь» и имеющих гиперактивность детрузора с амплитудой более 9,5 см Н20, углубленное неврологическое обследование в последующем позволило диагностировать рассеянный склероз в 1 наблюдении, периферическую полинейропатию в 2, дегенеративно-дистрофические заболевания позвоночника в 3 и цереброваскулярную болезнь у 1 больного.
Минимальный объем наполнения мочевого пузыря, при котором возникало первое непроизвольное сокращение детрузора для пациентов с нейрогенной детрузорной гиперактивностью (НДГ), составил 137±120 мл, при идиопатической гиперактивности – 218±120 мл (р=0,07). Различия имели характер статистической тенденции. ROC-анализ показал недостаточную диагностическую значимость данного параметра для диагностики нейрогенного характера дисфункции.
Обсуждение. Как показал анализ результатов работы, более чем у трети (36%) пациентов, проходивших уродинамическое исследование по поводу идиопатического ГМП, гиперактивности детрузора обнаружено не было. С одной стороны, это может быть обусловлено рядом технических моментов, не позволивших зарегистрировать непроизвольное сокращение. Например, недостаточным наполнением мочевого пузыря, отсутствием провоцирующих факторов, нефизиологичным положением тела пациента, приемом лекарственных препаратов, способностью пациента подавлять недержание мочи за счет напряжения мышц промежности и др. С другой стороны, отсутствие гиперактивности как уродинамического феномена может свидетельствовать об ошибочном диагнозе и другой этиологии симптомов накопления у этих больных, что требует дальнейших научных исследований.
Сложно судить о реальной доле таких пациентов среди людей, наблюдающихся с диагнозом ГМП, так как исследование было ограничено особенностями выборки, ибо для выполнения КУДИ чаще направляют пациентов, у которых стартовая терапия холинолитиками оказалась неэффективной [3].
У мужчин и женщин с синдромом хронической тазовой боли и жалобами на учащенное мочеиспускание не было выявлено гиперактивности детрузора ни в одном случае. При этом гиперсенсорность демонстрировали пациенты как с синдромом болезненного мочевого пузыря, так и с другими вариантами СХТБ. Это говорит о том, что повышенная чувствительность мочевого пузыря не только может быть связана с состоянием слизистой [11] и уменьшением растяжимости стенки, но и характерна в целом для людей с хронической тазовой болью и миофасциальным синдромом тазового дна [12]. Роль центральной сенсетизации и состояния мышц тазового дна в возникновении позывов к мочеиспусканию у этой категории больных требует дальнейшего изучения.
При наличии у пациента с НДНМП симптомов гиперактивного мочевого пузыря нейрогенная гиперактивность детрузора была выявлена в 100% наблюдений. НДГ сопровождалась недержанием мочи в 59,5% наблюдений, в то время как идиопатическая – в 19,2%.
В процессе исследования повторное наполнение мочевого пузыря с целью уточнения наличия гиперактивности детрузора потребовалось 86% пациентов с идиопатическим гиперактивным мочевым пузырем, 63% пациентов с СХТБ и только 12% больных НДНМП.
Уродинамические особенности НДГ по сравнению с идиопатической гиперактивностью были ранее показаны Lemack et al. [13] и Lucio et al. [14] на примере больных рассеянным склерозом. В работе Lemack et al. амплитуда внутрипузырного давления при непроизвольном сокращении детрузора у больных РС превысила аналогичный показатель пациентов с идиопатическим ГМП (28,3 cm H2O и 20,5 cm H2O соответственно, р=0,003), пороговый объем, при котором возникало непроизвольное сокращение детрузора, был больше у больных НДНМП (186,8 мл и 150,5 mL; р=0,037). Авторы установили, что амплитуда более 30 см H2O при первом непроизвольном сокращении детрузора имеет положительную предсказательную способность в диагностике нейрогенной природы гиперактивности, равную 88% [13]. Мы продемонстрировали, что для нейрогенных нарушений мочеиспускания характерна более высокая амплитуда детрузорной гиперактивности независимо от этиологии НДНМП.
Golabek et al., проанализировав уродинамические параметры 29 пациенток с НДГ на фоне сахарного диабета (СД) и 29 больных идиопатическим ГМП, показали, что нейрогенная детрузорная гиперактивность при СД также характеризовалась более высокой амплитудой первого непроизвольного сокращения (16 см H2O против 9 см H2O) [15]. Чувствительность значения амплитуды первого непроизвольного сокращения детрузора в диагностике НДГ составила 72,41% при пороговом значении 12 см Н2О, что коррелирует с полученными нами данными. Диабетическая цистопатия может проявляться гиперактивностью детрузора, имеющей у данных больных сложный этиопатогенез [16]. В настоящем исследовании пациенты с нарушениями мочеиспускания на фоне СД были отнесены к группе периферической полинейропатии.
Заключение. Пациенты с симптомами ГМП представляют собой неоднородную группу больных. Уродинамическое исследование позволяет дополнить клиническую картину объективными данными и разобраться в природе имеющихся жалоб. Наличие высокоамплитудной гиперактивности детрузора пациента без установленного неврологического диагноза должно быть поводом для консультации невролога и углубленному неврологическому обследованию.



