Введение. Почечно-клеточный рак (ПКР) представляет существенную медико-социальную проблему, занимая первое место по темпам прироста и девятое – по уровню заболеваемости среди всех злокачественных новообразований с сохраняющейся высокой смертностью [1–3].
Ежегодно в России выявляется более 23 тыс. новых случаев рака почки, среди которых на I–II стадии приходится 47,9 и 16%, а на III–IV – 15,5 и 19,1% соответственно [1, 2]. ПКР встречается в 4,3% всех злокачественных новообразований у мужчин и 2,9% у женщин и сопровождает 6-ю и 7-ю декады жизни [3–5]. В экономически развитых странах уровень заболеваемости ПКР остается выше, чем в развивающихся [6–8].
При лечении рака почки нефрэктомия продолжает оставаться методом выбора и достигает 20% (и даже более) в общей структуре оперативной тактики в онкоурологии [3, 4, 9–11]. С учетом высокой хирургической активности следует полагать, что число больных с единственной почкой неуклонно увеличивается. Однако у более чем 25% больных имеется снижение почечной функции уже на момент выявления опухоли, а у более чем половины – после операции [11]. ПКР относится к группе риска развития артериальной гипертензии, затрагивающей «органы-мишени» (гипоталамические структры, сосуды, сердце, почки и др.), что ухудшает реабилитацию больных и клинический прогноз [12, 13]. Нефрэктомия неизбежно приводит к уменьшению количества функционирующих нефронов и(или) их гипоксическому повреждению, что формирует или вызывает прогрессирование хронической болезни почек (ХБП) [14, 15]. Единственная почка является самостоятельным фактором возникновения сердечно-сосудистых осложнений вплоть до летального исхода [16–20].
Кроме того, в клинической урологии описано множество случаев, свидетельствующих о прогрессировании нефропатии при дисциркуляторных и метаболических нарушениях функционального аппарата почки у пожилых людей, ведущих в итоге к расстройству плазменного и тромбоцитарного гемостаза (в направлении гиперкоагуляции), что сопровождается формированием фиброза почечной ткани [10, 21, 22]. Повышение артериального давления, компенсаторная гипертрофия единственной почки, нарастание ХБП – все это требует активных медицинских мероприятий в лечебных и прогностических целях.
Цель исследования – изучить особенности функциональных изменений единственной почки как механизм компенсации после нефрэктомии по поводу рака почки.
Материалы и методы. В урологическом и онкоурологическом отделениях за пятилетний период наблюдались 36 пациентов после хирургического лечения рака почки в объеме нефрэктомии. Критерий невключения в исследования – наличие артериальной гипертензии в анамнезе. Распределение больных по полу: мужчин – 20, женщин –
16. Возраст больных: от 39 до 76 лет (средний – 59,0±10,8 года). Соотношение мужчин и женщин – 1,1:1. Чаще поражалась левая почка – 21 (58,3%) случай. Размеры опухоли находились в пределах 7,0–12,0 см. У всех больных по настоящему заболеванию установлен диагноз ХБП. Все пациенты дали добровольное согласие на операцию и участие в исследовании.
Всем больным с единственной оставшейся после нефрэктомии по поводу рака почкой предложено пройти плановое контрольное обследование через 3 ме. после оперативного вмешательства. Оно включило:
- измерение периферического артериального давления (АД) с расчетом среднего динамического давления;
- ультразвуковое исследование почек. Для определения размеров контралатеральной почки при ультразвуковом исследовании использовалась расчетная формула: V= a x b x c х 0,53, где а – длина, b – ширина, с – толщина почки, 0,53 – коэффициент погрешности;
- расчет скорости клубочковой фильтрации (СКФ) по формуле CKD-EPI;
- допплерография сосудов почки;
- определение фибриногена и растворимых фибринмономерных комплексов (РФМК) сыворотки крови;
- биомикроскопия бульбарной конъюнктивы (использована щелевая лампа SL–P с увеличением в 40 раз и жестко фиксированной к одному из окуляров видеокамеры с высокой разрешающей способностью).
Статистическую обработку полученных данных осуществляли с использованием пакета прикладных программ Statistica, 6,0 и электронных таблиц Excel, 2010. Для определения значимости статистических различий количественных показателей в сформированных группах применяли критерий Стьюдента, при отрицательном использовали непараметрические методы – критерий Манна–Уитни. Использовали также общепринятые уровни значимости: p<0,05; p<0,01 и p<0,001.
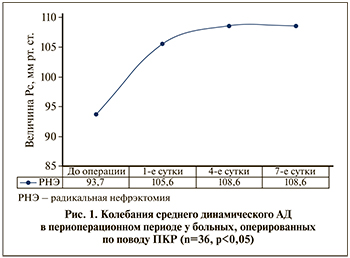
Результаты. АД в предоперационном периоде у включенных в исследование 36 больных колебалось в пределах 122– 128 мм рт.ст. систолическое и 80–85 мм рт.ст. диастолическое, среднее динамическое давление составило 93,4±1,8 мм рт.ст. После радикальной нефрэктомии уже за первые сутки у 61,1% (n=22) систолическое АД колебалось от 136–141 мм рт.ст., диастолическое – 88-92 мм рт.ст. Среднее динамическое АД составило 105,6±2,4 мм рт.ст. С четвертых-пятых суток у больных с единственной почкой АД приобретало стабильный характер со средним динамическим АД 108,6±2,4 мм рт.ст. (p<0,05, рис. 1).
При ультразвуковом исследовании отмечено (на 1–2-е сутки послеоперационного периода) увеличение размеров единственной оставшейся после нефрэктомии почки в среднем до 132,4±4,8 см3, что составило около 16% от исходного (контроль – колебание V почек было от 83,7 до 121,1 cм3, в среднем 110,4±11,2 см3; p<0,05). При выписке из стационара на 10-е сутки объем единственной почки в среднем составил 126,4±4,2 см3 (p<0,05, рис. 2).

У всех пациентов независимо от объема операции в течение первых двух суток после операции отмечено ухудшение функции почек, проявившееся достоверным снижением СКФ. Медиана показателя предоперационной СКФ составила 102,4±9,4 мл/мин /1,73 м². После операции снижение СКФ выявлено у 33 пациентов до 73,4±8,2 мл/мин /1,73 м² (91,7%; p<0,05).
При доплерографии сосудов единственной после радикальной нефрэктомии (РНЭ) почки на 4–5-е сутки послеоперационного периода в 83,7% случаев (p<0,05) прослеживалась тенденция к умеренному снижению почечного кровотока (диаметр почечной артерии был без изменений – 5,6±1,2 мм): V кровотока почечной артерии – 69,4±5 мл при норме не менее 100 мл. Отмечалось умеренное повышение линейного почечного кровотока до 1,15 см/с (p>0,05), что свидетельствует о достаточном для функциональной обеспеченности органа давления в макрососудистом русле. Было отмечено увеличение индекса резистентности в основном стволе до 0,72±0,02 (норма – 0,62±0,02, на 16,1% по отношению к верхней границе нормы; p<0,05), в сегментарных же артериях до 0,69±0,01 (норма – 0,61±0,01, p>0,05), в междолевых до 0,66±0,04 (норма – 0,6±0,03, p>0,05). Пульсационный индекс составил 0,64±0,07 при норме 0,68±0,08 в основном стволе. В сегментарных артериях 0,54±0,08 (норма – 0,88±0,08, p<0,05), в междолевых артериях пульсационный индекс составил 0,64±0,06 (норма – 0,89±0,06, p<0,05).
Одним из методов оценки состояния микроциркуляции органов и систем в различных условиях их функционирования является прямое наблюдение капиллярной сети бульбарной коньюнктивы. Витальная биомикроскопия бульбарной коньюнктивы у пациентов на 4–5-е сутки после РНЭ позволила наблюдать такие специфические признаки изменений микроциркуляции, как замедление венулярного и капиллярного кровотоков, стаз форменных элементов крови в капиллярах (рис. 3).
До операции и в раннем послеоперационном периоде отмечена выраженная фибриногенемия и повышение уровня РФМК. Фибриноген является белком острой фазы при любых воспалительных, специфических и неспецифических процессах, развивающихся, в частности, перифокально вокруг опухолевого очага. Этим можно объяснить его стабильно повышенный уровень в ответ на наличие онкологического процесса и операционную травму в раннем послеоперационном периоде. Мы оценивали фибриноген как показатель предтромботического состояния только в комплексе с другими вышеуказанными параметрами, влияющими на реологию крови (табл. 1).

При взятии больных с единственной почкой (n=36) на диспансерный учет обращено внимание на сохранение следующих изменений:
- повышение АД до 140/90 мм рт.ст. с увеличением среднего динамического АД до 107,4±2,6 мм рт.ст., что соответствовало развитию артериальной гипертензии 1-q степени у 94,4% (n=34);
- скорость клубочковой фильтрации составила 76,2±4,6 мл/мин /1,73 м² у 91,7% пациентов;
- умеренное повышение фибриногена до 4,8±0,4 г/л у 80,56% больных;
- повышение РФМК сыворотки крови до 15,3±0,5 10-2 г/л у 75% больных;
- сохранившаяся викарная гипертрофия, по данным ультразвукового исследования почек, – 125,6± 4,5 см3 у 97,2%;
- нарушения периферической микроциркуляции, по данным биомикроскопии бульбарной конъюктивы, составили от умеренных до выраженных у 83,3%.
Повышение концентрации креатинина в сыворотке или снижение СКФ указывают на ухудшение функции почек, свидетельствуют о поражении фильтрационного барьера клубочков, что является предиктором сердечно-сосудистых событий. Эпизоды повышения АД выше среднего уровня могут создавать дополнительный гемодинамический стресс для сердца и сосудов и увеличивать риск поражения органов-мишеней. Всем больным, у которых выявлены данные нарушения, назначено лечение препаратами ренокардиопротективного ряда с умеренным гипотензивным эффектом (периндоприл в титруемой дозе начиная с 2 мг), в качестве тромбопрофилактики и улучшения реологических свойств крови – апиксабан 5 мг/сут.
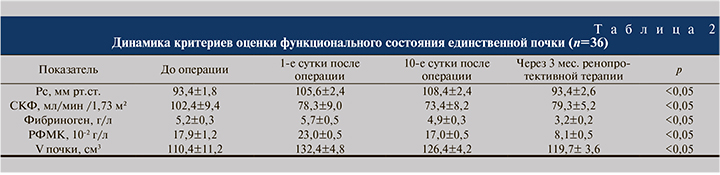
По истечении 3 мес. терапии у повторно обследованных больных выявлено (табл. 2):
- достижение целевых значений АД (<130/85 мм рт.ст.) со средним динамическим АД 93,4±2,6 мм рт.ст;
- СКФ составила 79,3±5,2 мл/мин /1,73 м²;
- снижение фибриногена и РФМК до субнормальных значений 3,2±0,2 г/л и до 8,1±0,5 10-2 г/л соответственно;
- сохранившаяся викарная гипертрофия, по данным ультразвукового исследования почек, – 119,7±3,6 см3;
- нарушения периферической микроциркуляции, по данным биомикроскопии бульбарной конъюктивы, нами оценены как умеренные (рис. 4).
В связи с отмеченным положительным эффектом проводимой амбулаторной терапии данная схема лечения в дальнейшем рекомендована по выписке всем больным с единственной почкой сроком на 3 мес. с контролем АД, размеров органа, расчетом СКФ, показателей гемореологии амбулаторно.
Обсуждение. Считается вполне допустимым развитие компенсаторной гипертрофии почки в качестве естественной адаптации органа в ответ на усиление нагрузки после нефрэктомии. Викарная гипертрофия может обеспечивать высокую стабильность гомеостатических параметров на протяжении длительного времени. В основе этого лежат процессы управления образованием тканевой жидкости и лимфы для обеспечения лимфатического дренажа тканей и элиминации токсических метаболитов, от чего зависит поддержание метаболизма микроциркуляторного звена и трофики тканей [16, 23]. Индекс резистентности и пульсационный индекс в большей степени отражают состояния микроциркуляторного русла (тонус, состояние стенки артериол и капилляров). Более точно состояние сосудов отражает пульсационный индекс. Снижение величины этого показателя отмечается в случаях артериовенозного шунтирования или при выраженной периферической вазодилатации. В нашем случае повышение индекса резистентности в основном стволе может свидетельствовать о вазоспастической реакции. В сегментарных и междолевых артериях оба индекса имеют тенденцию к снижению, особенно это проявляется пульсационным индексом, что может свидетельствовать о периферическом венозном отеке с усилением периферического сопротивления, что существенно влияет на реологические свойства крови с повышением ее вязкости.
После нефрэктомии в единственной почке возникает коменсаторная функциональная перегрузка; формируется капилляростаз – результат отека ткани, то есть нарушения дренажной функции венозной (в результате развития флебогипертензии), лимфатической системы вышеупомянутого коллектора, а также связанной с ними рыхлой лимфоидной и соединительной ткани (интерстиция) [24].
Отмечено замедление капиллярного кровотока в системе микроциркуляции, стаз форменных элементов крови (согласно показателям биомикроскопии бульбарной конъюнктивы), что отражает нарушения микроциркуляции в органах и тканях, в том числе в единственной почке как важное патогенетическое звено в ряде типичных патологичских процессов различных заболеваний [25, 26].
Факторы, вызывающие гиперфильтрацию, ускоряют развитие ХБП за счет повышения давления в гломеруллярных капиллярах, где развиваются микрогемоциркуляторные нарушения, ведущие в свою очередь к гиперфильтрации. Само по себе удаление почки служит достоверным фактором развития ХБП, которая повышает вероятность метаболических осложнений, сосудистых заболеваний и летального исхода [20, 27]
Многокомпонентный механизм формирования артериальной гипертензии есть компенсация сниженной перфузии тканей вследствие влияния нервного и гуморального факторов, объема сердечного выброса, эластичности, диаметра и просвета сосудов, а также вязкости крови.
После нефрэктомии формируется замкнутый круг: единственная почка увеличивается в объеме (викарная гипертрофия), что вызывает венозный отек интерстиция как фактора давления на ткань, повышение тонуса артериол, развитие вторичной ишемии ткани, как минимум циркуляторной гипоксии как раздражителя клеток юкстагломерулярного аппарата, повышение АД – все это укладывается в картину гипертензивной нефропатии.
Развитие гипертензивной нефропатии и манифестация (либо прогрессирование) ХБП требует включения в терапию гипотензивных препаратов с ренокардиопротективным действием.
Заключение. Развитие и прогрессирование ХБП у больных с единственной почкой сопровождается структурной перестройкой органа с повышением АД, увеличением его объема, снижением функции, микроциркуляторными нарушениями и гипертензивной нефропатией. Вынужденное радикальное вмешательство при лечении почечно-клеточного рака в объеме нефрэктомии требует в последующем не только патогенетически обоснованной комплексной медицинской, но и социальной реабилитации лиц с единственной почкой, которую нельзя считать полноценной в условиях возросшей функциональной нагрузки. Проблема единственной почки в современной онкоурологии по-прежнему не решена, необходим междисциплинарный подход к ее решению.



