Введение. Выполнение РПЭ при локализованном и местнораспространенном раке предстательной железы промежуточного и высокого онкологических рисков является «золотым» стандартом хирургического лечения, обеспечивая эффективный и хороший отдаленный онкологический результат [1]. Удаление тазовых лимфатических узлов при РПЭ способствует лучшему обнаружению метастазов в лимфатической ткани и правильному стадированию патологического процесса. Как правило, выполнение ТЛАЭ при радикальной простатэктомии хорошо переносится пациентами. Однако, принимая во внимание высокую частоту послеоперационных осложнений после тазовой лимфаденэктомии, выполнение ее пациентам с низким онкологическим риском (PSA≤10 нг/мл, Gleason≤6, cT≤2a) не оправданно, поскольку риск выявления метастазов в лимфатических узлах составляет около 1% [2]. Из этого следует, что, по рекомендациям Европейской ассоциации урологов, если индивидуальный риск поражения лимфатических узлов, рассчитанный с помощью номограмм, более 5%, то это является показанием к выполнению расширенной ТЛАЭ [3]. Тем не менее границы выполнения тазовой лимфаденэктомии все еще обсуждаются, поскольку стандартная или даже ограниченная лимфаденэктомия до сих пор распространена в клинической практике.
В различных исследованиях частота осложнений, связанных с удалением лимфатических узлов, варьируется от 2 до 51% и включает лимфогенные осложнения, тромбоз глубоких вен нижних конечностей, травму мочеточника, повреждение подвздошных сосудов и запирательного нерва [4]. К наиболее частыми послеоперационными осложнениями лимфаденэктомии относятся длительная лимфорея, формирование лимфатических кист (лимфоцеле), а также развитие лимфедемы нижних конечностей и половых органов. Однако не все лимфогенные осложнения нуждаются в дальнейшем хирургическом лечении.
Знание факторов риска и методов профилактики лимфогенных осложнений при выполнении радикальной простатэктомии с тазовой лимфаденэктомией могут предотвращать их развитие. Целью нашего ретроспективного исследования была оценка влияния различных факторов риска на развитие лимфогенных осложнений после РПЭ с ТЛАЭ.
Материалы и методы. С января 2017 по март 2020 г. включительно в университетской клинике урологии РНИМУ им. Н. И. Пирогова на базе ГКБ № 1 им. Н. И. Пирогова выполнено 203 радикальных простатэктомий с ТЛАЭ, из них позадилонных РПЭ без формирования брюшинного лоскута 101 (49,8%) пациенту, позадилонных РПЭ с формированием брюшинного лоскута 51 (25,1%), лапароскопических РПЭ также 51 (25,1%) пациенту. Все операции выполнялись разными хирургами.
Клинико-патологическая характеристика пациентов в нашем исследовании была представлена следующими показателями: возраст, индекс массы тела (ИМТ), оценка физического состояния по опроснику Американского общества анестезиологов (ASA) (https://www.asahq.org/ American Society of Anesthesiologist); предоперационный уровень простатспецифического антигена (ПСА), объем предстательной железы, проведение неоадъювантной гормональной терапии, патологоанатомические результаты гистологического исследования (баллы по Глисону, классификация pTN); доступ и время оперативного вмешательства, объем кровопотери, наличие или отсутствие страховых дренажей; вид тазовой лимфаденэктомии, количество удаленных лимфатических узлов; день удаления страховых дренажей и количество дней в стационаре, а также 30 дневные лимфогенные осложнения, классифицированные в соответствии со шкалой Clavien-Dindo.
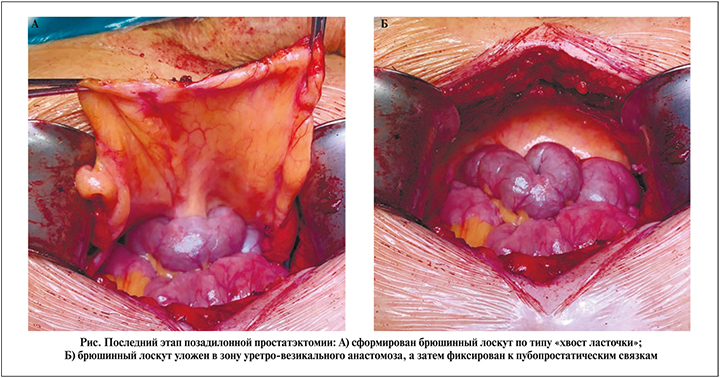
Открытая РПЭ выполнялась позадилонным доступом, ЛРПЭ – трансперитонеальным. Часть открытых операций (n=51) и все ЛРПЭ (n=51) дополнялись техникой формирования брюшинного лоскута для профилактики лимфогенных осложнений (рис. 1). Мы формировали брюшинный лоскут по типу «хвост ласточки» и укладывали его в зону уретро-везикального анастомоза с последующим фиксированием двумя швами к пубопростатическим связкам.
Пациентам была проведена стандартная или расширенная тазовая лимфаденэктомия. При стандартной ТЛАЭ вся лимфатическая ткань иссекалась вдоль наружной подвздошной артерии и вены начиная от бифуркации общей подвздошной артерии и вены и продолжалась до лимфатического узла Пирогова–Розенмюллера–Клоке, а также в запирательной ямке краниально и каудально от запирательного нерва. Выполнение расширенной ТЛАЭ дополнялось удалением лимфатических узлов медиально и латерально от внутренней подвздошной артерии и вены, а также удаление лимфатической ткани в общей подвздошной и пресакральных зонах. При открытой методике иссечения лимфатической ткани использовался биполярный инструмент, а во время лапароскопической – ультразвуковой. Также в некоторых случаях были применены полимерные клипсы, которые накладывались на крупные лимфатические сосуды проксимальнее лимфатического узла Пирогова–Розенмюллера–Клоке. Лимфостатические средства (фибриновые губки, клей) во время операции не использовались.
После выполненного оперативного вмешательства в случае установки страховых дренажей они помещались в околопузырное пространство. Дренажи удалялись в ближайшем послеоперационном периоде при отделяемом менее 50 мл в течение 24 ч. При развитии длительной лимфореи (более 3 сут с отделяемым более 100 мл лимфы в сутки) страховые дренажи не удалялись до уменьшения отделяемого менее 100 мл в течение 24 ч, в некоторых случаях их удаление выполнялось в амбулаторном порядке. Также отделяемое исследовалось на биохимические показатели (креатинин, азот мочевины) для исключения мочевых затеков.
Всем пациентам помимо стандартного компрессионного трикотажа проводилась периоперационная антикоагулянтная тромбопрофилактика инъекциями низкомолекулярных гепаринов в подкожно-жировую клетчатку живота, начинавшаяся за 12 ч до операции и продолжавшаяся амбулаторно в течение 30 дней после операции.
В послеоперационном периоде на первые и третьи сутки, а также в день выписки из стационара проводилось комплексное ультразвуковое исследование органов забрюшинного пространства, брюшной полости и малого таза (УЗИ). После выписки УЗИ выполнялось в амбулаторном режиме, а в случае возникновения симптоматических лимфогенных осложнений (лимфоцеле и лимфедема) пациентов госпитализировали в стационар для дальнейшего обследования и определения лечебной тактики, проводили мультиспиральную компьютерную томографию (МСКТ) органов забрюшинного пространства, брюшной полости и малого таза, а также ультразвуковую допплерографию сосудов нижних конечностей (УЗДГ).
Основные симптомы, которые указывали на развитие лимфогенных осложнений: боль и тяжесть в проекции брюшной полости и малого таза, отек и боль в нижних конечностях, половых органах, недержание мочи, лихорадка, тянущая боль в поясничной области вследствие обструкции верхних мочевыводящих путей. При возникновении симптоматических лимфатических кист выполнялось повторное оперативное вмешательство: чрескожное дренирование лимфатической кисты под ультразвуковым контролем с установкой дренажа в полость кисты для ее опорожнения и последующего введения склерозирующих веществ или лапароскопическая/открытая марсупиализация ЛК.
Статистическая обработка данных выполнена с помощью электронных таблиц Microsoft Office Excel, 2010 (Microsoft Corporation, США) и пакета прикладных программ IBM SPSS Statistics 22 (IBM, США). Количественные показатели представлены в виде M±SD, где M – среднее арифметическое, SD – стандартное отклонение, а в случае отсутствия нормального распределения – в виде медианы и интерквартильного размаха Me (Q1-Q3), где Me – медиана, Q1 – первый квартиль (25%), Q3 – третий квартиль (75%).
При нормальном виде распределения числовых данных применялись методы параметрической статистики (t – критерий Стьюдента). В отсутствие нормального распределения данных применялись методы непараметрической статистики (U-тест Манна–Уитни). Для качественных показателей применяли критерий χ2 – тест с поправкой Йетса на непрерывность или точный критерий Фишера. Статистически значимыми считались различия при p<0,05 (95%-й уровень значимости) и при p<0,01 (99%-й уровень значимости). В ходе построения прогностической модели произведен многофакторный анализ (метод бинарного логистического регресса) влияния факторов риска на развитие лимфогенных осложнений. В результате данного анализа в модели остались только независимые факторы, достоверно оказавшие влияние на исход (p<0,05).
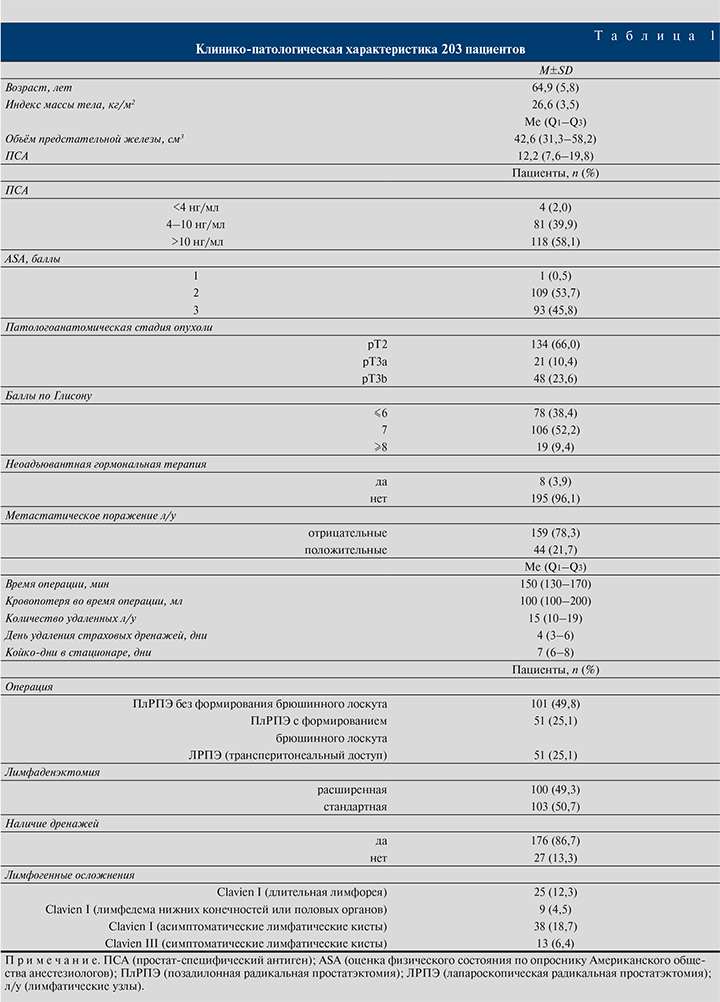
Результаты. В общей сложности 203 пациента с раком предстательной железы перенесли позадилонную или лапароскопическую радикальную простатэктомию с ТЛАЭ. Клинико-патологическая характеристика 203 пациентов представлена в табл. 1.
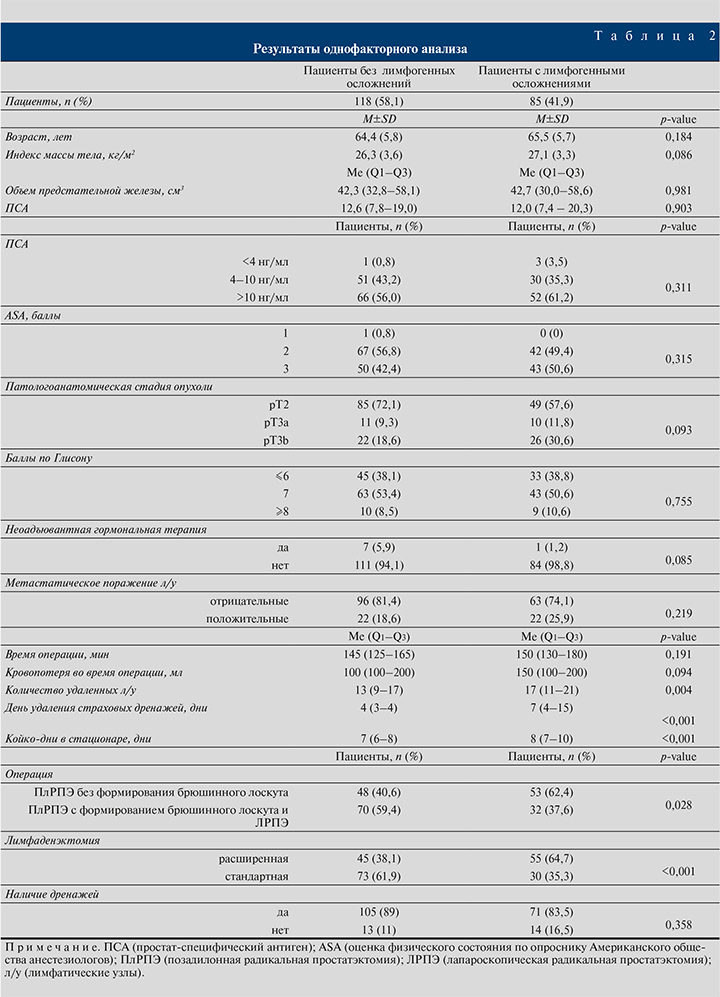
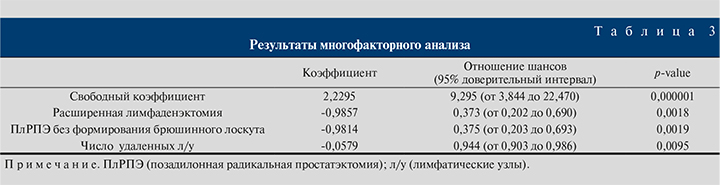
Результаты одно- и многофакторного анализов представлены в табл. 2 и 3 соответственно.
Обсуждение. Удаление тазовых лимфатических узлов при РПЭ представляет собой наиболее надежный метод диагностики метастатического поражения лимфатических узлов и не может быть адекватно заменено альтернативными методами визуализации на сегодняшний день. Лимфатические кисты представляют собой наиболее частое лимфогенное осложнение после РПЭ с ТЛАЭ, приводящее к повторному оперативному вмешательству в отношении 11,2% пациентов [5]. Истинная частота лимфогенных осложнений мало изучена, так как клинически большинство лимфатических кист протекают бессимптомно и далеко не всем пациентам после оперативного вмешательства выполняются визуализирующие методы обследования. В исследовании, проведенном Orvieto M.A. et al., группа авторов изучала общую частоту всех случаев образования лимфатических кист, симптоматических и бессимптомных, выполнив послеоперационную компьютерную томографию через 6–12 нед. после операции 76 пациентам, которым была проведена робот-ассистированная РПЭ с выполнением стандартной ТЛАЭ по поводу рака предстательной железы. По результатам выявлено, что у 39 (51%) пациентов развились лимфатические кисты, у 6 (15,4%) из них они проявили себя клинически. Одному пациенту потребовалось выполнение оперативного вмешательства [6].
В отечественном ретроспективном исследовании, проведенном П. И. Раснером и соавт., пациентам была выполнена робот-ассистированная РПЭ с расширенной или стандартной ТЛАЭ. Из 512 пациентов у 4 (0,8%) развились лимфатические кисты, у 33 (6,4%) наблюдалась длительная лимфорея [7].
В нашем исследовании общий процент развития лимфогенных осложнений составил 41,9% (85 из 203 пациентов). Из них у 13 (6,4%) пациентов развились симптоматические ЛК, у 38 (18,7%) асимптоматические ЛК, длительная лимфорея присутствовала у 25 (12,3%) пациентов, лимфедема нижних конечностей или половых органов у 9 (4,5%).
Знание факторов, способствующих возникновению лимфогенных осложнений, может помочь предотвратить их развитие и улучшить послеоперационный уход и восстановление пациента. В ряде исследований важным нехирургическим фактором риска развития лимфогенных осложнений стал возраст пациента на момент операции [5, 8].
В нашей работе не было обнаружено статистически значимой разницы между средним возрастом пациентов, у которых развились лимфатические осложнения, по сравнению с пациентами без лимфогенных осложнений (65,5 vs. 64,4, p=0,184). Другим потенциальным фактором риска развития лимфогенных осложнений может быть индекс массы тела (ИМТ) [9]. Однако в работе C. Thomas et al. продемонстрировали отсутствие влияния ИМТ на развитие симптоматических ЛК [8]. Наши данные это подтверждают, ИМТ достоверно не влиял на развитие лимфогенных осложнений (p=0,086).
Доступ при оперативном вмешательстве играет немаловажную роль в возникновении лимфогенных осложнений. Можно предположить, что трансперитонеальный доступ способствует меньшему проценту развития лимфогенных осложнений вследствие имеющегося сообщения малого таза с брюшной полостью. Исследования, проведенные F. Porpiglia et al., J. S. Chung и et al., демонстрируют преимущество трансперитонеального доступа перед экстраперитонеальным [10, 11]. В статье, опубликованной J. U. Stolzenburg et al., описано выполнение двусторонней перитонеальной фенестрации в конце экстраперитонеальной РПЭ с ТЛАЭ 50 пациентам и сравнение их с 50 пациентами, брюшина которых оставалась нетронутой. Число и процент сформированных лимфатических кист были следующими: 1-я группа – 3 (6%); 2-я – 16 (32%) (p<0,001) [12]. В нашем исследовании мы сравнили две группы пациентов по количеству развившихся лимфогенных осложнений: 1-я группа – после ПлРПЭ без формирования брюшинного лоскута; 2-я – после ПлРПЭ с формированием брюшинного лоскута и ЛРПЭ. Мы объединили ПлРПЭ с формированием брюшинного лоскута и ЛРПЭ в одну группу, так как в обоих случаях брюшина обеспечивает физиологическую реабсорбцию лимфы, что способствует профилактике развития лимфогенных осложнений. Частота развития лимфогенных осложнений была выше в группе ПлРПЭ без формирования брюшинного лоскута, в которую вошли 53 пациента из 101, по сравнению с группой ПлРПЭ с формированием брюшинного лоскута, включившую 18 пациентов из 102, и с группой ЛРПЭ, которую составили 14 пациентов из 102 (p=0,028). В ходе многофакторного анализа ПлРПЭ без формирования брюшинного лоскута (отношение шансов=0,375; 95% доверительный интервал – 0,203–0,693; p=0,0019) осталась независимым предиктором развития лимфогенных осложнений.
Одним из факторов риска, который может потенциально увеличивать риск развития лимфогенных осложнений, является выполнение расширенной ТЛАЭ по сравнению со стандартной. Расширенная ТЛАЭ дает прогностически важную информацию, которую нельзя получать другими доступными способами в настоящее время. При такой степени лимфаденэктомии становится возможным правильное стадирование пораженных лимфатических узлов в 94% случаев [13]. В исследовании, проведенном M. Mush al., расширенная лимфаденэктомия стала фактором риска развития симптоматических ЛК (p<0,0001) [14]. C. Thomas et al. продемонстрировали влияние независимого фактора риска – количества удаленных лимфатических узлов на развитие симптоматических ЛК. Медиана удаленных лимфатических узлов составила 13 у пациентов с симптоматическими ЛК по сравнению с 10 у пациентов без симптоматических ЛК (p=0,005) [15].
Логично предположить, что при расширенной ТЛАЭ число удаленных лимфатических узлов будет больше по сравнению с количеством таковых после стандартной ТЛАЭ. Однако у пациентов не существует стандартного набора лимфатических узлов в фиброзно-жировой ткани малого таза [16]. Также одним из факторов, который может влиять на оценку количества лимфатических узлов, является способ, которым патологоанатомы оценивают лимфатические узлы малого таза [17]. Из этого можно сделать вывод: при удалении массы ЛУ будет выше вероятность развития лимфогенных осложнений. Эта корреляция скорее всего зависит от самого факта выполнения ТЛАЭ, нежели от конкретного числа удаленных лимфатических узлов.
В нашем исследовании мы не получили четкой корреляции между расширенной лимфаденэктомией и количеством удаленных лимфатических узлов. Частота развития лимфогенных осложнений была выше в группе с расширенной ТЛАЭ, в которую вошли 55 пациента из 100, по сравнению с группой со стандартной ТЛАЭ, включившей 30 пациентов из 103 соответственно (p<0,001). Медиана удаленных лимфатических узлов составила 17 у пациентов с лимфогенными осложнениями по сравнению с 13 у пациентов без таковых (p=0,004). В ходе многофакторного анализа расширенная ТЛАЭ (отношение шансов=0,373; 95% доверительный интервал – 0,202–0,690; p=0,0018) количество удаленных лимфатических узлов (отношение шансов=0,944; 95% доверительный интервал – 0,903–0,986; p=0,0095) остались независимым предиктором развития лимфогенных осложнений после РПЭ с ТЛАЭ.
В проспективном рандомизированном исследовании H. Danuser et al. предиктором развития симптоматических ЛК стало наличие метастатического поражения лимфатических узлов (p<0,02) и отсутствие или раннее удаление (на 1 сутки) страховых дренажей (p<0,05) после ПлРПЭ с расширенной ТЛАЭ [18]. В нашей работе мы получили противоположные данные: положительные лимфатические узлы и отсутствие страховых дренажей не показали достоверной статистической значимости. Однако частота развития лимфогенных осложнений была выше в группе пациентов, которые имели положительные лимфатические узлы у 22 (50%) из 44, по сравнению с группой пациентов с отрицательными лимфатическими узлами у 63 (39,6%) из 159 (p=0,219). В группе пациентов, которым не устанавливали страховых дренажей, частота развития лимфогенных осложнений была выше у 14 (51,8%) из 27 по сравнению с группой, в которой устанавливались страховые дренажи 71 (40,3%) из 176 (p=0,358).
Также такие показатели, как ПСА (p=0,903), объем предстательной железы (p=0,981), баллы по ASA (p=0,315), pT (p=0,093), баллы по шкале Глисон (p=0,755), неоадъювантная гормональная терапия (p=0,085), время операции (p=0,191), кровопотеря во время операции (p=0,094), не продемонстрировали статистической разницы в группе пациентов, у которых развились лимфогенные осложнения, по сравнению с группой без лимфогенных осложнений.
Заключение. Таким образом, наше исследование продемонстрировало, что ПлРПЭ без формирования брюшинного лоскута, расширенная ТЛАЭ и количество удаленных лимфатических узлов являются независимым предиктором возникновения лимфогенных осложнений после РПЭ с тазовой лимфаденэктомией. Необходимо дальнейшее проведение большего количества научных исследований по данной проблематике, и все они должны быть направлены на изучение факторов риска развития лимфогенных осложнений и методов их профилактики.



