Введение. Болезнь Пейрони характеризуется рубцовым изменением белочной оболочки с потерей ее эластичности, что приводит к деформации полового члена. Этот процесс всегда сопровождается уменьшением функциональной длины полового члена, что отрицательно влияет на качество жизни и иногда приводит к серьезным психологическим последствиям. По некоторым данным, встречаемость болезни Пейрони среди мужчин 40–70 лет составляет 3–10%, хотя это состояние может встречаться и до 30 лет [1–3] Более того, оно обычно ассоциировано с эректильной дисфункцией (ЭД), которую диагностируют в 20–54% случаев [4].
Показания к хирургическому лечению болезни Пейрони можно сформулировать, когда заболевание становится стабильным. Четкого определения фазы стабилизации нет, но обычно о ней говорят, когда заболевание длится минимум 1 год, а в течение 6 мес. нет боли при пальпации бляшки или эрекции и форма пениса больше не изменяется [5]. На данный момент способов прогнозировать естественное течение болезни Пейрони нет, поэтому клиницистам приходится ориентироваться на данные суррогатных факторов. Кандидатами на лечение болезни Пейрони становятся только те пациенты, у которых половой акт невозможен или затруднен из-за ненормальной конфигурации полового члена. Поскольку это заболевание не опасно для жизни и не влияет на трудоспособность, во всех остальных случаях целесообразность оперативного вмешательства практически никогда не рассматривается.
Хирургическое лечение должно быть индивидуализировано и нацелено на восстановление не только функции полового члена, но и его прежней формы и длины, насколько это возможно. Были предложены различные методики для закрытия дефекта белочной оболочки, но ни одна из них так и не получила статуса «золотого» стандарта [6, 7].
Эволюция хирургических методов лечения болезни Пейрони привела к тому, что целью оперирующего хирурга перестало быть только механическое устранение искривления пениса: для наилучших эстетических и функциональных результатов должны применяться методики, направленные на восстановление его длины и диаметра. В то же время любые хирургические вмешательства по поводу болезни Пейрони бессмысленны и носят характер «хирургического упражнения», если пациент после такой операции не живет половой жизнью. Одной из причин, по которой пациенты не способны вести регулярную половую жизнь, служит ЭД. Считается, что разные виды операций по поводу болезни Пейрони несут риск развития или усугубления уже имеющейся ЭД. Пликационные методики оказывают наименьшее влияние на эректильную функцию, а корпоропластика с графтингом, как считается, способна ее ухудшить. Вероятно, это связано с несовпадением механических свойств графта и нативной белочной оболочки, нарушением работы веноокклюзивного механизма. Фаллопротезирование представляет собой радикальный вид лечения как болезни Пейрони, так и ЭД. Однако с учетом высокой стоимости имплантатов применение этого метода лечения всех пациентов с болезнью Пейрони и ЭД представляется проблематичным.
Не до конца понятно, какие факторы предиктивные в отношении развития ЭД после заместительной корпоропластики. Важно учитывать, что васкулогенная ЭД, которая может быть ассоциирована с дислипидемией и сахарным диабетом, со временем имеет независимую тенденцию к прогрессированию, поэтому нельзя исключать, что негативное влияние графтинга белочной оболочки на эректильную функцию несколько переоценено: ухудшение эрекции может быть связано не столько с перенесенной корпоропластикой, сколько с естественным течением ЭД. Необходимо изучение потенциальных предикторов увеличения тяжести ЭД после хирургической коррекции деформации полового члена, чтобы при накоплении достаточного объема данных стал возможен рациональный отбор пациентов, способных в наибольшей степени выиграть от превентивной установки фаллопротеза.
Цель: оценить состояние эректильной функции у пациентов после корпоропластики по поводу болезни Пейрони.
Материалы и методы. Проведен анализ медицинской документации 374 пациентов, подвергшихся корпоропластике по поводу болезни Пейрони одним хирургом за 1996–2016 гг. и давших согласие на участие в исследовании.
Исходно пациенты предъявляли следующие жалобы: неудобство во время полового акта (n=184), боль во время полового акта (n=99), искривление полового члена (n=374), уменьшение размеров пениса (n=158), снижение качества эрекции (n=125), дискомфорт у половой партнерши во время полового акта (n=109), затрудненная эякуляция или анэякуляция (n=19).
В отношении 125 пациентов, предъявивших жалобы на ухудшение качества эрекции, проведены анкетирование с помощью опросника МИЭФ, анализ крови на гормоны и фармакодопплерография сосудов полового члена. При этом у 87 пациентов обнаружены признаки васкулогенной ЭД, из них у 21 – артериогенной, у 37 – веноокклюзивной и у 29 – смешанной артериовенозной ЭД.
У остальных 38 пациентов, предъявивших жалобы на ухудшение эректильной функции, характерных нарушений гемодинамики пениса выявлено не было.
У 21 пациента отмечен низкий уровень тестостерона в сыворотке крови, взятой в утренние часы.
Показатели МИЭФ у 160 пациентов составили 26 баллов и более; у 59 – 21–25; у 64 – 16–20; у 28 – 10–15; у 30 – менее 10 баллов.
Несмотря на то что субъективно только 125 пациентов жаловались на снижение качества эрекции, по данным анкеты МИЭФ ,признаки ЭД имели место у 181 пациента. Данное разногласие можно объяснить тем, что пациенты с легкой степенью ЭД не всегда придают ей значение, а иногда и склонны воспринимать ее как «возрастную норму». Три пациента с легкой, 64 с умеренно легкой ЭД принимали ингибиторы фосфодиэстеразы 5-го типа (ФДЭ-5) с положительным эффектом. Пятьдесят восемь пациентов с умеренно тяжелой и тяжелой ЭД не достигали желаемого эффекта при приеме ингибиторов ФДЭ-5. Все пациенты с тяжелой или умеренно тяжелой ЭД имели признаки веноокклюзивной дисфункции (n=29) или смешанной артериовенозной формы ЭД (n=29) по результатам фармакодопплерографии. Восемь пациентов с изолированной веноокклюзивной дисфункцией имели легкую степень ЭД и хорошо реагировали на прием ингибиторов ФДЭ-5. Всем пациентам с подтвержденной при фармакодопплерографии венозной или артериовенозной формой ЭД рекомендовали имплантацию фаллопротеза, но 8 пациентов отказались от такого вида лечения. В результате 58 больным было выполнено фаллопротезирование: в 25 случаях с использованием однокомпонентных протезов, в 33 – с использованием трехкомпонентных гидравлических протезов. Восьми пациентам интраоперационное ручное моделирование позволило выполнить коррекцию деформации пениса при установке протеза; у этих пациентов угол искривления не превышал 40°. Другим пациентам потребовалась заместительная корпоропластика с использованием внутреннего листка крайней плоти (n=3), графта из vena saphena magna (n=37) или трупного перикарда (n=10). Имплантация фаллопротеза с ручным моделированием при болезни Пейрони выполнялась через стандартный пеноскротальный доступ. При необходимости выполнения графтинга осуществляли циркумцизионный доступ со скальпированием полового члена, позволяющий провести мобилизацию дорсального сосудисто-нервного пучка и/или уретры. При использовании однокомпонентных протезов выполняли корпоротомию, непосредственно устанавливали имплантат и уже после этого проводили инцизию бляшки с фиксацией графта. При использовании гидравлических пенильных протезов такая последовательность была бы недопустимой из-за риска повреждения осевых цилиндров при инцизии и графтинге, поэтому изначально мы проводили корпоропластику на металлических бужах и только потом устанавливали имплантаты.
Были использованы следующие хирургические методики: заместительная корпоропластика с графтингом (n=239), заместительная корпоропластика в сочетании с установкой пенильного имплантата (n=50), пликация tunica albuginea (n=37), фаллопротезирование с мануальным моделированием (n=8), заместительная корпоропластика в сочетании с резекцией глубокой дорсальной вены (n=5), пликация tunica albuginea в сочетании с резекцией глубокой дорсальной вены пениса (n=3). Многим пациентам проводилась профилактика развития ЭД после корпоропластики: 74 пациента получали ингибиторы ФДЭ-5 регулярно, 38 принимали эти препараты по требованию, 34 подвергались вакуумэрекционной терапии и 22 пациента носили пенильные экстендеры в послеоперационном периоде.
Все пациенты были приглашены на контрольное обследование. Состояние эректильной функции определялось с помощью устного опроса, анкетирования и фармакологического теста.
Во время устного опроса выясняли наличие потенциальных факторов риска развития ЭД. Кроме того, фиксировали все имеющиеся сопутствующие заболевания и характер проводимой по их поводу терапии. Для количественной оценки эректильной функции применялся опросник МИЭФ (вопросы 1–5 и 15).
С помощью анкетирования регистрировались оцениваемые самими пациентами функциональные результаты (patient-reported outcomes) по домену качества эрекции. По каждому домену предложено три варианта ответа: «удовлетворен», «относительно удовлетворен» и «не удовлетворен».
Результаты. Средний возраст пациентов составил 42,4±15,6 (от 28 до 72) года, медиана продолжительности наблюдения – 9,5 лет.
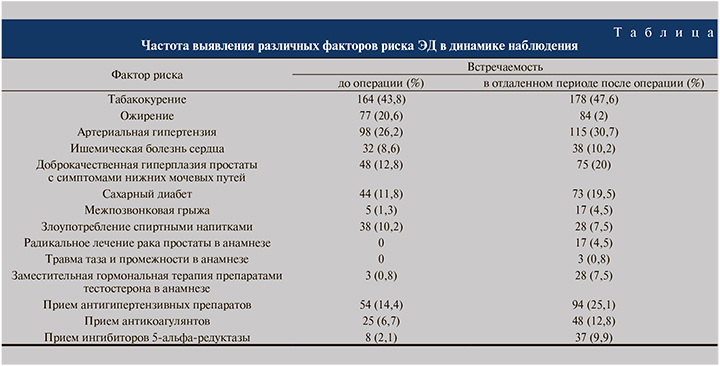
В таблице представлены факторы риска развития ЭД, зафиксированные у пациентов из нашей выборки. Встречаемость многих факторов риска очевидно возросла за время наблюдения.
На вопрос, насколько Вы удовлетворены качеством эрекции при проведении полового акта, 139 (48,8%) пациентов ответили «полностью удовлетворен», 84 (29,5%) – «относительно удовлетворен» и 62 (21,7%) пациента выбрали ответ «не удовлетворен».
Интракавернозный фармакологический тест (ИФТ) был выполнен 252 пациентами; 32 пациента отказались от выполнения данной процедуры. Пациентам, перенесшим фаллопротезирование, этот тест не предлагали (n=58). В качестве вазоактивного препарата был использован алпростадил, начальная доза которого составила 5 мкг, затем при необходимости титровалась до 20 мкг. Средняя доза алпростадила составила 11,7 мкг. У 185 (73,4%) пациентов при ИФТ эрекция достигла 5 баллов по шкале Юнема, у 59 (23,4%) – 4, у 8 (3,2%) – 3 баллов. У 17 пациентов в ответ на введение алпростадила развилась пролонгированная эрекция (>30 мин). Ни одного эпизода приапизма не было.
Большинство (n=285) пациентов к моменту контрольного визита вели активную половую жизнь. У 7 пациентов были редкие половые акты (1–2 в месяц). У 50 пациентов по различным причинам регулярной половой жизни не было. У 17 из 50 пациентов причиной отсутствия половой жизни была тяжелая, рефрактерная к терапии ЭД после лечения рака простаты (радикальная простатэктомия – 7, лучевая терапия – 4, андрогендепривационная терапия – 6). Рак простаты у этих пациентов был диагностирован в среднем через 2,4 года после корпоропластики. У 11 из 50 пациентов была тяжелая ЭД иного происхождения, не реагирующая на прием ингибиторов ФДЭ-5; эти пациенты имели противопоказания к хирургическому лечению ЭД. У 21 пациента были иные причины отсутствия половой жизни, не связанные с качеством эрекции, в том числе отсутствие партнерши. При этом четырем из них были установлены пенильные имплантаты.
Во избежание искажения результатов анализ данных анкетирования МИЭФ проводили только среди 285 пациентов, ведущих активную регулярную половую жизнь. Эректильную функцию оценивали без применения ваккумэрекционной терапии и интракавернозных инъекций. Все пациенты с показателем МИЭФ <15 баллов были вынуждены применять ваккум-эректоры или аутоинъекционную терапию для осуществления полового акта.
Среднее количество баллов (±стандартное отклонение) в домене ЭФ опросника МИЭФ в выборке составило 22,5±3,0; в домене либидо – 8,5±1,4.
У 105 (36,8%) пациентов, согласно данным опросника МИЭФ, ЭД отсутствовала (>26 баллов в домене ЭФ). У 74 (26%) пациентов была легкая ЭД (22–25 баллов); у 67 (23,5%) – легкая умеренная ЭД (15–21 балл); у 21 (7,4%) – ЭД средней тяжести (10–14 баллов), у 18 (6,3%) – тяжелая ЭД (<10 баллов). Все пациенты с числом баллов в домене ЭФ менее 15 были вынуждены использовать интракавернозную инъекционную терапию или вакуум-эректоры для осуществления полового акта.
Троим из восьми пациентов с подтвержденной венозной утечкой, достаточной длиной пениса (>15 см) и простой конфигурацией искривления с углом менее 40° мы выполняли пликацию белочной оболочки с резекцией глубокой дорсальной вены. Остальным 5 пациентам с веноокклюзивной дисфункцией мы выполняли заместительную корпоропластику с использованием графта из vena saphena magna и резекцию глубокой дорсальной вены полового члена. При этом только у 2 пациентов в отсроченном периоде наблюдалась ЭД, но она успешно поддавалась симптоматической терапии с использованием ингибиторов ФДЭ-5.
Обсуждение. Болезнь Пейрони – это состояние, способное вызывать определенные психосексуальные последствия, приводить к ЭД или усугублять имеющиеся органические причины ЭД. Этиология ЭД у пациентов с болезнью Пейрони может быть напрямую связана с наличием фиброзной бляшки и измененной анатомией пениса, а может иметь психогенный и/или васкулогенный компоненты. В то же время следует учитывать, что болезнь Пейрони и ЭД – самостоятельные заболеваниям, которые нужно диагностировать и лечить по отдельности. Наш ретроспективный анализ подчеркивает важность этого тезиса, а также необходимость обсуждать с пациентами потенциальные факторы риска ЭД и правильно формировать ожидания в отношении динамики эректильной функции после операции. Так, в отсроченном периоде качеством эрекции были полностью удовлетворены лишь чуть меньше половины пациентов (48,8%).
В литературе отмечено, что до 80% пациентов с болезнью Пейрони могут иметь сопутствующую ЭД. [8]. Трудно оценивать объективные показатели, так как в разных исследованиях применяются разные критерии диагностики ЭД: в основном это жалобы пациента при детальном расспросе и результаты анкетирования с помощью опросников, таких как МИЭФ. В исследовании L. Levine et al. [9] 103 (58,5%) из 176 пациентов с болезнью Пейрони целенаправленно обратились к врачу по поводу ЭД. Еще 71 (40,3%) пациент также отмечал ухудшение качества эрекции, но за помощью не обращался. Из-за наличия непрямой ассоциации между болезнью Пейрони и ЭД большому числу пациентов с болезнью Пейрони может потребоваться терапевтическое или хирургическое лечение ЭД. Важно понимать, что большинство методов хирургической коррекции искривления пениса не приводит к улучшению эректильной функции и не является гарантией ее сохранности в отдаленном периоде после операции. Инцизия/эксцизия бляшки с последующим графтингом может даже приводить к усугублению ЭД.
J. Lopez et al. [10] установили, что 36% пациентов с ЭД при болезни Пейрони имеют артериальную недостаточность, а у 59% обнаруживается веноокклюзивная дисфункция. Исследование [11] со сплошной выборкой из 99 мужчин с болезнью Пейрони показало, что у 52% из них была артериогенная ЭД, у 8% имела место венозная утечка. В вышеупомянутом исследовании [9] по применению силденафила цитрата этой категорией пациентов фармакодопплерография продемонстрировала, что у 42,2% больных была недостаточность артериального наполнения и только у 20,3% – веноокклюзивная дисфункция. J. Jarow et al. [12] указали на то, что мужчины с психогенной и васкулогенной ЭД лучше отвечают на силденафил, чем пациенты с нейрогенной ЭД, но не изучали отдельно пациентов с болезнью Пейрони. Не исключено, что у многих таких мужчин есть психогенный компонент ЭД, обусловленный физической деформацией пениса и болевыми ощущениями, поэтому от них можно ожидать высокой результативности консервативного лечения нарушений эрекции.
При этом возможности терапии ЭД при болезни Пейрони, в том числе после ее хирургического лечения, казалось бы, очевидны, учитывая широкую доступность ингибиторов ФДЭ-5. Тем не менее анатомические деформации полового члена, включая болезнь Пейрони, были и остаются относительными противопоказаниями к применению силденафила, первого и наиболее часто используемого препарата этого класса, что отражено в аннотации к нему. Это связано с тем, что мужчины с ЭД и болезнью Пейрони не принимали участия в клинических исследованиях перед тем, как силденафил, варденафил и тадалафил были одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Из-за этого консервативное лечение мужчин с ЭД и болезнью Пейрони представляется спорным. С другой стороны, уже были опубликованы результаты неслепого исследования с участием 73 мужчин с болезнью Пейрони и ЭД, получавших силденафил [9]. В этой популяции искривление не превышало 60°, так как авторами предполагалось, что с такой конфигурацией полового члена возможен пенетративный вагинальный секс. Пациенты получали силденафил с возможностью титрования дозы до 100 мг.
Удовлетворенность лечением оценивали путем опроса и заполнения опросника EDITS [13]. В вышеописанном исследовании L. Levine и et al. удовлетворенность пациентов проводимым лечением составила 71%, не отмечалось случаев усиления боли или деформации [11]. В нашей работе 78,3% пациентов в той или мной степени были удовлетворены результатами в отношении качества эрекции, с учетом того что им проводилось дефинитивное хирургическое лечение. Кроме того, в нее были включены больные разной степени эректильной деформацией пениса, что затрудняет полноценное сопоставление результатов консервативного и хирургического подходов.
Фаллопротезирование в сочетании с ручным моделированием или графтингом с определенными ограничениями позволяет гарантировать отсутствие ЭД в будущем, поэтому теоретически может применяться в отношении не только больных рефрактерными к терапии нарушениями эрекции в сочетании с болезнью Пейрони, но и пациентов с высокой вероятностью развития ЭД в ближайшие годы. В пользу этого говорит то, что удовлетворенность пациентов своей эректильной функцией в отсроченном периоде в нашем исследовании была далека от 100%. Еще одним доводом в пользу «превентивного фаллопротезирования» при болезни Пейрони является высокая частота факторов риска ЭД, таких как табакокурение (52%) и сахарный диабет (21,3%), в нашей популяции. Подчеркиваем, что данный подход еще не был изучен в рамках проспективных исследований и широко рекомендовать его нельзя. У 21 (6,1%) пациента не было возможности вести регулярную половую жизнь в отсроченном периоде после хирургической коррекции деформации пениса из-за отсутствия партнерши и других, не зависящих от качества эрекции причин, что также может говорить против расширения показаний к фаллопротезированию при болезни Пейрони. Тем не менее еще у 28 (8,2%) прооперированных не было половой жизни из-за рефрактерной к терапии ЭД, в том числе ассоциированной с лечением рака простаты. Поскольку эти пациенты могли бы получить положительный эффект от установки фаллопротеза, применение подобной превентивной тактики в отдельных случаях может быть оправданно и требует изучения в проспективных контролируемых исследованиях. Еще одним перспективным направлением может быть разработка мультивариабельных моделей, позволяющих прогнозировать вероятность развития тяжелой ЭД после корпоропластики с учетом ожидаемой продолжительности жизни и других факторов. Подобный инструмент позволил бы проводить обоснованный отбор кандидатов для превентивного фаллопротезирования в сочетании с корпоропластикой при болезни Пейрони.
Не все пациенты в отдаленном периоде наблюдения удовлетворены своей эректильной функцией после корпоропластики по поводу болезни Пейрони. В то же время, учитывая возрастание частоты независимых факторов риска ЭД, нарушения эрекции у них не всегда можно считать следствием оперативного лечения болезни Пейрони. Вопрос о расширении или ограничении показаний к фаллопротезированию при фибропластической индурации полового члена остается открытым.



