Введение. Согласно данным EAU Guidelines on Urological Infections (2019), 4-стаканная проба Meares–Stamey (1968) остается оптимальным тестом для диагностики хронического бактериального простатита (БП) (уровень доказательности [УД]: 2b, степень рекомендации [СР]: сильная) c высокими показателями чувствительности и специфичности на уровне 91%. В качестве альтернативного подхода рекомендовано применение 2-стаканного препостмассажного теста (ППМТ), разработанного J.C. Nickel et al. (1997), который в крупном проспективном исследовании продемонстрировал сопоставимые диагностические показатели чувствительности и специфичности ППМТ по отношению к «золотому» стандарту (УД: 2b, СР: сильный) [1, 2]. В то же время применение вышеупомянутых тестов противопоказано в отношении диагностики острого БП и на основании результатов нескольких проспективных и ретроспективных когортных исследований в качестве метода верификации микробных патогенов рекомендовано селективно проводить бактериологическое исследование средней порции мочи (СПМ) перед антибиотикотерапией (СР: C) [3].
В противовес этому, согласно Canadian Urological Association Guidelines on Prostatitis (2011), для идентификации микроорганизмов посев СПМ рекомендовано проводить всем пациентам с острым БП в обязательном порядке (УД: 2; СР: A) [4].
В аннотации пробы Meares–Stamey определено, что диагностически значимым уровнем в секрете простаты и постмассажной моче (ПММ) является идентификация грамотрицательных уропатогенов в титре, 10-кратно превышающем показатели концентрации аналогичных таксонов микроорганизмов в I (ПМ1) и II (ПМ2) порциях мочи либо полное отсутствие роста данных бактерий в ПМ1 и ПМ2 [5]. В более поздних работах в качестве порогового уровня содержания уропатогена в эксприматах (секрет простаты и эякулят), свидетельствующего о развитии воспалительного процесса бактериальной природы в простате, определен титр ≥105 КОЕ/мл [6, 7]. K. Naber et al. в обзоре о микробиологических аспектах диагностики простатита приводят данные интерпретации пробы Meares–Stamey и ППМТ, согласно которым при остром БП диагностически значимым титром является обнаружение в ПМ1 и ПМ2 >105 КОЕ/мл бактерий, а в случае хронического БП >104 КОЕ/мл – микроорганизмов в секрете простаты и ПМ3 при выполнении пробы Meares–Stamey и >104 КОЕ/мл бактерий в ПММ при ППМТ соответственно [8]. Согласно другим данным литературы, идентификация в секрете простаты и ПМ3 уропатогенов уже в концентрации >103 КОЕ/мл служит основанием для верификации хронического БП [9, 10].
Отсутствие консенсуса в диагностических критериях, в первую очередь в валидном титре идентифицированного в секрете простаты и ПМ3 уропатогена, затрудняет адекватную интерпретацию лабораторных данных практикующими врачами, на основании которых проводится дифференциальная диагностика хронического БП и других нозологических форм (в частности, уретрита, ХП/ СХТБ и т.д.), а также определяется терапевтическая тактика.
В связи со сказанным выше возникает два вопрос: 1) считать ли уровень бактериальной обсемененности секрета простаты и ПМ3 <104 КОЕ/мл у пациентов с дизурией дискомфортом или болью в промежности и другими симптомами основанием для назначения антибактериальной терапии; 2) является ли основанием для перевода пациента в группу «watchful waiting» (бдительного наблюдения) изолированная идентификация в секрете простаты и/или ПМ3 каузативного уропатогена в титре ≤103 КОЕ/мл в отсутствие клинических признаков простатита? Однако следует упомянуть, что несколькими клиническими исследованиями доказана роль бактериальной колонизации, приводящей к развитию субклинического персистирующего инфекционно-воспалительного процесса в простате, в формировании доброкачественной гиперплазии простаты/доброкачественной простатической обструкции, а также рака простаты [11, 12].
C целью изучения проблематики корреляционных особенностей течения бактериального простатита при идентификации низких титров уропатогенов в секрете простаты проведен информационный серфинг публикаций в базах данных MEDLINE/PubMed, ScienceDirect/Scopus, Embase-Elsevier, Cochrane Database, eLIBRARY с ключевыми словами bacterial prostatitis, low titers, low counts, prostatic secretion samples, uropathogens, experimental models, UTI, LUTS и применением тезауруса MeSH. К сожалению, небольшое количество актуальных, в основном экспериментальных, работ ориентировано в первую очередь на воспроизведение БП с использованием высоких титров каузативных уропатогенов (в частности, E. coli (107–108 КОЕ/мл) на изучение фармакодинамики и клинических эффектов различных комбинаций лекарственных препаратов, а не на изучение особенностей формирования инфекционно-воспалительных изменений в простате [13, 14].
Цель исследования: определить и сравнить в условиях экспериментального моделирования на лабораторных животных потенциальные особенности развития и течения инфекционно-воспалительного процесса в простате при инфицировании каузативным уропатогеном в низком титре.
Материалы и методы. Планирование дизайна и описательное представление его результатов базировались на рекомендациях ARRIVE и чек-листе проверки качества экспериментальных исследований [15–17].
Этическое заявление. Выполнение клинического исследования на лабораторных животных рассмотрено и одобрено Локальным независимым этическим комитетом ФГБОУ ВО РостГМУ Минздрава России на основании представленного дизайна и плана эксперимента (протокол № 16/17 от 05.10.2017).
Разработка и проведение клинической части эксперимента основаны на положениях, статьях и требованиях, отраженных в международных и отечественных документах и руководствах (согласно рекомендациям Rus-LASA), а именно: 1) на директиве 2010/63/EU Европейского парламента и Совета Европейского Союза от 22.09.2010 по охране животных, используемых в научных целях; 2) на рекомендациях рабочей группы FELASA по этической оценке экспериментов на животных; 3) на основных положениях Хельсинкской декларации (пересмотр 64-й WMA General Assembly, г. Форталеза, Бразилия, 10.10.2013); 4) на Европейской конвенции о защите позвоночных животных, используемых в экспериментальных и иных научных целях (ETS 123). Приложение А «Руководство по содержанию и уходу за животными» [18–21].
Характеристика лабораторных животных. В эксперименте использовано 16 половозрелых кроликов-самцов рода Oryctolagus cuniculus породы New Zealand массой 3,5±0,3 кг в возрасте 24±2 нед., прошедших ветеринарную проверку на отсутствие носительства T. cuniculi, E. cuniculi, Cl. piliformis, Salmonella spp., экзо- и эндопаразитов. Условия содержания животных в виварии отвечали санитарно-эпидемиологическим и гигиеническим нормам [22, 23]. Животных содержали по 1 особи в клетке (размером 85×120×95 см) с постоянным поддержанием условий микроокружения и искусственного освещения (температурный режим: 18,0±2,5°С; относительная влажность воздуха: 70%; режим «свет–темнота»: 12/12 ч). Все животные имели свободный доступ к пище и воде ad libitum, формирование рациона проводили из расчета потребления 150±20 г сухого гранулированного полнорационного корма и 200 мл жидкости на взрослую особь. Период адаптации лабораторных животных к новой среде и условиям обитания перед инициацией эксперимента составил 7 дней.
Экспериментальные штаммы. В качестве каузативного уропатогена использованы штаммы E. сoli (штамм № 32), выделенные из секрета простаты и ПМ3 (полученного путем проведения пробы Meares–Stamey) у пациентов с верифицированным БП II категории (NIH-NIDDK, 1995). Посев материала проводили в соответствии с разработанной методикой [24]. Верификацию микроорганизмов проводили по стандартной методике. Далее идентифицированные штаммы Е. coli переносили и культивировали в Tryptic-soy Вroth при температуре 37°С в течение ночи перед проведением инокуляции. Накануне эксперимента проводили титрование в фосфатно-буферном растворе полученной культуры уропатогена методом серийных разведений до достижения концентраций 103 КОЕ/мл, 105, 107 КОЕ/мл.
Рандомизация. Для минимизации ошибок отбора (selection bias) и повышения качества исследования по истечении адаптационного срока все животные были рандомизированы на 4 группы по 4 особи. Животным 1-й, 2 и 3-й групп была введена E. coli в титре 103, 105 и 107 КОЕ/мл соответственно, животным четвертой, контрольной, группы – sol. NaCl 0,9%. После инфицирования для снижения вероятности ошибок, связанных с ходом исследования, и предотвращения систематических ошибок при уходе и наблюдении за лабораторными животными разных групп (performance bias) проводили «ослепление» обслуживающего персонала и основных участников эксперимента путем присвоения индивидуального идентификационного кода каждой испытуемой особи.
Экспериментальное моделирование БП. На основании данных литературы и результатов эксплоративных вивисекций лабораторных животных нами разработана и апробирована экспериментальная модель воспроизведения рефлюксогенного БП. Методика инфицирования: в фиксированном положении на спине под общим обезболиванием (sol. Analgini 25% п/к и sol. Dimedroli 1% в/м; саппорт-анестезия emls. Propofoli Kabi 1%+sol. Natrii Chloridi 0,9% в/в до достижения хирургической стадии наркоза) после обработки наружных половых органов sol. Chlorhexidini bigluconatis 0,05% посредством модифицированного уретрального катетера Foley трансуретрально осуществляли компрессивную топическую инокуляцию 0,5 мл (эмпирически установленный объем простатической уретры) инфектанта Е. coli в простатический отдел уретры. Для снижения степени диссеминации инфектанта в ретроградном направлении симультанно баллончиком катетера проводили изоляцию нижних мочевых путей на уровне шейки мочевого пузыря. После экспозиции инокулята в простатической уретре в течение 30 мин катетер удаляли, выполняли повторное обезболивание sol. Analgini 25% п/к и sol. Dimedroli 1% в/м. Активный мониторинг состояния животных осуществляли в течение 2 ч после вмешательства.
Вивисекцию в каждой группе выполняли на 1-е, 3-и, 7-е, 14-е контрольные сутки наблюдения. Сакрификацию осуществляли под общим обезболиванием (по вышеуказанной схеме) путем интракардиальной инъекции sol. Lidocaini 2%, что приводило к exitus letalis ad stimulum. Посредством срединной лапаротомии послойно осуществляли доступ к органам таза. После удаления кишечника и перевязки всех магистральных сосудов, семявыносящих протоков и мочеточников органокомплекс (мочевой пузырь+простатический комплекс+проксимальная [мембранозная] уретра) извлекали единым блоком и подвергали препаровке.
Микробиологическое и патоморфологическое исследования.
В соответствии с анатомическим строением нижних мочевых путей и простатического комплекса (состоящего из пропростаты, простаты и парапростаты) лабораторных животных для бактериологического исследования формировали 6 (1А–1D, 2A–2B) биоптатов из определенных участков простатического комплекса с последующей кодировкой для ослепления персонала, выполняющего бактериологическое и морфологическое исследования, и для исключения ошибок детекции (detection bias). Участки ткани подвергали гомогенизации в аппарате механической дезагрегации BDTM MedimachineSystem («Becton, Dickinson and Company, BD Biosciences», США) в течение 15 мин с 10 мл
фосфат-буферного раствора. Далее методом серийных разведений выполняли 10-кратную дилюцию гомогената. Посев полученных образцов проводили на плотную питательную среду MacConkeyAgar («HiMedia», Индия) с последующей инкубацией в термостате ТС-1/80 СПУ («Смоленское СКТБ СПУ», РФ) при 37°С в течение 3 сут., после чего осуществляли количественную оценку роста колоний.
Для патоморфологического исследования через все слои формировали три продольных биоптата из медиального (1), латерального (2) участков органокомплекса и шейки мочевого пузыря (3). Фиксацию препаратов осуществляли путем экспозиции в 10%-ном розовом нейтральном забуференном формалине («БликМедиклПродакшн», РФ) в течение 2 сут., после чего обезвоживали и уплотняли по стандартной технологии. Срезы из парафиновых блоков формировали с помощью ротационного микротома Leica RM 2265 («Leica Mycrosystems», Германия), полученные препараты окрашивали гематоксилином и эозином («БликМедиклПродакшн», РФ). Патоморфологическую оценку и фотофиксацию гистологических изменений осуществляли путем световой микроскопии готовых препаратов (в разрешениях 10, 40, 100, 400) с помощью прямого светового микроскопа Leica DM2000 («Leica Microsystems», Германия) и цифровой камеры Leica DFC295 3 Mpx («Leica Microsystems», Германия).
Статический анализ. Обработку данных проводили с помощью пакетов прикладных программ Microsoft Excel Office 365 («Microsoft», США) и Statistica 10.2 («StatSoft Inc.», США). Описательная статистика количественных признаков представлена в виде центральной тенденции медианы (Me) и интерквартильного размаха (25-й и 75-й процентили; LQ; UQ), верхних и нижних пределов (min–max), а также среднего (M) и стандартного отклонения среднего (m).
Результаты и обсуждение. В ходе работы спонтанной летальности лабораторных животных от осложнений или дефектов реализации эксперимента на этапе инфицирования не зарегистрировано.
Простата кролика представляет собой комплекс, состоящий из четырех отдельных независимых структур, располагающихся дистальнее мочевого пузыря и дорсальнее простатической уретры: пропростаты, собственно простаты и двух парапростат, вплотную прилегающих друг к другу и окруженных общей соединительнотканной капсулой, которая дорсально отграничивает данные анатомические образования от стенок предпрямой и прямой кишки, а вентрально прилегает к семявыносящим протокам [25].
Бактериологическое исследование. Применение разработанной трансуретральной методики воспроизведения рефлюксогенного БП позволило вызвать контаминацию тканей внутренних половых органов животных во всех случаях (см. таблицу).

Наибольшая степень бактериальной обсемененности зафиксирована в биоптатах, соответствующих расположению парапростаты (1D), дистальной части простаты (1А), и составила 4,0±1,7 и 3,5±1,9 lg КОЕ/мл соответственно, наименьшая – локусам проксимальной пропростаты (1С) и шейки мочевого пузыря (2B) – 3,0±1,2 и 3,0±1,7 lg КОЕ/мл соответственно. Интерпретировать этот факт можно, опираясь на теоретические основы разработанной методики трансуретрального инфицирования, которая предполагает развитие интрапростатического рефлюкса как одного из основных патогенетических механизмов возникновения БП [26]: путем компрессионного нагнетания инокулята через артифициальные отверстия модифицированного катетера, которые после наполнения баллончика в полости мочевого пузыря и создания обструкции на уровне его шейки, согласно результатам анатомических расчетов эксплоративных вивисекций, должны располагаться в проекции отверстия семенного бугорка. Таким образом, наибольшая степень контаминации парапростаты и дистальной части простаты обусловлена тем, что анатомически в непосредственной близости от них (несколько медиальнее и каудальнее) располагается семенной бугорок и рудиментарный аналог простатической маточки, в которой сливаются семявыносящие, а также выводные протоки парапростат и простаты. Соответственно, через эти протоки инфектант может поступать в данные анатомические структуры. Пропростата, особенно ее проксимальная часть, расположена на значительном удалении от семенного бугорка и визуально не имеет выводных протоков в простатическую маточку, т.е. диссеминация инфекции на нее осуществляется per continuitatem путем распространения с ткани простаты. Шейку мочевого пузыря в свою очередь обтурировали баллончиком катетера в течение достаточно продолжительного промежутка времени – это препятствует значительному распространению инокулята в ретроградном направлении и формированию цистита.
Погрупповой анализ результатов показал, что наибольшая совокупная контаминация биоптатов зафиксирована в 1-й группе, при этом титр бактерий прогредиентно рос от 1-х к 7-м суткам и на 14-е сутки снижался до минимальных значений. Парадоксально, что во 2-й и 3-й группах совокупная микробная нагрузка оказалась соответственно в 1,4 и 1,9 меньше, чем в 1-й группе, а наивысший посуточный титр во всех биоптатах отмечен в 1-е сутки в обеих группах. При этом во 2-й группе в последующем зафиксировано двукратное снижение контаминации тканей на 3-и сутки и практически симметричный рост обсемененности на 7-е с сохранением этих показателей к 14-м суткам. В 3-й группе, напротив, отмечено прогредиентное снижение совокупных посуточных титров с 3-х к 14-м суткам (рис. 1).
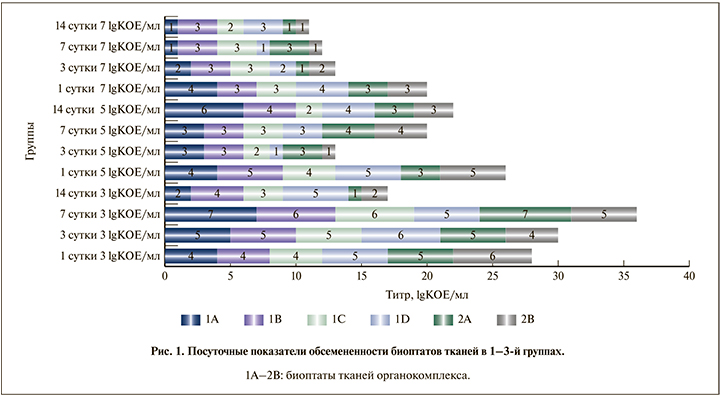
Следует отметить, что в контрольной группе зафиксирован рост резидентных, преимущественно анаэробных, моно- и поликомпонентных смешанных микробных ассоциаций (Propionibacterium spp., Eubacterium spp., Bacteroides spp. и т.д.) в максимальном титре до 104 КОЕ/мл.
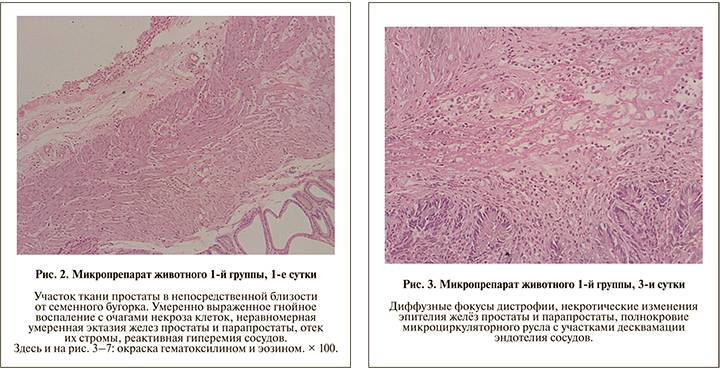
Патогистологическое исследование. Результаты гистологического исследования в полной мере коррелировали с данными микробиологического исследования только в 1-й группе. Так, в 1-е сутки после инфицирования E. coli 103 КОЕ/мл в стенке семенного бугорка и окружающей его ткани простаты и парапростаты определялись умеренно выраженное гнойное воспаление с очагами некроза клеток, неравномерная умеренная эктазия желез простаты и парапростаты, отек их стромы с отложением в ней фибрина, а также полнокровие сосудов с набуханием клеток эндотелия; в клеточном инфильтрате преобладали нейтрофилы с участками скоплений эозинофилов (рис. 2). К 3-м суткам в ткани простаты и парапростаты определялось выраженное гнойное воспаление с развитием мелких диффузных фокусов дистрофии, сопровождавшееся некротическими изменениями эпителия желез простаты и парапростаты, а также значительным полнокровием микроциркуляторного русла с участками десквамации эндотелия сосудов (рис. 3); на 7-е сутки отмечались сходные гистологические изменения с увеличением количества гнойно-деструктивных очагов в поле зрения, максимально выраженным отеком стромы желез простаты и парапростаты и резкой плеторой окружающих питающих сосудов; при этом в некоторых участках нейтрофильно-эозинофильный состав инфильтрата сменялся на лимфогистиоцитарный (рис. 4).
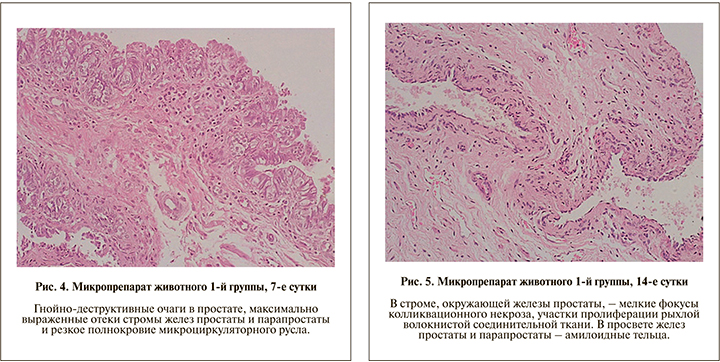
На 14-е сутки в препаратах визуализированы изменения, характерные для перехода экссудативной фазы воспаления в пролиферативную, а именно извитость желез простаты, в просветах которых определялись амилоидные тельца, в строме, окружавшей железы простаты, имело место формирование мелких фокусов колликвационного некроза и появление участков ремоделирования тканей, сопровождавшее пролиферацией рыхлой волокнистой соединительной ткани; клеточный состав имел смешанную структуру с наличием участков умеренной лимфогистиоцитарной инфильтрации с плазматическими клетками, преобладающими в первую очередь в эпителиальных структурах, а также диффузных очагах нейтрофильно-макрофагальной инфильтрации; при этом во всех участках препарата сохранялись умеренное полнокровие сосудов и отек интерстиция (рис. 5).
В препаратах шейки мочевого пузыря на протяжении всего периода исследования регистрировали гидропическую дистрофию клеток уротелия, которая к 14-м суткам сменялась очаговой десквамацией эпителия с появлением фокусов неравномерной гиперплазии, а также персистирующее полнокровие сосудов и отек стромы.
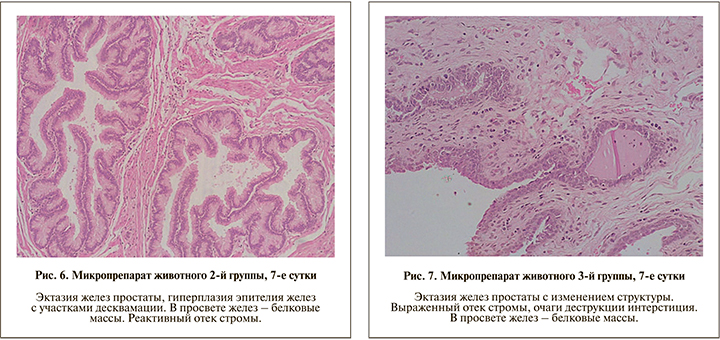
Во 2-й и 3-й группах результаты патоморфологического исследования показали наличие выраженных воспалительных изменений в структурах простатического комплекса. Поскольку наиболее выраженные воспалительные изменения при инфицировании уропатогеном в титре 103 КОЕ/мл были определены на 7-е сутки и коррелировали с результатом микробиологического исследования, проведено сопоставление данных посева и патоморфологических изменений на 7-е сутки в группах инокуляции 105 КОЕ/мл и 107 КОЕ/мл. Так, во 2-й группе уже на 7-е сутки в интерстиции отмечали формирование рыхлой волокнистой соединительной ткани, железы простаты были эктазированы, в просвете содержали умеренное количество эозинофильных белковых масс, отдельные участки железистого эпителия были десквамированы, отмечались резкое полнокровие сосудов, выраженный отек и умеренная нейтрофильно-эозинофильная гранулоцитарная инфильтрация стромы между железистыми структурами (рис. 6). В 3-й группе на 7-е сутки были обнаружены симилярные по отношению к зафиксированным во 2-й группе гистологические изменения, отличавшиеся более выраженной десквамацией эпителия с формированием некротических очагов в железах простаты и локусов деструктивных изменений в межуточном веществе, сопровождавшихся деструктуризацией стромы (рис. 7).
Кажущееся противоречие микробиологических и гистологических результатов исследований может объясняться развитием гипериммунной клеточной реакции в ответ на инфицирование высокими титрами уропатогена, что в конечном итоге приводит к быстрой элиминации возбудителя, и снижением общем бактериальной обсемененности тканей органокомплекса. В подтверждение данной гипотезы следует привести факт, отмеченный при проведении вивисекций лабораторных животных из экспериментальных групп: макроанатомическая регистрация выраженных воспалительных изменений со значительным гнойным компонентом имела место быть при вскрытии животных на 3-и и 7-е сутки, как из 2-й, так и из 3-й групп. При этом сопоставимых по эксплицитности визуальных морфологических изменений при оценке секционного материала животных из 1-й группы зарегистрировано не было.
Подобные данные приводят J. C. Nickel et al. [27]: по результатам эксперимента у 100% крыс Sprague–Dawley на 3-и сутки после инфицирования штаммом E. coli K-235 в титре 108 КОЕ/мл определены изменения, характерные для острого БП. Однако исследователи отметили, что после вскрытия другой серии животных через 7 нед. наблюдения приблизительно от 50% особей получены отрицательные результаты бактериологического анализа тканей простаты, а патогистологическое исследование биоптатов не выявило морфологических изменений, характерных для хронического БП [27]. Исследовательская группа под руководством Y. S. Lee (2005) также отмечает, что при инфицировании штаммом E. coli Z17 в титре 108 КОЕ/мл крыс Wistar в 58,6% случаев (41 из 70 особей) по результатам микробиологического и морфологических исследований, проведенных через 4 нед. после инокуляции, в биоптатах простаты не зафиксировано бактериологических и патогистологических изменений, характерных для хронического БП [28].
Также необходимо отметить, что патогистологическое исследование биоптатов тканей органокомплекса в контрольной группе не выявило инфекционно-воспалительных изменений в исследуемых анатомических структурах ни на одном из контрольных сроков наблюдения.
Заключение. В результате экспериментального исследования установлено, что низкий титр каузативного уропатогена Е. coli (103 КОЕ/мл) способен вызывать развитие инфекционно-воспалительного процесса в простате, сопровождающегося появлением фокальных гнойно-деструктивных процессов, исходом которых являются необратимые пролиферативные изменения.
Таким образом, считаем целесообразным использование антибактериальных препаратов в группе пациентов, у которых в секрете простаты после пробы Meares–Stamey или препостмассажного теста по данным бактериологического исследования верифицированы низкие титры каузативных патогенных микроорганизмов.



