Введение. Бесплодие в браке – распространенная проблема, которая затрагивает около 15% супружеских пар. Порядка 50% случаев бесплодия связаны с так называемым мужским фактором [1]. На 1-м месте среди причин мужского бесплодия (30%) стоит идиопатическое бесплодие. Однако его доля постепенно сокращается благодаря тому, что появляются научные данные, позволяющие выявлять причины этого состояния [2]. Второй по частоте (14,8%) причиной бесплодия служит варикоцеле: 80% случаев вторичного бесплодия у мужчин связано именно с ним [3].
Известно, что оплодотворяющая способность сперматозоидов зависит от секреторной активности вспомогательных половых желез: придатков яичек, простаты и семенных пузырьков. Наиболее важным биохимическим маркером нормального созревания сперматозоидов является L-карнитин, продуцируемый придатком яичка [4]. Физиологическая роль придатка яичка заключается в создании условий для нормального развития сперматозоидов путем секреции ряда соединений, в том числе L-карнитина, участвующего в переносе ацил-группы и процессе окислительного фосфорилирования жирных кислот в митохондриях, как следствие – обеспечении энергией, используемой сперматозоидами для созревания и приобретения ими подвижности. Также установлено, что L-карнитин и ацетил-L-карнитин обладают антиоксидантной активностью за счет удаления токсичного внутриклеточного ацетил-кофермента А и стабилизации клеточной мембраны сперматозоидов под действием активных форм кислорода, гиперпродукция которых является важным патогенетическим фактором патоспермии у мужчин [4, 5]. Следует отметить, что существует прямая корреляция между концентрацией в сперме карнитина, с одной стороны, и количеством, общей и прогрессивной подвижностью, способностью сперматозоидов проникать в цервикальную слизь, с другой.
В то же время другой патологический процесс – фрагментация ДНК сперматозоидов – нарушение целостности ДНК сперматозоидов, связанное с упаковкой патологического хроматина или дефицита протамина, оказывает негативное влияние на репродуктивные исходы при естественном зачатии или в программах вспомогательных репродуктивных технологий (ВРТ) [6, 7]. У бесплодных мужчин доля сперматозоидов с нарушением целостности ДНК составляет более 30%, тогда как у здоровых фертильных мужчин она не превышает 15%. При фрагментации ДНК спермы более 30% вероятность наступления беременности крайне низкая [8].
В здоровом организме существует баланс между оксидантными и антиоксидантными системами, обеспечивающий нормальное функционирование клеток. Обе системы одинаково важны для организма. Однако при нарушении этого соотношения могут развиваться различные патологические процессы. В случае недостаточности оксидантной системы нарушаются защитные механизмы клетки, угнетается апоптоз, возможны диспластические процессы, включая злокачественное перерождение клеток. При плохой работе антиоксидантной системы, наоборот, имеют место излишняя гибель клеток, повышенный апоптоз, в том числе повреждение сперматозоидов [9, 10].
Оксидативный стресс сперматозоидов – это широко распространенное патологическое состояние, возникающее вследствие смещения такого баланса в пользу оксидантной системы, признаки которого можно обнаружить у 30–80% мужчин с бесплодием [11]. Повреждения наносятся в основном активными формами кислорода и азота, пероксидами и свободными радикалами. Их источниками могут служить как непосредственно сперматозоиды, так и лейкоциты спермы [12].
Причины оксидативного стресса хорошо известны, среди них: неблагоприятные факторы образа жизни и окружающей среды, возраст, сопутствующие заболевания и прием препаратов для их лечения, онкологические заболевания. Сперматозоиды уязвимы перед действием оксидативного стресса, их мембраны содержат большое количество полиненасыщенных жирных кислот, при повреждении мембраны снижается подвижность сперматозоидов, так как они почти не имеют собственной антиоксидантной системы в цитоплазме (представляют собой ядро со жгутиком для движения). Защитные факторы, которые должны содержаться в обычной клетке, в сперматозоиде практически отсутствуют. Отчасти эту функцию на себя берет семенная плазма, именно там содержится основная доля веществ с антиоксидантными свойствами. Однако при их недостатке ДНК сперматозоидов практически беззащитна перед прямым воздействием оксидативного стресса [13].
В этом случае может быть использована антиоксидантная терапия. В современной литературе имеются неопровержимые данные масштабных исследований, подтверждающих эффективность и безопасность антиоксидантов, применяемых в современной врачебной практике с целью стимуляции сперматогенеза при бесплодии у мужчин [14, 15].
Кокрановские данные (2011) [16] и рекомендации Европейского общества урологов (EAU) 2015 г. показывают, что пероральный прием антиоксидантов улучшает результаты ВРТ, но его влияние на естественное зачатие требует дальнейшего изучения.
В Кохрановском обзоре (2014) [17] эффекта применения пероральных антиоксидантов и микроэлементов 4179 субфертильными мужчинами из 48 рандомизированных клинических исследований было показано, что употребление в пищу антиоксидантов и микроэлементов способствует повышению шансов на зачатие для субфертильных пар, при этом не отмечено увеличения риска репродуктивных потерь.
Наибольший и вполне обоснованный интерес представляют лекарственные комплексы для воздействия на различные факторы нарушения сперматогенеза (олиго-, астено-, тератозооспермия), оксидативного стресса и уровень фрагментации ДНК сперматозоидов.
Препарат, содержащий ацетил-L-карнитин, L-карнитин и альфа-липоевую кислоту (СпермАктин® Форте), может быть использован в лечении мужского бесплодия и репродуктивных потерь, при повышенном уровне оксидативного стресса и фрагментации ДНК сперматозоидов [13].
Целью настоящего исследования было изучить влияние комплекса ацетил-L-карнитина, L-карнитина фумарата и альфа-липоевой кислоты (СпермАктин® Форте) на показатели оксидативного стресса, качества эякулята и фрагментации ДНК сперматозоидов у мужчин с бесплодием.
Материалы и методы. Исследовательская работа (двойное слепое плацебо-контролируемое рандомизированное сравнительное исследование влияния комплекса ацетил-L-карнитина, L-карнитина и альфа-липоевой кислоты на показатели оксидативного стресса и фрагментации ДНК сперматозоидов) проводилась на базе отделения андрологии и урологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В. И. Кулакова» Минздрава России и заключалась в регистрации клинических и лабораторных данных пациентов, которым лечащий врач в рамках повседневной клинической практики назначал 180-дневный курс терапии антиоксидантным комплексом СпермАктин® Форте в стандартной дозировке или плацебо.
Критерии включения:
- отсутствие беременности более 12 мес. при регулярной половой жизни без контрацепции;
- невынашивание беременности супругой при наличии повышенных показателей фрагментации ДНК спермы и оксидативного стресса у мужчины;
- неоднократные неудачи программ ВРТ при наличии повышенных показателей фрагментации ДНК спермы и оксидативного стресса у мужчины;
- нормальное развитие по данным физикального обследования.
Критерии невключения:
- наличие активных воспалительных процессов;
- лабораторные признаки воспалительных изменений придаточных половых желез;
- установленные генетические причины бесплодия (синдром Клайнфельтера, микроделеции AZF, CFTR);
- криптозооспермия;
- азооспермия;
- некрозооспермия;
- пиоспермия;
- гипергонадотропный и гипогонадотропный гипогонадизм;
- варикоцеле;
- наличие иммунной формы бесплодия (MAR-test IgG >50%);
- выраженная соматическая патология;
- психосексуальная и эякуляторная дисфункции.
В открытом проспективном рандомизированном исследовании участвовали 80 мужчин в возрасте 25–45 лет (средний возраст – 34,9 [30; 39] года) с бесплодием и повышенными уровнями фрагментации ДНК сперматозоидов и оксидативного стресса.
Все участники были разделены методом адаптивной динамической рандомизации со стратификацией на две группы.
Группу А составили 20 мужчин, которые принимали плацебо на протяжении 180 дней. В группу В вошли 60 мужчин, принимавших ацетил-L-карнитин, L-карнитин фумарат и альфа-липоевую кислоту (СпермАктин® Форте) по 1 саше по 10 г 1 раз в день, утром, во время или после еды, на протяжении 180 дней.
Клиническое наблюдение заключалось в регистрации демографических и клинических данных пациентов (оценка общего состояния, осмотр, оценка сексуального здоровья, а также наступление беременности у супруги) до и после окончания 180-дневного указанного курса терапии, а также через 90 дней после начала терапии.
Лабораторное наблюдение заключалось в получении образцов спермы пациентов исходно, через 90 и 180 дней после начала терапии и изучении их по показателям спермограммы (концентрация, подвижность, морфология сперматозоидов по строгим критериям Крюгера в соответствии с требованиями ВОЗ (2010)), оксидативного стресса и фрагментации ДНК сперматозоидов.
Критерии оценки эффективности: показатели спермограммы, показатели уровня фрагментации ДНК сперматозоидов, уровня оксидативного стресса сперматозоидов, факт наступления беременности, информацию о которой получали путем опроса всех пациентов – участников исследования.
Статистическая обработка. Результаты по изучаемым параметрам представлены с помощью описательных статистик – медианы (Me) и квартилей [Q1; Q3].
Для проверки нормальности распределения использовали критерий Шапиро–Уилка. Для попарного сравнения групп использовали критерий Манна–Уитни. Статистическую значимость динамики показателей оценивали с помощью критерия Вилкоксона. Для всех критериев устанавливали критический уровень α=0,05.
Результаты. Группы были сопоставимыми по таким показателям, как возраст, длительность бесплодия в браке, физикальные данные, а также по параметрам спермограммы, МАР-теста и уровня фрагментации ДНК сперматозоидов. Лишь по уровню оксидативного стресса (концентрации активных форм кислорода (ROS)) в группе В наблюдалось достоверное (р<0,05) превышение по сравнению с группой А.
Сравнительная характеристика больных в зависимости от группы лечения по различным критериям представлена в табл. 1.

Концентрация сперматозоидов. В ходе исследования в обеих группах наблюдалось незначительное снижение концентрации сперматозоидов, однако эти изменения не были статистически значимыми, не приводили к развитию олигозооспермии и не выходили за рамки нормативов ВОЗ (2010) (табл. 2).
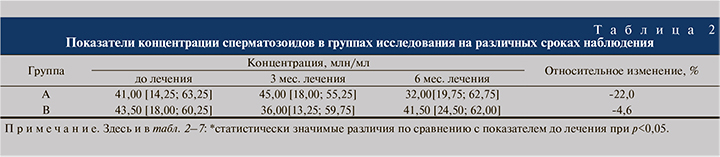
Подвижность сперматозоидов. Согласно критериям ВОЗ (2010), по оценке показателей спермограммы проводили анализ результатов прогрессивной подвижности сперматозоидов (категория А+В). В группе А отмечено значительное снижение прогрессивной подвижности сперматозоидов (на 22,5% к 6-му месяцу лечения), т.е. наблюдалась выраженная отрицательная динамика по данному показателю.
В группе В, напротив, констатировали увеличение прогрессивной подвижности практически в 1,4 раза (с 29 до 40% [на 37,9%]), что стало статистически значимым уже к концу 3-го месяца лечения (табл. 3).
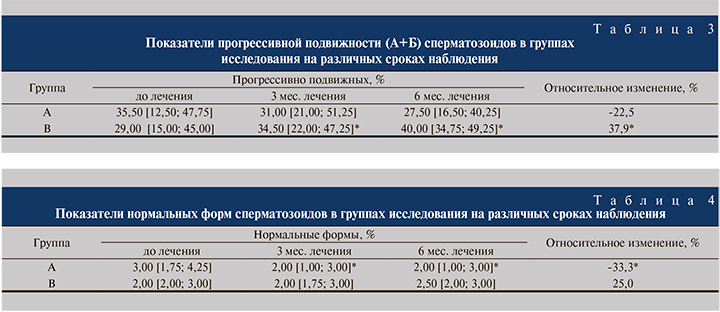
Патологические формы сперматозоидов. Количество патологических форм сперматозоидов в группе В достоверно не изменялось ни через 3, ни через 6 мес. лечения (табл. 4).
В то же время в группе А наблюдалось достоверное ухудшение этого показателя (на 33,3%) уже к 3-му месяцу лечения (см. табл. 4).
Оксидативный стресс сперматозоидов оценивали по концентрации активных форм кислорода (свободных радикалов – ROS). При этом оказалось, что в группе А ситуация значительно ухудшилась: уровень оксидативного стресса к концу периода наблюдения вырос в 2 раза (на 103,2%).
В группе В, наоборот, отмечено значительное улучшение данного показателя – снижение на 86%, что стало статистически значимым, причем уже к 3-му месяцу лечения (табл. 5).

Фрагментация ДНК сперматозоидов. При определении степени фрагментации ДНК сперматозоидов методом TUNEL отмечалось снижение показателя в обеих группах исследования. Однако в группе А оно составило всего лишь 3,6% и не было статистически значимым, тогда как в группе В параметр уменьшился на 21,5%, достоверно отличаясь от исходных значений уже по прошествии 3 мес. лечения (табл. 6).
MAR-тест. В группе А показатель МАР-теста статистически значимо снизился на 28,6%, однако эти изменения находились в пределах нормативных значений (табл. 7).

Побочных эффектов фармакотерапии зафиксировано не было.
Дополнительная информация. В период исследования 1 пациент (5%) из группы А и 13 пациентов (21,7%) из группы В, сообщили о наступлении беременности у супруги на фоне лечения. В группе А беременность закончилась выкидышем на сроке 7–8 нед., в группе В у 11 пар родились здоровые дети, в 1 случае имела место неразвившаяся беременность на сроке 5–6 нед., в 1 – анэмбриония.
Таким образом, у мужчин с бесплодием на фоне приема препарата антиоксидантного комплекса СпермАктин® Форте отмечалась положительная динамика основных параметров спермограммы, таких как подвижность и морфология. Примечательно, что в группе А прогрессивная подвижность сперматозоидов значительно снизилась за время наблюдения на 22,5%, напротив, в группе В было отмечено возрастание прогрессивной подвижности на 37,9%, что стало статистически достоверным, причем уже к 3-му мес. лечения. Количество патологических форм сперматозоидов в группе В достоверно не изменялось, однако в группе А наблюдалось достоверное ухудшение этого показателя на 33,3% уже в первые месяцы терапии. Одним из важных тестов – оксидативный стресс сперматозоидов (количество свободных радикалов [ROS]), демонстрировал значительное ухудшение в группе А, тогда как в основной группе – В, наоборот, отмечено значительное улучшение данного показателя – снижение на 86%, что стало статистически достоверным, причем уже к 3-му мес. лечения. При определении степени фрагментации ДНК отмечалось снижение ее показателей во всех группах исследования, однако в группе А такое снижение составило всего лишь 3,6%, в группе В уменьшение составило 21,5% к 3-му мес. лечения, при этом к 6 мес. лечения среднее значения данного показателя составило 15,35%, что можно считать нормативным. Данные факты позволяют говорить, что использование антиоксидантного комплекса СпермАктин® Форте позволило улучшить показатели спермограммы большинства пациентов, снизить уровень оксидативного стресса и фрагментации ДНК сперматозоидов, причем положительный эффект проявился уже к 3-му месяцу использования препарата. Стимуляция сперматогенеза с помощью антиоксидантного комплекса СпермАктин® Форте является эффективным и безопасным методом лечения мужского бесплодия. Однако требуются дополнительные исследования для получения более подробных данных, а также с целью оценки дополнительных возможностей компонентов антиоксидантного комплекса. Что особенно хотелось подчеркнуть, что в 13 случаях пациенты сообщили о наступлении беременности у супруги на фоне лечения, что позволяет говорить о положительных исходах не только по лабораторным значениям, но и по конечным точкам терапии.
Выводы
- Стимуляция сперматогенеза с помощью антиоксидантного комплекса СпермАктин® Форте является эффективным и безопасным методом лечения мужского бесплодия.
- Прием данного препарата позволяет снизить уровень оксидативного стресса на 86% и фрагментации ДНК сперматозоидов на 21,5%, а также улучшить показатели спермограммы большинства пациентов уже к 3-му месяцу лечения.
- Прием комплекса СпермАктин® Форте более чем в 4 раза увеличивает вероятность зачатия. Результат терапии: 85% успешно завершившихся родов.
- Данная терапия может быть использована как I этап лечения мужчин с бесплодием, репродуктивными потерями (невынашивание беременности, неразвивающаяся и внематочная беременность у супруги, неудачи предшествовавших программ ВРТ).
- В отсутствие естественной беременности терапия с помощью антиоксидантного комплекса СпермАктин® Форте может быть рассмотрена в качестве подготовки ко II этапу лечения – проведению программ ВРТ с целью повышения их эффективности.
Прием СпермАктин® Форте не вызывал каких-либо нежелательных явлений.



