Введение. Частоту бесплодных браков в России и других развитых странах оценивают в пределах 11–20%, из них до 45% случаев связано с бесплодием у мужчин, представляя собой актуальную проблему в современной андрологии и урологии [1]. При диагностике мужского бесплодия поэтапно исключают наиболее частые причины заболевания: инфекции мочеполовой системы, варикоцеле, травмы, системные заболевания, прием стероидов и некоторых других препаратов, хронические стрессы, аномалии развития органов мочеполовой системы. В отсутствие выявленных причин заболевания проводят молекулярно-генетические исследования, причем доля генетически обусловленных форм бесплодия в этой группе пациентов может достигать 20% в зависимости от вида отклонения в спермограмме. В качестве молекулярно-генетических причин бесплодия у мужчин рассматривают микроделеции в области AZF на Y-хромосоме, компаунд-гетерозиготы по тяжелой и мягкой мутациям CFTR, как маркеры предрасположенности – длинные аллели CAG-повтора гена андрогенового рецептора (AR) [2].
Микроделеции Y-хромосомы, затрагивающие область AZF (azoospermia factor), могут включать субрегионы AZFa, b и/или c и приводить к утрате генов USP9Y, DBY, UTY, TB4Y и других локусов, участвующих в регуляции сперматогенеза. Одновременные делеции субрегионов AZFa, b или нескольких субрегионов становятся причиной азооспермии, частичные делеции субрегиона AZFc могут приводить к олигозооспермии [3].
Ген CFTR кодирует трансмембранный регулятор проводимости, который участвует в транспорте ионов хлора через плазматическую мембрану и в формировании секрета эпителиальных клеток. Компаунд-гетерозиготы по тяжелой и мягкой мутациям CFTR не имеют клинической картины муковисцидоза, как пациенты с инактивацией обоих аллелей. Однако у них наблюдают проявления гаплонедостаточности – измененную концентрацию ионов хлора и электролитов, повышенную вязкость секрета в мелких протоках желез внешней секреции, что ассоциировано с агенезией семявыносящих протоков (CBAVD – congenital bilateral absence of the vas deferens) [4]. В России с диагностической целью, как правило, проводят определение наиболее частых мутаций CFTR с помощью тест-систем, использующих метод ПЦР [5, 6].
Андрогены играют важную роль в функционировании мужской половой системы и сперматогенезе, реализуя свое действие через андрогеновый рецептор, который кодируется геном AR. В первом экзоне AR расположен полиморфный CAG-повтор, соответствующий полиглутаминовому тракту вариабельной длины. Длина повтора обратно пропорциональна способности рецептора активировать транскрипцию генов-мишеней, что может иметь значение в патогенезе бесплодия у носителей длинных аллелей [7].
Молекулярно-генетические тесты имеют свои показания: в частности, мутации CFTR рекомендуют исследовать у мужчин с обструктивным бесплодием, кроме того, перед молекулярно-генетическим тестированием следует выполнять цитогенетический анализ для исключения хромосомной патологии. Однако зачастую проводят комплексную лабораторную диагностику, при которой одновременно определяют выбранную клиникой (лабораторией) панель биохимических, иммунологических, цито- и молекулярно-генетических маркеров [8, 9]. Целью настоящей работы стало выявление молекулярно-генетических нарушений, которые целесообразно одновременно тестировать у мужчины с неустановленной на текущий момент формой бесплодия для повышения информативности лабораторной диагностики.
Материалы и методы. Характеристика выборки. Проведено ретроспективное исследование, в которое вошли 885 мужчин с бесплодием, обследованных в 2006–2018 гг., среди которых 43% составляли пациенты с азооспермией, остальные – с олигозооспермией. Все пациенты дали информированное согласие. Важным критерием отбора было назначение молекулярно-генетических тестов до получения результатов остальных методов диагностики, что позволило оценить частоту генетических нарушений при обследовании гетерогенной группы первичных пациентов без окончательно верифицированной формы бесплодия.
Выделение ДНК. Геномную ДНК выделяли из образцов периферической крови методом сорбции на кремниевом носителе с помощью набора ДНК-сорб-В (ООО «Некстбио», Россия) или его аналога.
Анализ делеций AZF. Делеции области AZF выявляли методом мультиплексной ПЦР с последующим электрофорезом в полиакриламидном геле (ПААГ) и окраской нитратом серебра. Амплифицировали по 3 STS-маркера в субрегионах AZFa, b и 4 – в AZFc; всего 12 локусов, разделенных по четырем мультиплексным ПЦР. В качестве контролей на Y-хромосому использовали локусы SRY и AMELX/Y, положительного контрольного образца – ДНК мужчины без делеций на Y-хромосоме. Делеции субрегионов AZF выявляли по отсутствию ПЦР-продуктов соответствующих им STS-маркеров (рис. 1).
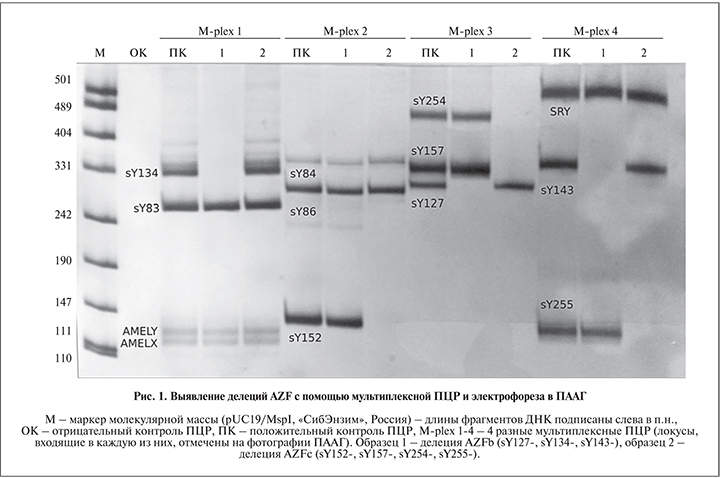
Выявление частых мутаций в гене CFTR. В настоящей работе определяли следующие частые мутации CFTR: F508del, CFTRdel2,3(21kb), I507del, 1677delTA, 2143delT, 2184insA, 394delTT, W1282X, G542X, N1303K, R334W и 5Т. Для выявления делеций и инсерции проводили мультиплексную ПЦР участков экзонов 3, 10, 13 и области делеции 21 kb. Генотипирование по аллелям 5Т-9Т проводили методом гнездовой ПЦР локуса IVS8(T)n. Остальные четыре мутации определяли с помощью мультиплексной ПЦР и реакции удлинения внутреннего праймера в позиции тестируемой мутации (SNaPshot) в участках экзонов 7-го, 11, 20, 21-го генов CFTR (см. табл. 1) с последующим фрагментным анализом на капиллярном генетическом анализаторе 3500xl («Thermo Fisher Scientific», США). В реакции SNaPshot использовали следующие внутренние праймеры: tgggattcaataacttccaaacagtg (1282m, 26 н.), tccctatgcactaatcaaaggaatcatcctc (334m, 31 н.), gctcgttgacctccactcagtgtgattccaccttctc (542m, 37 н.) и обратный праймер на экзон 21 (21 н.).

Определение длины CAG-повтора гена AR. Участок экзона 1 гена AR, содержащий CAG-повтор, амплифицировали с участием праймера, конъюгированного с флуорофором FAM (см. табл. 1), затем определяли длину ПЦР-продукта методом фрагментного анализа на капиллярном секвенаторе 3500xl. Полученные значения в п.н. сравнивали с положительными контролями – образцами ДНК мужчин с ранее секвенированными CAG-повторами известной длины.
Статистический анализ данных. Сравнивали выявленные в настоящей работе частоты делеций AZF и мутаций CFTR с ранее опубликованными данными, для чего применяли точный двусторонний критерий Фишера. Анализировали распределение частот аллелей CAG-повтора AR в исследованной когорте пациентов и сравнение его с другими опубликованными данными, применяя непараметрические критерии и рассчитывая коэффициент корреляции Спирмена. При статистической обработке полученных данных использовали таблицы Excel, пакеты программ GraphPadPrism 7, STATISTICA 10.
Результаты и обсуждение. Делеции AZF в исследованной выборке. Проведено определение делеций в области AZF с использованием STS-маркеров, локализованных в субрегионах AZFa (sY83, sY84, sY86), AZFb (sY127, sY134, sY143) и AZFc (sY152, sY157, sY254, sY255) (рис. 1). Делеции AZF были выявлены в 73 случаях. Чаще всего делеции выявляли в AZFc – 58,9%, в AZFa делеции встречались в 5,5% случаев, в AZFb – в 12,3%, наличие сочетанных делеций двух и трех субрегионов суммарно констатировали в 23,3% образцов (табл. 2). Делеции AZFa, AZFb и комплексные делеции наблюдали только у мужчин с азооспермией, среди пациентов с делециями AZFc 29 мужчин имели азооспермию, 14 – олигозооспермию (концентрация сперматозоидов менее 15 млн/мл). Такое распределение частот с превалированием делеций AZFc соответствует данным других авторов [10].
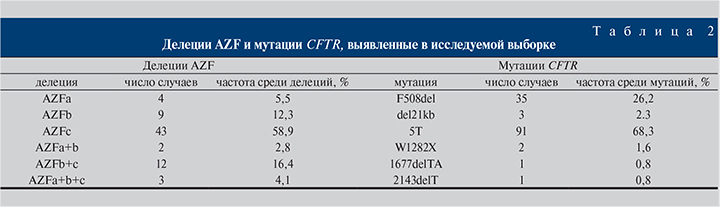
Cуммарная частота делеций AZF в нашей гетерогенной выборке мужчин с бесплодием была равна 8,2% (73/885). Эта величина близка к ранее подсчитанным частотам встречаемости делеций при бесплодии у мужчин в России (9,9%) и странах Восточной Европы (8–12%), популяциях Южной и Восточной Азии (6–9%) [3]; т.е. от значений, определенных при оценке встречаемости делеций AZF у мужчин с идиопатическим бесплодием после исключения других известных причин заболевания. Делеции AZF и, соответственно, содержащихся в этой области важных для сперматогенеза генов служат этиологическим фактором генетически обусловленного мужского бесплодия, что существенно для постановки окончательного диагноза. Все это свидетельствует в пользу тестирования мутаций AZF на этапе первичной диагностики бесплодия у мужчин, которое может быть выполнено как в формате мультиплексной ПЦР с электрофорезной детекцией, так и в менее трудоемком формате ПЦР в реальном времени [11].
Мутации CFTR у мужчин с бесплодием. В работе проведен поиск 11 тяжелых мутаций CFTR, из которых в тестируемой выборке были выявлены F508del, CFTRdel2,3(21kb), 1677delTA, 2143delT, W1282X (всего 42 случая). Чаще встречалась мутация F508del – 83,3%, гораздо реже – CFTRdel21kb (7,1%), W1282X (4,8%), оставшиеся две мутации были обнаружены в единичных случаях (табл. 2). Гетерозиготное носительство тяжелых мутаций CFTR обнаружено в 4,7% (42/885) случаев, что имеет значение для профилактики рождения детей с муковисцидозом в случае использования этими пациентами вспомогательных репродуктивных технологий. Частота гетерозиготного носительства тяжелых мутаций CFTR в нашей выборке находится в пределах 2–5%, характерных для восточно-европейских популяций, и близка к показателю, полученному в недавней экспериментальной работе по оценке частот мутаций CFTR в России – 2,9% [12]. Это указывает на невысокую долю CBAVD, обусловленную мутациями CFTR при первичной диагностике мужского бесплодия. Например, если целенаправленно выделять когорту пациентов с CBAVD и исключенными другими причинами азооспермии, то с применением секвенирования всего гена CFTR другим авторам удавалось выявлять носителей тяжелых мутаций этого гена в 60% случаев [13]. Тем не менее нами было выявлено 4 случая агенезии семявыносящих протоков (CBAVD) у компаунд-гетерозигот F508del/5T; впоследствии у них была диагностирована обструктивная форма бесплодия.
Генотипы локуса IVS8(T)n в нашей выборке распределились следующим образом: 7T/7T – 65,7% (581/885), 7Т/9T – 22,7% (201/885), 5T/7T – 8,7% (77/885), 9T/9T – 1,4% (12/885), 5T/9T – 1,2% (11/885) и 5T/5T – 0,3% (3/885). Следовательно, частота аллели 7Т составила 81,4%, 9T – 13,3%, на долю мягкой мутации 5Т приходилось 5,3% аллелей.
При сравнении европеоидных популяций и выборок пациентов с CBAVD в последних наблюдали увеличение частоты встречаемости аллеля 5Т: 3 против 21% и более по данным различных авторов [13, 14]. Показано, что 5Т достоверно чаще встречается в исследуемой нами когорте пациентов с различными формами мужского бесплодия, чем в здоровом контроле европеоидного происхождения (в частности, выборка C. Gelfi et al. [14], p=0,002). Вместе с тем частота аллеля 5Т в расчете на количество генотипированных хромосом, равная 5,3%, указывает на небольшую долю генетически детерминированных форм обструктивного бесплодия в отсутствие четких критериев отбора пациентов на этапе первичной лабораторной диагностики. Повышенная частота мутации 5Т у мужчин с бесплодием отмечена также в недавнем исследовании с участием 2146 российских мужчин с репродуктивными нарушениями [15]. Это делает целесообразным ее определение, в том числе и в составе генетических тестов на начальных этапах диагностики бесплодия. Отметим, что зачастую при поиске мутаций CFTR у бесплодных мужчин используют тест-системы для диагностики муковисцидоза, которые включают до 18 диагностически значимых (частых) мутаций в Европейской части России [5, 6]. Это оправданно при диагностике муковисцидоза, так как позволяет выявлять максимально возможное число мутаций методом ПЦР, а оставшуюся меньшую часть пациентов обследовать путем секвенирования всей кодирующей последовательности гена CFTR с прилегающими участками. Также целесообразно проводить расширенное тестирование мутаций CFTR при доказанной обструктивной форме мужского бесплодия. В то же время наши результаты указывают на избыточность такой диагностики у мужчин с неверифицированной на момент анализа формой бесплодия. В гетерогенной когорте пациентов на этапе первичной диагностики наблюдали только наиболее частые патогенные мутации – F508del, CFTRdel21kb, 1677delTA, 2143delT, W1282X, 5T.
Исследование CAG-повтора гена AR. Длина CAG-повтора в первом экзоне гена андрогенового рецептора при проведении лабораторной диагностики была определена у 37,5% (332/885) пациентов как дополнительный ассоциативный маркер бесплодия. Пороговый уровень для отнесения CAG-повтора к группе длинных аллелей был принят как >26 CAG-тринуклеотидов, исходя из проведенного нами ранее исследования случай–контроль мужчин с идиопатическим бесплодием относительно здоровых доноров [16]. Наименьший аллель в нашей выборке содержал 9, наибольший – 31 CAG-тринуклеотид (рис. 2). Наиболее представленным аллелем был 21(CAG), доля которого в распределении частот составила 21,5%. В целом длинные аллели с 27 и более CAG-тринуклеотидами были определены нами в 7,5% (25/332) случаев.

Проведен сравнительный анализ распределения частот аллелей CAG-повтора в нашей выборке с выборкой 200 российских мужчин с бесплодием у других авторов. Аллели CAG-повтора рассматривались как порядковые качественные признаки, в связи с чем применяли непараметрические критерии и рассчитывали коэффициент корреляции Спирмена. Показано, что распределения аллелей в этих двух выборках в значительной мере совпадают (r=0,89; 95% доверительный интервал [ДИ] – 0,76–0,95). Интересно, что в исследовании других авторов показана ассоциация нарушений сперматогенеза со всеми аллелями CAG-повтора, выходящими за пределы границ условной нормы в обе стороны: как с условно длинными (>28 CAG), так и с короткими (19< CAG) аллелями AR [17]. В нашей выборке было 17 случаев с длиной повтора 19< CAG (8 мужчин с азооспермией, 9 – с олигозооспермией), однако отсутствие точной информации о концентрации сперматозоидов у части этих пациентов с олигозооспермией не позволило провести сравнительный анализ.
Вопрос о целесообразности определения длины CAG-повтора в гене AR при идиопатическом бесплодии в разное время рассматривался неоднозначно. В настоящее время, согласно результатам мета-анализа 40 оригинальных работ, включившего 3858 мужчин с бесплодием и 3161 индивидуума контрольной группы, показана ассоциация длинных аллелей CAG-повтора с мужским бесплодием в объединенной выборке: обобщенное стандартизированное среднее различие (standardized mean difference – SMD) составило 0,14 с 95% ДИ=0,02–0,26. С учетом популяционной принадлежности ассоциация длинных аллелей показана для европейских и североамериканских популяций, но не для североафриканских представителей или популяций из Юго-Восточной Азии. Однако в приведенном мета-анализе к условно длинным аллелям относились все повторы более 21 CAG-тринуклеотида, т.е. самого частого аллеля [18]. Это позволило повысить чувствительность выявления различий длины CAG-повтора AR в мета-анализе. Вместе с тем указанный подход мало пригоден для стратификации и обособления группы высокого риска в клинических целях в силу того, что подавляющее большинство частых аллелей, и, соответственно, пациентов, оказываются в группе условно длинных повторов. К тому же информацию о длине CAG-повтора сложно имплементировать в практическую плоскость: если наличие делеции AZF или компаунд-гетерозиготы CFTR позволяет установить причину бесплодия, то обнаружение длинного аллеля AR говорит лишь о возможной генетической предрасположенности к бесплодию у мужчины.
С наступлением эры секвенирования нового поколения (NGS – next generation sequencing) появилась возможность в масштабах всего генома, экзома или расширенных генных панелей проводить поиск герминальных мутаций в минорных генах-кандидатах мужского бесплодия при моногенных заболеваниях. Например, секвенирование экзонов и прилегающих интронных участков панели из 261 гена позволило выявить 18 новых генов-кандидатов гипогонадотропного гипогонадизма, а также идентифицировать новые герминальные мутации в уже известных генах, связанных с основной формой этого заболевания – синдромом Кальмана, KAL1, FGFR1 [19]. В недавнем обзоре систематизированы данные о 23 исследованиях нарушений фертильности у мужчин с применением NGS-технологий, в результате которых идентифицировано 28 новых генов – кандидатов мужского бесплодия [20]. Кроме точковых мутаций в настоящее время проводят работы по секвенированию мутаций в митохондриальной ДНК, а также выявляют субмикроскопические хромосомные аберрации с помощью хромосомного микроматричного анализа, что также проясняет этиологию части случаев мужского бесплодия [21].
Кроме структурных генетических нарушений (мутаций) для сперматогенеза важно правильное формирование отцовского импринта – совокупности паттернов метилирования ДНК в импринтированных районах генома и связанных с ним модификаций гистонов, степени упаковки хроматина. Показано, что олигозооспермия ассоциирована с аберрантным метилированием генов, непосредственно регулирующих сперматогенез (DAZL) или находящихся в семи импринтированных районах (LIT1, MEST, SNRPN, PLAGL1, PEG3, H19 и IGF2) в сперматозоидах. Причем наиболее воспроизводимые результаты были получены для IGF2/H19, SNRPN и MEST [22, 23]. Не исключено, что случаи идиопатического бесплодия, при которых отсутствуют как частые генетические нарушения, так и герминальные мутации, детектируемые в составе генных панелей NGS для мужского бесплодия, могут быть связаны с комплексной эпигенетической патологией.
Заключение. Таким образом, в гетерогенной группе пациентов с мужским бесплодием при проведении первичной комплексной лабораторной диагностики причин заболевания целесообразно тестировать делеции AZF и наиболее частые мутации CFTR, включающие F508del, CFTRdel21kb, 1677delTA, 2143delT, W1282X и 5Т. Анализ более широкого перечня частых мутаций CFTR оправдан лишь у пациентов с верифицированной обструктивной азооспермией. Длинные аллели CAG-повтора являются низкопенетрантными локусами, к тому же их ассоциация с мужским бесплодием, по данным мета-анализа, показана не всем популяциям. Для выяснения этиологии по крайней мере части случаев идиопатического бесплодия у мужчин сегодня можно определять герминальные мутации путем NGS-анализа генных панелей, включающих все значимые гены – кандидаты сперматогенеза.



