Введение. Проблема нарушения уродинамики нижних мочевыводящих путей привлекает к себе все большее внимание в последнее время. Распространенность заболеваний мочевыделительной системы растет с каждым годом. Это связано с массой врожденных и приобретенных заболеваний, патологических состояний этого отдела мочевого тракта у детей и их ролью в происхождении расстройств акта мочеиспускания, пузырно-мочеточникового рефлюкса, мегауретера, пиелонефрита, цистита, хронической почечной недостаточности [1]. Данные проблемы, связанные с расстройством функции мочевого пузыря и нарушением уродинамики, наблюдаются у 25–72,2% детей [2]. Первое место по частоте занимают нейрогенные дисфункции мочевого пузыря, которые встречаются у 10% детского населения и у каждого второго ребенка с нефроурологической патологией [3].
Проблема морфофункциональных нарушений мочевого пузыря, в частности энуреза, также имеет высокую социальную значимость, которая определяется значительным снижением качества жизни ребенка, отрицательным влиянием на формирование личности и характера, что затрудняет адаптацию больных в обществе. Это определяет важность своевременного выявления и лечения данной патологии [4]. Существует множество методов диагностики данного расстройства, которые в совокупности позволяют получать полную клиническую картину заболевания, но зачастую они либо инвазивны, либо затратны по времени [1].
По современным представлениям, транспорт мочи от почки до мочевого пузыря в норме обеспечивается ритмичными последовательными сокращениями почечной лоханки и мочеточника. Сокращения инициируются потенциалами действия, генерируемыми в миоцитах чашечек и лоханки, которые концентрируются в так называемой пейсмекерной зоне и распространяются в дистальном направлении по мочеточнику. При многоканальной пиелоуретерографии регистрируются ритмично возникающие электрические комплексы, обычно двухфазные, являющиеся суммой потенциалов действия гладкомышечных клеток, расположенных в области регистрирующего электрода. При плотном прилегании электрода к стенке амплитуда электрического комплекса составляет около 1 мВ, но при неплотном прилегании амплитуда может сильно различаться, поэтому низкие значения амплитуды сигнала сами по себе не могут служить признаком патологии. Скорость распространения волны возбуждения по мочеточнику составляет 35–45 мм/с в зависимости от отдела мочеточника. По некоторым данным, в области лоханочно-мочеточникового сегмента скорость ниже, чем в остальных отделах мочеточника, и не превышает 25–30 мм/с. Сразу за волной возбуждения происходит сокращение стенки верхних мочевыводящих путей, которое также распространяется от почечной лоханки до терминального отдела мочеточника. Как правило, сокращение распространяется по типу перистальтической волны, но у ряда пациентов выявляется цистоидный тип сокращений, когда сокращается сразу протяженный участок мочеточника. Полагают, что перистальтический тип сокращений присущ нормальному, неизмененному мочеточнику, а цистоидный тип возникает лишь при патологических состояниях, а также при форсированном диурезе [11].
При перистальтическом типе волна возникает 2–5 раз в 1 мин и распространяется в дистальном направлении со скоростью около 4,5 см/с, обусловливая продвижение порции мочи. Сокращение вызывает смыкание стенок мочеточника, отгораживая порцию мочи от вышележащих отделов. Сокращения лоханки и мочеточника в норме так же ритмичны, как и предшествовавшие им комплексы электровозбуждения. Частота сокращений может сильно варьироваться в зависимости от диуреза [11].
К распространенным методам диагностики нейрогенной патологии мочевой системы относятся регистрация изменения электрофизиологических параметров (реография и электромиография [ЭМГ]), цистологические и ультразвуковые методы исследования. Однако электроуретерография является инвазивным методом и не всегда представляется возможным его применение в амбулаторных условиях.
Использование методов ультразвуковой диагностики для решения задачи непрерывной оценки степени наполнения мочевого пузыря и его функционирования в течение суток представляется весьма затруднительным. Регистрируя электрофизиологические параметры (сопротивление биоткани и величина биопотенциалов), можно оценить в количественном и качественном аспектах функцию всех отделов мочевой системы: почек, мочеточника, детрузора, внутренних и наружных сфинктеров, уретральной диафрагмы, передней брюшной стенки.
Из-за инструментальных ограничений исследователи долгое время не могли анализировать реограмму в области частот ниже 1 Гц и обнаружить в ней так называемые дыхательный и майеровский ритмы, а также исследовать тонкую структуру пульсовых гармоник [5]. С помощью ЭМГ регистрируется динамика разности мышечных потенциалов, которая показывает состояние периферической части рефлекторной дуги, а именно мышцы, спинальных мотонейронов, а также опосредованно нейросегментарных структур [2]. Применение метода регистрации биопотенциалов мочевого пузыря и мочеточников показало наличие периодичности изменения потенциалов на частотах из диапазона 0,3–150 Гц.
Следует отметить, что кроме измерения электрических потенциалов органов мочевой системы широко используется и воздействие электрическим током в комплексном консервативном лечении больных, страдающих мочекаменной болезнью [6].
Важным аспектом диагностики и терапии с использованием электрического сигнала является его специфичность в отношении внутренних органов, в частности к мочевому пузырю. Использование функциональных проб и нагрузок позволяет выявлять параметры полезного сигнала из интегральной электрической активности органов и тканей.
Анализ литературы и проведенные исследования показали, что в зависимости от наполненности мочевого пузыря наблюдается различная биоэлектрическая активность его стенок, что в свою очередь можно использовать как диагностический критерий.
В связи с этим целью работы стало выявление специфики биоэлектрической активности стенок мочевого пузыря при функциональной нагрузке.
Материалы и методы. В качестве испытуемых были выбраны молодые люди 18–22 лет без заболеваний мочевой системы, всего 5 человек. Все исследования на людях осуществлялись только после одобрения этическим комитетом организации и при информированном согласии пациентов. В качестве устройства для регистрации биопотенциалов с области мочеточников и мочевого пузыря использовали 21-канальный электроэнцефалограф Нейрон-Спектр-4 фирмы «Нейрософт», который характеризуется высокой чувствительностью по сравнению с другими усилителями биопотенциалов. Диапазон чувствительности электроэнцефалографа по паспорту составлял в полосе частот от 0,05 до 250 Гц 1–1000 мкВ/мм, частота квантования – до 5000 Гц, уровень шума – менее 0,3 мкВ. Следует отметить, что вместо электроэнцефалографа можно использовать любой другой усилитель биопотенциалов, а электроэнцефалограф был выбран вследствие своей высокой чувствительности.
Ранее в работе [9] были приведены результаты изучения влияния электромиостимуляции на мочевыводящие пути детей с недержанием мочи, в рамках которых проводили электромиографию мочевого пузыря. Полученные данные находились в согласии с результатами УЗИ и других уродинамических исследований, вследствие чего можно считать данный метод регистрации биопотенциалов мочевого пузыря подходящим для подобной цели.
В ходе исследования испытуемый сидел на стуле в удобном положении. На кожу испытуемого в области мочевого пузыря накладывали три электрода, выполненных в виде присосок (рис. 1). Электроды располагали вдоль горизонтальной прямой, причем электрод 5, расположенный в центре, является индифферентным, он выполняет функцию электрода сравнения и служит для измерения разности потенциалов. Крайние электроды 6 и 7 вместе с индифферентным формируют два отведения для регистрации миоволн (биопотенциалов) мочевого пузыря. Подключение к электроэнцефалографу осуществляли следующим образом: индифферентный электрод 5 подключается к гнезду ушного электрода (например, А2 для «Нейрон-Спектр-4»), остальные, 6-й и 7-й, – к гнездам, соответствующим тому же полушарию, что и ушной электрод (например, F8 и Т4 для «Нейрон-Спектр-4»). Три электрода-прищепки, выполненных в виде зажимов, накладывали на запястья обеих рук и щиколотку правой ноги. Электрод на правой ноге 4 используется как заземление для устойчивости сигнала ЭКГ, электроды на запястьях предназначены для измерения разности потенциалов, они и формируют сигнал ЭКГ первого стандартного отведения.
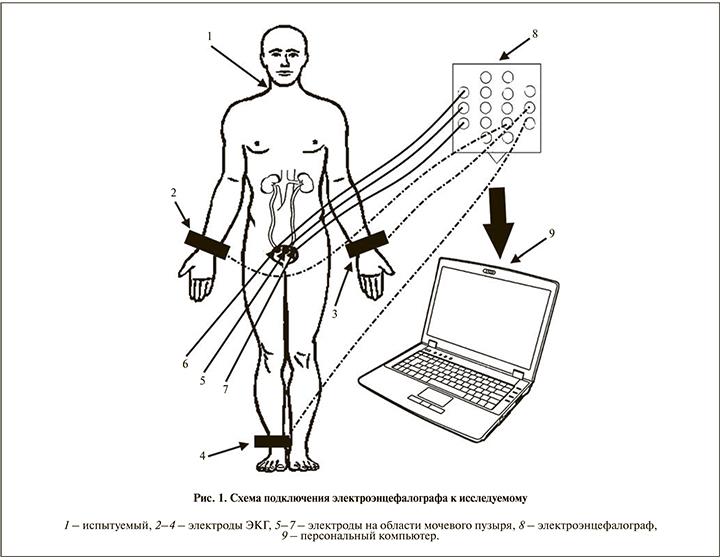
Подключение к электроэнцефалографу осуществляли следующим образом: электрод 4 подключали к гнезду заземления электроэнцефалографа, электрод 3 – к гнезду ушного электрода (например, А1 для «Нейрон-Спектр-4»), электрод 2 – к любому из гнезд, соответствующих полушарию того гнезда ушного электрода, к которому подключили электрод 3. Таким образом, электроды для регистрации биопотенциалов мочевого пузыря были подключены к гнездам электроэнцефалографа, соответствовавшим правому полушарию головного мозга, а электроды для регистрации ЭКГ – левому. Также возможны варианты подключения электродов от мочевого пузыря к левому полушарию, а ЭКГ – к правому, кроме того, электроды и мочевого пузыря, и ЭКГ могут быть подключены к одному и тому же полушарию.
Запись сигнала миоволн (биопотенциалов) мочевого пузыря проводилась между 6-м и 5, 7 и 5-м электродами. Одновременно с этим шла запись сигнала ЭКГ первого стандартного отведения. Кроме того, для подтверждения сокращения мочеточника проводили УЗИ мочеточниковых выбросов, по которому можно косвенно судить о сокращении мочеточника и регистрировать увеличение объема мочевого пузыря.
Фоновую запись сигналов проводили в течение 20 мин до нагрузочной водно-питьевой пробы. Полученные сигналы ЭКГ и биопотенциалов мочевого пузыря подвергали математической обработке с помощью персонального компьютера, которая предусматривала разбиение на файлы, включающие данные по 1 мин, нормировку (приведение в состояние от 0 до 1) с помощью средств программы MS Excel и построение спектров участков для каждой минуты в среде математического пакета Mathcad 14 методом дискретного преобразования Фурье с помощью встроенной функции CFFT, результат которой вычисляется по формуле:

где N – количество значений сигнала, измеренных за период, а также количество компонент разложения исходного вектора (набора) данных xn с номерами n=0, … , N-1, k – индекс частоты, с которой брались входные данные, Xk – набор данных, составляющих дискретное преобразование Фурье комплекснозначного вектора xn.
Спектры сигналов с отведений от мочевого пузыря 6 и 5, 7 и 5 фильтровали от сигнала ЭКГ (соответствующим делением значений амплитуд каждой частоты спектров отведения мочевого пузыря и спектра отведения ЭКГ) в MS Excel.
После нагрузочной водно-питьевой пробы в виде 350 мл теплой воды (температура около 36°С) осуществляли запись сигнала с отведений в течение 20 мин, для которой аналогичным образом были построены временные зависимости амплитуд наиболее характерных гармоник фильтрованных спектров после нагрузочной пробы. На следующем этапе обработки сигналов сравнивали поведение выбранных гармоник до и после нагрузочной воднопитьевой пробы. Проводили корреляционный анализ (с помощью программы STATISTICA 10) в сравнении фон–нагрузка. Для некоторых значений времени отличие дисперсии при функциональной нагрузке и фоновой записи рассчитывался с помощью программы STATISTICA 10 в рамках t-теста Стьюдента, применяемого для небольших выборок. Таким образом, была выявлена предположительная закономерность в изменении биоэлектрической активности мочевого пузыря, что может быть основой при диагностике степени его наполненности и сократительной способности.
Результаты. В процессе построения спектров сигналов с отведений было выявлено, что наибольшая активность наблюдалась в низкочастотном диапазоне от 0 до 2 Гц.
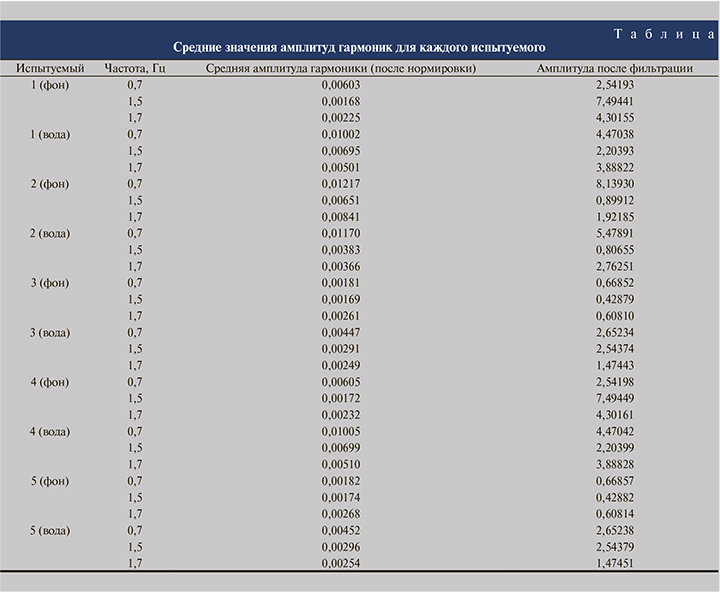
Средние значения амплитуд выбранных гармоник спектра для пяти испытуемых (в фоновой записи и при нагрузке) представлены в таблице.
По результатам анализа спектров фона для одного и того же времени (в покое и при нагрузке) было установлено, что коэффициент корреляции=0,8, т.е. существует некоторая зависимость между данными спектрами. Были выбраны три частоты в диапазоне 0,5–2 Гц, для которых наиболее четко прослеживалась динамика амплитуды в зависимости от времени. Для них также проводили корреляционный анализ (с помощью программы STATISTICA 10) в сравнении фон–нагрузка. В результате установлен коэффициент корреляции 0,2.
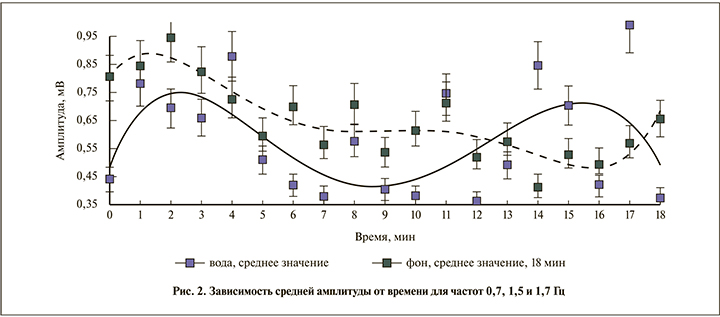
Следовательно, эти частоты можно использовать для сравнения и анализа биоэлектрической активности мочевого пузыря. Причем гармоникам с наиболее высокой амплитудой (0,7, 1,5 и 1,7 Гц) свойственны схожий характер увеличения или уменьшения амплитуды во времени, а также изменение ее с периодичностью 4–6 мин.
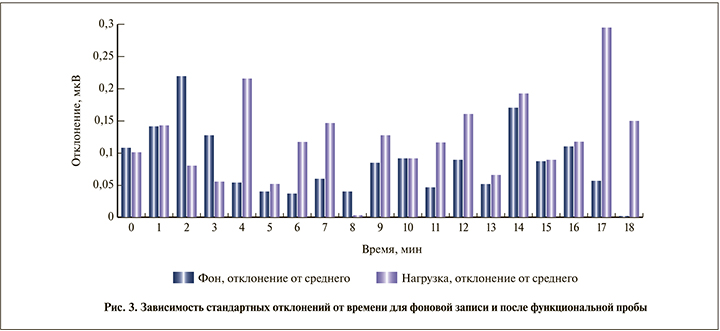
На рис. 2 видно увеличение активности для частот 0,7, 1,5 и 1,7 Гц с 10-й минуты после нагрузочной пробы. По рис. 3 можно сделать общий вывод о том, как изменялась дисперсия среднего значения гармоник (амплитуды биопотенциалов стенок мочевого пузыря) во времени; для некоторых значений времени отличие дисперсии при функциональной нагрузке и фоновой записи превысило 30% (р=0,03).
В ходе проведенного исследования установлено, что в случае воднопитьевой нагрузки наблюдается увеличение активности биопотенциалов стенок мочевого пузыря после 10-й минуты регистрации. Отметим, что этот вывод получен при данных условиях исследований (объем воды, ее температура). Известно, что время всасывания воды в организме человека зависит не только от химического состава воды и психофункционального состояния организма, но и от температуры воды [10].
Можно отметить также, что при функциональной нагрузке изменяется характер динамики выбранных гармоник: в фоновой записи гармоники ведут себя практически одинаково во времени, а после питьевой пробы наблюдается большее изменение в амплитудах гармоник с течением времени, причем периодическое с интервалом около 12 мин (рис. 2). Одним из главных результатов проделанной работы является обнаружение нескольких частот из интервала 0,5–2 Гц (0,7, 1,5 и 1,7 Гц), на которых можно увидеть динамику биоэлектрической активности стенок МП, подтвержденную в серии случаев.
Заключение. Таким образом, была выявлена предположительная закономерность в изменении биоэлектрической активности мочевого пузыря, что может быть основой при диагностике степени его наполненности и сократительной способности.



