Введение. Травма почки – наиболее часто встречающееся повреждение мочевой системы (8–10% случаев всех травм) [1] с превалированием закрытых, не проникающих в полостную систему органа, – 80–95% случаев [2, 3].
Травмой считается нарушение анатомической целостности органа с расстройством ее функций, обусловленное воздействием факторов окружающей среды [4]. Механическое повреждение паренхиматозных органов имеет конкретную причину и представляет собой патоморфологическую категорию, для которой характерны объективные проявления на макро- и микроструктурном уровнях в виде сотрясений, ушибов, разрывов. Среди посттравматических осложнений лидирует пиелонефрит (72–84,9%) [5].
При изучении посттравматических осложнений воспалительного характера основное внимание уделяется иммунным нарушениям при сочетанной травме [5]. В то же время сдвиги в функционировании различных звеньев иммунной системы после изолированной закрытой тупой травмы почки освещены недостаточно. Практически отсутствуют исследования по оценке реактивности иммунологической системы при этом виде повреждений с использованием многофакторного анализа.
Цель исследования: изучить иммунные сдвиги при повреждении почки и их влияние на возникновение воспалительных посттравматических осложнений.
Материалы и методы. Иммунологические показатели проанализированы у 92 пострадавших в возрасте 30–50 лет с 1–3-й степенями изолированного закрытого повреждения почки (классификация тяжести повреждений почки (OIS/OI) Американской ассоциацией хирургии травм (AAST), 2018) [6], проходивших консервативное лечение в урологическом стационаре (средний койко-день составил 9,6±1,5 суток). Все пострадавшие были госпитализированы в течение первых суток после получения травмы, из них 46 (50,5%) – в течение первых 6 ч после травмы. Соотношение мужчин и женщин было 3,6:1. Пациенты были обследованы в динамике: 1–5-е, 6–10-е сутки госпитализации и на амбулаторном этапе спустя 11 и более суток с момента получения травмы. В исследование не включали пострадавших с 4–5-й степенями повреждения почки, так как им были выполнены различные оперативные вмешательства, которые, являясь стрессовым воздействием, могут отражаться на реакции иммунной системы. Группу сравнения составили 25 практически здоровых лиц.
Иммунологические методы исследования включали определение субпопуляционного состава лимфоцитов периферической крови с помощью моноклональных антител ЛТ. Вычисляли процент лимфоцитов, экспрессирующих CD3+, CD4+, CD8+, CD19+. Иммунофлюоресценцию оценивали на проточном цитометре Epics-Profile («Coulter»). Содержание иммуноглобулинов классов A, M, G в сыворотке крови определяли методом простой радиальной иммунодиффузии. Активность комплемента определяли методом титрования по 50%-ному гемолизу эритроцитов барана в единицах СН50. Циркулирующие иммунные комплексы изучали путем осаждения их полиэтиленгликолем 60001 [7].
Для обработки полученных данных были применены методы описательной статистики, выборочных сравнений и многомерный анализ. Рассчитывали средние значения с 95% доверительными интервалами (95% ДИ), вычисленными бутстрепом (метод BCa, n=99999). Сравнения средних проводили в ходе рандомизационного (n=99999) варианта однофакторного дисперсионного анализа после преобразования данных по Боксу–Коксу [8]. Редукцию данных с обобщением проводили методом главных компонент с акцентом на объяснение межгрупповой изменчивости (between-group PCA) [9]. Статистически значимыми считали эффекты при p≤0,05, незначимыми – при p>0,10.
Для прогноза состояния здоровья пострадавших изучены корреляционные связи показателей: нейтрофилы–лимфоциты (регуляторные и эффекторные субпопуляции иммунокомпетентных клеток) и IgM–IgG (ранних и поздних иммуноглобулинов) [10]. При этом использовали количественные градации: сильные корреляционные взаимосвязи (0,5 и более) свидетельствовали об устойчивом состоянии иммунной системы; уменьшение силы взаимосвязей (менее 0,5) характеризовало неустойчивое состояние иммунной системы.
Результаты и обсуждение. Результаты иммунологических исследований представлены в табл. 1.

В ходе рандомизационного однофакторного дисперсионного анализа было установлено, что отдельные показатели клеточного и гуморального иммунитета у пациентов с травмами почки были в пределах нормы и не отличались от показателей в контрольной группе (p от 0,213 до 0,932). При этом основные показатели иммунограммы оставались стабильными все время пребывания пациентов в стационаре.
 Д. С. Саркисов [11] сформулировал принцип мозаичности функционирования органов и систем, согласно которому структурные компоненты органов или систем при предъявлении им требований имеющегося патологического процесса распределяют эту функциональную нагрузку между собой, выбирая такое количество и качество структурных компонентов, которое будет адекватно данным конкретным требованиям По мнению И. Г. Чесноковой [12], в рамках анализа эмпирического подхода при оценке иммунологической реактивности суждение по средним значениям отдельных показателей патогенетически необоснованно. Эта трудность усугубляется большой вариабельностью показателей активности различных компонентов иммунной системы, обусловленной влиянием разнообразных объективных или раздражающих нагрузочных факторов. В связи с этим нами использован многомерный анализ данных для обнаружения возможных комплексных изменений иммунологических показателей.
Д. С. Саркисов [11] сформулировал принцип мозаичности функционирования органов и систем, согласно которому структурные компоненты органов или систем при предъявлении им требований имеющегося патологического процесса распределяют эту функциональную нагрузку между собой, выбирая такое количество и качество структурных компонентов, которое будет адекватно данным конкретным требованиям По мнению И. Г. Чесноковой [12], в рамках анализа эмпирического подхода при оценке иммунологической реактивности суждение по средним значениям отдельных показателей патогенетически необоснованно. Эта трудность усугубляется большой вариабельностью показателей активности различных компонентов иммунной системы, обусловленной влиянием разнообразных объективных или раздражающих нагрузочных факторов. В связи с этим нами использован многомерный анализ данных для обнаружения возможных комплексных изменений иммунологических показателей.
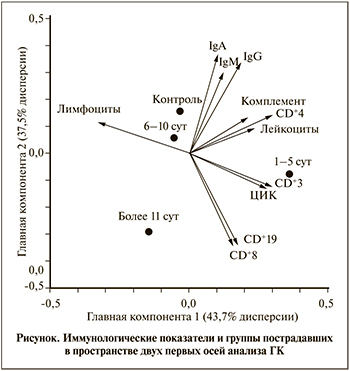
Наиболее распространенной многомерной техникой, используемой для редукции данных с обобщением, являются анализ главных компонент (ГК) [13] и его модификация «between-group PCA», где единицей анализа выступают групповые средние показатели (табл. 2, рис. 1).
В результате редукции данных были выделены три ГК, объясняющие в сумме все 100% межгрупповых различий.
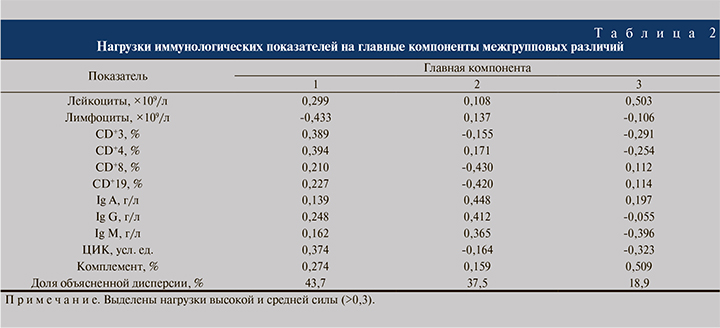
ГК 1 объясняла 43,7% общей изменчивости (дисперсии) данных, куда с наибольшей и отрицательной нагрузкой вошел показатель абсолютного числа лимфоцитов, который был противопоставлен всем остальным исследуемым показателям с положительной нагрузкой. Сравнение групп по индивидуальным значениям меток выявило тенденцию к межгрупповым различиям (p=0,074). Это заключалось в особом положении группы пациентов с травмой почки, обследованных на 1–5-е сутки после травмы, которая отличалась от группы больных на сроке более 11 сут. (p=0,021). Группа изучения на 1–5-е сутки демонстрировала близкие к статистически значимым отличия от контрольной группы (p=0,072) и группы пострадавших на 6–10-е сутки (p=0,083). В этой группе больных на фоне нормальных значений лейкоцитов и распределения относительного числа субпопуляций CD+3 наблюдалось снижение абсолютного числа лимфоцитов. Такое снижение может быть обусловлено стресс-реакцией, при которой повышенная концентрация глюкокортикоидов вызывает апоптоз лимфоидных компонентов, а катехоламины способствуют хоумингу (возврату) лимфоцитов в ткани [14].
В целом ГК 1 характеризует острую фазу локального асептического воспалительного процесса [15], развивающегося в тканях поврежденной почки, при котором продукты клеточного повреждения запускают активацию и рекрутирование клеток, прежде всего врожденного иммунитета в место воспаления, что приводит к увеличению абсолютного числа нейтрофилов и снижению абсолютного содержания лимфоцитов в системном кровотоке.
ГК 2 объясняла 37,5% дисперсии межгрупповых данных. Она позволила выделить группу пациентов (см. рисунок), обследованную через 11 сут. после травмы, для которой были характерны высокие показатели адаптивного клеточного иммунитета (особенно CD+19 и CD+8), свидетельствующие об их активизации. Сравнение групп по индивидуальным значениям меток, вычисленным для ГК 2, показало наличие тенденции к межгрупповым различиям: группы ˃11 сут. от контроля (p=0,018), в меньшей степени – от основной группы на 6–10-е сутки (p=0,099). Интересно отметить, что в ГК 2 также вошли показатели основных классов иммуноглобулинов, которые были низкими в основной группе вне зависимости от периода исследования по сравнению с контрольной группой.
Полученные данные по ГК 2 могут отражать переключение клеточно-опосредованного иммунного ответа с врожденного на адаптивный без участия гуморального компонента. Такое развитие иммунных реакций может способствовать благоприятному исходу заболевания, т.к. известно, что расширение популяции CD+8 играет протективную роль, предотвращая развитие воспалительного ответа [16].
ГК 3 вобрала оставшиеся 18,9% дисперсии межгрупповых различий. В нее с высокой отрицательной нагрузкой вошли показатели неспецифического гуморального иммунитета: IgM, комплемент и ЦИК. По значениям данной компоненты существенных различий между изученными группами не обнаружено (p=0,316), что указывает на остаточную изменчивость, не сопряженную с конкретными иммунологическими процессами.
Динамика корреляционных взаимосвязей основных показателей иммунной системы представлена в табл. 3.

Отмечена сильная отрицательная корреляция нейтрофилы–лимфоциты и слабая положительная корреляция IgM–IgG (на поздних сроках наблюдения), свидетельствующие о сохранении адаптивных возможностей иммунной системы в течение всего периода наблюдения.
Г. В. Булава и соавт. [17], изучив иммунологические показатели 405 пациентов с острой хирургической патологией, травмой груди и живота, установили, что адекватная реакция иммунной системы, так называемая норма патологии, способствующая саногенезу, характеризуется умеренным лейкоцитозом, нормальными показателями клеточного и гуморального звеньев иммунитета. Проведенное нами сравнение средних значений показателей иммунограммы в группе пострадавших с изолированной закрытой травмой почки при консервативном лечении с параметрами здоровых лиц не выявило значимых различий, в то время как многомерная техника статистической обработки данных позволила выделить и на 81,2% детализировать реактивность иммунной системы на повреждение органа.
Реакция иммунной системы на механическую травму характеризуется «дозой–эффектом», где под дозой понимается степень повреждения, а под эффектом – реакция иммунной системы [18]. Целостная тканевая реакция на повреждение складывается из воспаления, регенерации, фиброза, и все фазы этого процесса накладываются друг на друга со сменой типов клеточных взаимодействий. Конечной целью этой стереотипной реакции является ликвидация повреждения и максимальное анатомическое восстановление ткани с минимальными функциональными потерями [19].
Полученные корреляционные взаимосвязи в показателях реактивности иммунной системы позволяют заключить, что после закрытой тупой травмы почки с наличием раны почечной паренхимы менее/более 1 см доминирует макрофагальная неспецифическая реакция. Активация Т-клеточного звена иммунной системы отмечается после 5 сут. повреждения. В-звено системы отличается большой устойчивостью к повреждающему действию травмы с отсутствием значимых девиаций показателей реагирования. Установленная стадийность функционирования иммунной системы после закрытого локального повреждения почки служит критерием сохранности адекватных адаптивных ее возможностей для купирования раневого асептического воспалительного процесса.
Заключение. Многомерный анализ иммунологической реактивности организма свидетельствует о достаточной степени мобилизации собственных ресурсов иммунной системы для формирования адекватных адаптивных возможностей при изолированной закрытой травме почки, что делает сомнительным прогноз развития посттравматического пиелонефрита.



