Введение. В мире бесплодны 10–15% супружеских пар [1–5]. В России этот показатель достиг 17,2% [6]. Несмотря на значительные успехи в изучении механизмов женского бесплодия, мужское бесплодие в 50% случаев классифицируется как идиопатическое [7, 8]. Доказано, что 15–30% всех случаев бесплодия мужчин обусловлены микроделециями Y-хромосомы, хромосомными аберрациями и мутациями гена CFTR [9, 10].
Исследования российских и зарубежных авторов показали, что генетической основой мужского бесплодия как полиэтиологического заболевания могут быть полиморфизмы многих генов, продукты которых участвуют в метаболических реакциях и реализуются в защитных механизмах клеток [7, 10–12]. Многоступенчатый процесс сперматогенеза контролируется совместным действием порядка 2300 генов, каждый из которых может служить потенциальным генетическим фактором риска мужского бесплодия [2].
Значительная часть современных исследователей определяет ведущую роль генетических факторов в нарушении сперматогенеза, снижении качества спермы и развитии патоспермии у мужчин с бесплодием [7, 9, 10, 12, 13]. Характер нарушений спермограммы у мужчин с бесплодием варьируется в диапазоне от снижения количества сперматозоидов (олигозооспермия) в эякуляте до их полного отсутствия (азооспермия). Также различают снижение подвижности сперматозоидов (астенозооспермия) и нарушения их морфологии (тератозооспермия) [1]. Нередко у мужчин с бесплодием встречается комбинация нарушений нескольких параметров эякулята – олигоастенотератозооспермия.
К возможным механизмам нарушения фертильности мужчин и развития патоспермии относят токсический эффект гипергомоцистеинемии, нарушение процессов синтеза и метилирования ДНК в быстроделящихся половых клетках [14]. Гипергомоцистеинемия служит следствием снижения активности ферментов фолатного обмена и недостатка фолата в рационе [15, 16]. Нарушение функции метаболизирующих ферментов фолатного обмена приводит к накоплению гомоцистеина в клетках и повышению общего уровня гомоцистеина в плазме [17]. По этой причине полиморфизмы генов, кодирующих синтез ключевых ферментов фолатного цикла (MTHFR, MTR, MTRR), влияющие на активность метаболизирующих ферментов, могут выступать потенциальным фактором риска мужского бесплодия [18].
Ключевым ферментом фолатного цикла является фермент 5,10-метилентетрагидрофолатредуктаза (MTHFR) [MIM 236250], который переводит фолиевую кислоту в ее активную форму – 5-метилтетрагидрофолат. Ген MTHFR локализуется на коротком плече хромосомы 1(1р36.3) и состоит из 11 экзонов [13, 16]. Длина кодирующего участка гена составляет около 1980 пар нуклеотидов.
Клиническое значение имеют два полиморфизма гена MTHFR: С677Т в экзоне 4 (rs 1801133) и А1298С в экзоне 7 (rs 1801131), определяющие снижение активности фермента [14, 19]. Миссенс-мутация С677Т обусловлена замещением цитозина на тимин в положении 677 и вызывает замену аланина на валин (p.Ala222Val) в каталитическом домене белка-фермента [11, 20]. У гомозигот по аллелю 677Т активность фермента снижена на 70%, у гетерозигот – на 35%.
Аллель 677Т гена MTHFR встречается в популяциях мира с разной частотой. В европейских странах его частота колеблется в пределах от 19% (в Великобритании) до 55% (в Испании) [11]. В азиатских популяциях частота аллеля 677Т достигает 2% в Индонезии и 38% в Китае [11, 20]. У афроамериканцев Южной Каролины этот аллель встречается с частотой 11%; у индейцев Бразилии – 45% [21].
Полиморфизм гена MTHFR А1298С приводит к замене глутаминовой кислоты на аланин в регуляторном домене фермента (p.Glu429Ala), что также сопровождается снижением активности фермента. Согласно данным литературы, у лиц, являющихся компаунд-гетерозиготами (генотип 677СТ/1298АС), активность фермента снижена на 40–50% [3, 16].
Широкомасштабные ассоциативные исследования полиморфизмов генов фолатного обмена с мужским бесплодием проводилось в разных популяциях [4, 11, 22]. Необходимо отметить противоречивость результатов, полученных разными авторами в разных популяциях Европы, Азии и Америки [17, 19, 22, 23]. К настоящему времени отсутствуют данные об ассоциации полиморфизмов генов фолат-метаболизирующих ферментов с развитием патоспермии среди мужчин Московского региона.
Целью настоящего исследования стало изучение ассоциации полиморфизмов гена MTHFR С677Т (rs 1801133) и А1298С (rs 1801131) с риском бесплодия у мужчин Московского региона с разными формами патоспермии.
Материалы и методы. Дизайн исследования: это было проспективное когортное исследование с включением 195 мужчин, проживавших в Московском регионе. Из них 68 фертильных мужчин (имевших одного и более детей) и 127 пациентов с нарушением репродуктивной функции, т.е. с разными формами патоспермии неустановленной этиологии. Средний возраст бесплодных мужчин составил 30±2 года, возраст фертильных мужчин – 29±4 года (р>0,05).
Обследование включило сбор жалоб, анамнеза, оценку объективного и урологического статуса, спермограмму (ВОЗ, 2010), исследование гормонального профиля, определение кариотипа, выявление делеций AZF-региона Y-хромосомы, мутаций гена CFTR.
Согласно данным спермограммы, азооспермия диагностирована у 38 (29,9%) пациентов, астенозооспермия – у 47 (37%), тератозооспермия – у 42 (33,1%). У пациентов с нарушением репродуктивной функции при микроскопическом исследовании эякулята доля активно подвижных сперматозоидов в среднем была 18,6% (11–27%), половых клеток с анормальным морфологическим строением (по строгим критериям Крюгера) – 97,1% (94–99%). Все пациенты (n=195) имели нормальный кариотип, у них отсутствовали мутации в гене CFTR и микроделеции AZF локуса в Y-хромосоме (согласно данным медицинских карт). Во всех случаях женский фактор бесплодия в паре был исключен.
Для изучения ассоциации полиморфизмов гена MTHFR С677Т (rs 1801133) и А1298С (rs 1801131) выделяли ДНК из лейкоцитарной массы периферической крови. Проводили полимеразную цепную реакцию в режиме реального времен (ПЦР-РВ) на амплификаторе СFX96 (Bio-Rad) с программным обеспечением CFX ManagerTM. Использовали готовые наборы для определения полиморфизмов генов фолатного обмена («Синтол», Россия). Генотипирование осуществляли на основе метода Tag Man-зондов относительно флуоресценции (RFU) каждого зонда.
Полученные данные подвергали статистической обработке с использованием пакета программ STATISTICA 6.0 («StatSoft», США). Частоту аллелей исследуемых полиморфизмов в группах бесплодных пациентов и фертильных мужчин сравнивали с помощью критерия χ2. Корреляцию между носительством того или иного аллеля и риском бесплодия выявляли с помощью отнощения шансов (ОШ). Статистическую значимость различий оценивали по непараметрическому критерию Obs/Exp, достоверными считали различия при р<0,05.
Результаты. Распределение частот генотипов и частот аллелей изучаемых полиморфизмов гена MTHFR мы сравнивали в группах бесплодных и фертильных мужчин. Частота генов и генотипов аллельных вариантов генов фолатного обмена MTHFR, среди бесплодных пациентов и мужчин контрольной руппы представлена в табл. 1.
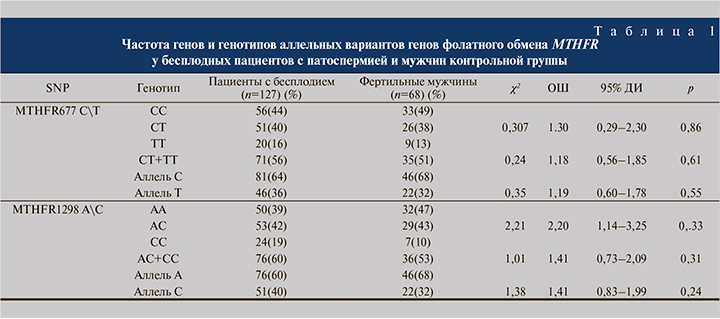
Мы не получили достоверной разницы полиморфизма С677Т гена MTHFR частоты генотипов 677С/С, 677С/Т и 677Т/Т между группами мужчин (χ2=0,29; р=0,67). Частота носителей аллеля 677Т в группе мужчин с патоспермией составила 55,9%, в группе фертильных мужчин отличалась лишь на 4,5% (χ2=0,24; р=0,61). Разница риска преобладания частоты минорного аллеля 677Т в группе мужчин с бесплодием составила 4% (χ2=0,35; р=0,55).
Мы не зафиксировали также различий полиморфизма А1298С гена MTHFR частоты генотипов А/А, А/С и С/С между пациентами с бесплодием и здоровыми мужчинами (χ2=1,53; p=0,29). Разница риска частоты аллеля 1298С (генотип АС+СС) у мужчин с патоспермией по сравнению с фертильной группой составила 7,4% (χ2=1,01; р=0,31). А разница риска частоты минорного аллеля 1298С в группе мужчин с бесплодием преобладала на 8% по сравнению с контрольной группой (χ2=1,38; р=0,24).
Так как анализ распределения генотипов MTHFR (С677Т и А1298C) в группах бесплодных и фертильных мужчин не выявил статистически значимых различий, мы решили провести сравнительный анализ частоты генов и генотипов по изучаемым полиморфизмам гена MTHFR у мужчин с разными формами патоспермии. Частота распределения генов и генотипов по полиморфизмам гена MTHFR в подгруппах мужчин с разными формами патоспермии представлена в табл. 2.
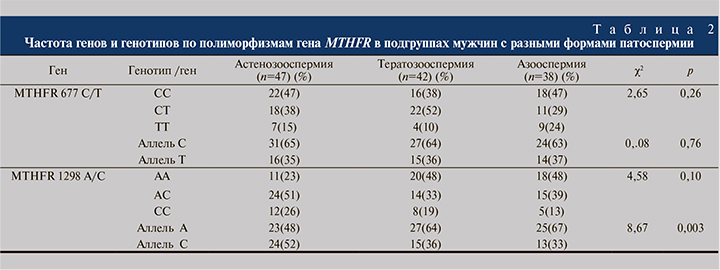
Для полиморфизма С677Т гена MTHFR частота генотипов 677С/С, 677С/Т и 677Т/Т в подгруппах мужчин с разными формами патоспермии (астенозооспермия, тератозооспермия, азооспермия) существенно не различалась (χ2=2,65; р=0,26).
Мы выявили полиморфизм A1298C гена MTHFR и незначительное преобладание частоты генотипов А/С и С/С у пациентов с нарушением подвижности сперматозоидов (χ2=4,58; р=0,1). И зафиксировали существенное преобладание частоты минорного аллеля 1298С в этой подгруппе пациентов (мужчины с астенозооспермией) по сравнению с другими подгруппами (тератоспермией и азооспермией), разница риска составила 16 и 19% соответственно (χ2=8,67; р=0,003).
Обсуждение. В литературе отмечается, что наличие низкофункциональных аллелей генов фолатного обмена вследствие изменения профиля метилирования ДНК в быстроделящихся половых клетках может сопровождаться нарушением экспрессии ключевых генов, участвующих в сперматогенезе [24]. При дефиците метильных групп в половых клетках может происходить включение уридилового нуклеотида во время репликации ДНК, что приводит к замедлению ее синтеза. Снижение метилирования ДНК из-за недостаточной активности ферментов фолатного цикла сопровождается нарушением процессов пролиферации и дифференцировки клеток вследствие дефицита метильных групп [18, 24, 25]. Отрицательное влияние полиморфизмов гена MTHFR (С667Т) на мужскую фертильность может быть связано с изменением экспрессии генов сперматогенеза, индуцированной гипометилированием [26]. В таких случаях сперматозоиды становятся более уязвимыми к воздействию реактивных метаболитов кислорода, вызывающих повреждение ДНК [26].
Следует отметить неоднозначность и противоречивость результатов исследований по изучению ассоциации полиморфизмов генов фолатного обмена с репродуктивной функцией мужчин, полученных авторами в разных популяциях. Так, ассоциация полиморфизмов С677Т и A1298С гена MTHFR c развитием необструктивной олиго- и азооспермий выявлена в Индии, Корее, Китае [11, 16, 17, 19, 20, 27]. Однако в работе [28] для некоторых районов Китая подобной связи установлено не было. Исследования по изучению влияния полиморфизмов С677Т и A1298С гена MTHFR на мужское бесплодие, проведенные в некоторых европейских популяциях, такой ассоциации также не выявили [14].
Противоречивость полученных результатов может быть вызвана как этногеографической неоднородностью генофондов популяций, так и различиями в критериях отбора обследуемых лиц, а также в числе употребляемых в пищу фолатов и витаминов В6 и В12. Например, дефицит фолатов и витамина В12 в рационе отмечен для популяции Индии, в то время как избыточное потребление фолатов и витаминов В6 и В12 зарегистрировано во Франции, Италии и в Корее [18]. Возможно, дефицит фолатов в рационе населения на фоне полиморфизмов генов фолатного обмена вносит существенный вклад в развитие бесплодия у мужчин в Индии, учитывая высокую частоту аллеля 677Т в этой популяции. Достаточное потребление продуктов, содержащих фолаты, и витамина В12, напротив, является протективным фактором развития патоспермии в европейских популяциях, маскируя негативное влияние полиморфных вариантов генов фолатного обмена.
Анализ работы C. Ravel et al., посвященной изучению ассоциации полиморфизмов гена MTHFR с мужским бесплодием во Франции, показал противоречивость результатов исследований, которые в значительной степени нивелируются при сравнении частоты распределения полиморфизмов этих генов в подгруппах мужчин с разными формами патоспермии [4]. Однако в других исследованиях была выявлена четкая ассоциация полиморфизма C677T гена MTHFR с азооспермией и с риском бесплодия у мужчин преимущественно для Азии [23], а полиморфизм А1298С гена MTHFR в большей степени ассоциирован с мужским бесплодием среди европейцев [25].
Результаты нашего исследования выявили ассоциацию аллеля 1298С гена MTHFR с риском развития астенозооспермии (р=0,003). Для полиморфизма С677Т гена MTHFR достоверной ассоциации с риском развития патоспермии среди бесплодных мужчин не установлено. Следовательно, есть все основания полагать, что полиморфизм А1298С гена MTHFR может быть одним из этиологических факторов мужского бесплодия у пациентов Московского региона. Наше исследование ограничено выборкой пациентов одного региона. В дальнейшем для оценки ассоциации полиморфизмов С677Т и А1298С гена MTHFR на репродуктивную функцию мужчин требуется проведение популяционного многоцентрового исследования.
Заключение. Аллель 1298С гена MTHFR ассоциируется с риском развития астенозооспермии в 2 раза чаще по сравнению с другими формами патоспермии. Полученные результаты позволяют рекомендовать проведение молекулярно-генетических исследований с целью выявления носителей аллеля 1298С гена MTHFR среди пациентов с патоcпермией.
Анализ ассоциации полиморфных вариантов гена MTHFR можно будет использовать для заключения о репродуктивном потенциале мужчины и выбора персонифицированной медикаментозной тактики преодоления бесплодия.



