В мире ежегодно выполняется более 2 млн биопсий предстательной железы (ПЖ) [1]. Врачебное сообщество предъявляет жесткие требования к данной процедуре и старается довести ее до совершенства. В настоящее время тонкоигольная 12-точечная биопсия под ультразвуковым наведением является «золотым» стандартом, согласно рекомендациям Европейской ассоциации урологов (ЕАУ) [2]. Именно она пришла на смену 6-точечной биопсии, которая пропускала 10–35% всех случаев рака предстательной железы (РПЖ) [3, 4]. Однако очевидно, что c увеличением количества точек (столбиков) забора материала увеличивается вероятность развития неблагоприятных исходов процедуры, а также повышается частота гипердиагностики индолентного РПЖ при низкой выявляемости агрессивных форм аденокарциномы, лоцирующихся на периферии железы. Поиск баланса между хорошей чувствительностью, специфичностью и безопасностью методики привел к появлению таргетной, или прицельной, биопсии, т.е. к забору биопсийного материала только из подозрительных участков ПЖ. Так появились множественные визуализационные методики наведения иглы во время биопсии ПЖ. В клинических рекомендациях ЕАУ (2020) рекомендуется выполнение магнитно-резонансной томографии (МРТ) ПЖ перед биопсией всем пациентам [2]. Споры по поводу необходимости использования МРТ перед биопсией ПЖ до сих пор продолжаются, поскольку исследование считается крайне ресурсозатратным, дорогим и сложным в воспроизведении. Кроме того, известно, что МРТ не выявляет около 12–23% клинически значимых опухолей ПЖ. Важно отметить, что не все пациенты могут пройти исследование по ряду причин (имплантированные металлические конструкции, кардиостимуляторы, аллергия на контрастное вещество, болезни почек и т.д.) [5]. Именно поэтому в клинических рекомендациях ЕАУ обсуждается и необходимость продолжения изучения других визуализационных методик для наведения биопсийной иглы, о которых и пойдет речь в данной статье [2].
Серошкальное трансректальное УЗИ (ТРУЗИ)
Долгое время трансректальная биопсия ПЖ выполнялась в слепую под мануальным контролем врача-уролога. В 1981 г. Holm и Gammelgaard впервые представили результаты выполнения тонкоигольной биопсии ПЖ под ультразвуковым наведением ([6]. С появлением данной методики значительно увеличился процент выявления злокачественных тканей во время биопсии. Использование ультразвука (УЗ) впервые позволило визуализировать, а не ощущать патологический очаг в предстательной железе. Значимым преимуществом УЗ-контроля при выполнении биопсии стало выявление гипоэхогенных образований в ПЖ, а значит, возможность более точного наведения биопсийной иглы на патологический очаг (рис. 1).
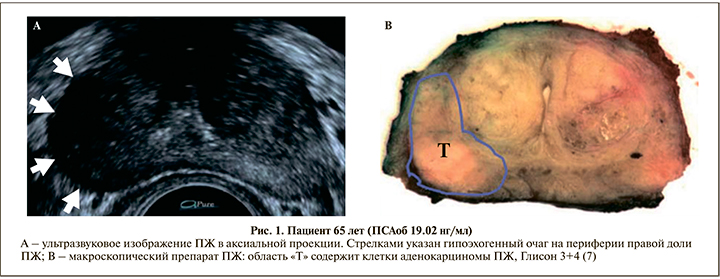
Однако со временем стали очевидными и ограничения данной методики. Забор дополнительных или таргетных участков при серошкальном УЗИ представляется крайне затруднительным из-за неоднородности визуализируемых очагов. Хотя большинство злокачественных образований в ПЖ представляются гипоэхогенными, некоторые могут иметь изо- или высокую эхогенность [7].
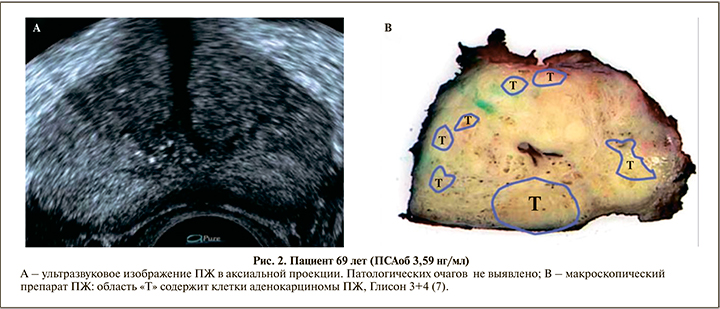
Было выявлено, что специфичность и чувствительность биопсии ПЖ под УЗ-контролем составляют 11–35%, а предсказанная ценность положительного результата колеблется в диапазоне 17–57% [8, 9]. Шанс, что из гипоэхогенного очага будет получен столбик тканей, содержащих злокачественные клетки, составляет от 3 до 52% [10, 11]. В нескольких работах выявляемость РПЖ при трансректальной биопсии под УЗ-контролем составила 23–29% [12, 13]. Большинство авторов сходятся во мнении, что серошкального УЗИ не достаточно для наведения иглы во время биопсии ПЖ.
Серошкальное УЗИ с компьютерной обработкой результатов (computer-analysed transrectal ultrasound, С-TRUS)
Для улучшения результативности серошкального УЗИ для выявления РПЖ разработано несколько компьютерных программ, анализирующих полученные УЗ-изображения. Лучшие результаты принадлежат нейронной сети, оценивающей с помощью специального алгоритма статические ТРУЗ-изображения ПЖ (artificial neuronal network analysis, ANNA-TRUS). Врач, выполняющий биопсию, по защищенному каналу пересылает УЗ-данные исследования на специальный сервер. Нейронная сеть оценивает полученный визуальный ряд и маркирует подозрительные области ПЖ, затем отсылает данные обратно врачу для выполнения таргетной биопсии (рис. 3).
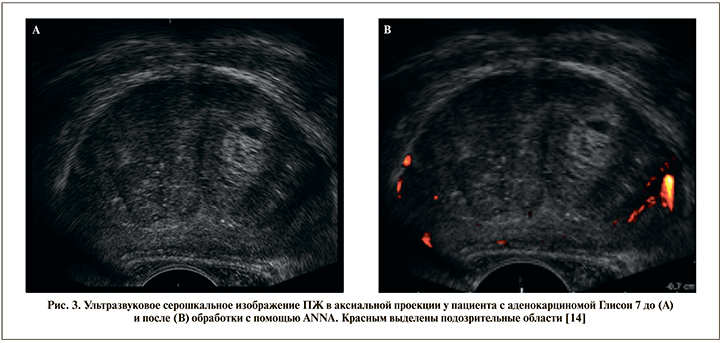
Авторы небольшой работы (28 наблюдений) оценили чувствительность и специфичность методики в 83 и 64% соответственно, что значительно превосходит показатели серошкального УЗИ [15]. В исследовании Loch et al. показано, что С-TRUS предсказал показатель Глисон в 85% случаев [16]. К сожалению, данные по результативности использования ANNA-TRUS для прицельного наведения биопсийной иглы в литературе мы не встретили.
Технология гистосканирования служит еще одним вариантом С-TRUS. Изначально аналитическая точность методики заявлена на уровне 90–100% чувствительности и 72–82% специфичности по результатам двух небольших работ [17, 18]. В более поздней работе Javed et al. [19] выявляемость РПЖ с помощью гистоскан-таргетированной биопсии составила 38%, в то время как системная биопсия может выявить до 63% опухолей ПЖ. Крупное исследование, посвященное методике гистоскан-таргетированной биопсии, принадлежит П. В. Глыбочко и соавт. [20]. Авторы показали, что таргетный забор тканей ПЖ по результатам гистосканирования выявляет 68% случаев РПЖ, что на 43% больше, чем при системной 12-точечной биопсии. Неоднородность получаемых данных по аналитической ценности такой методики требует проведения дополнительных обширных исследований.
ТРУЗИ в допплер-режиме
Известно, что очаги аденокарциномы ПЖ получают усиленное кровоснабжение за счет неоангиогенеза, характерного для злокачественного процесса [21]. Допплерографический режим позволяет оценивать степень васкуляризации ПЖ в целом, визуализировать сосудистый рисунок и гемодинамические показатели кровотока в области патологических образований. Допплерография может проводиться в двух вариантах: цветовое допплеровское картирование (ЦДК, позволяющее оценивать направление движения крови в сосудах) и энергетическая допплерография (оценивающая скоростные характеристики кровотока в сосудах более 1 мм).
Преимущество использования допплеровских методик над серошкальным УЗ для таргетного забора тканей отмечено во многих работах [17]. Самое обширное исследование (620 наблюдений) показало значительное увеличение специфичности энергетического допплеровского сканирования по сравнению с серошкальным ТРУЗИ с 47 до 74%, однако также выявило и снижение чувствительности – с 58 до 47% соответственно [22].
Ограничение методики энергетической допплерографии – высокие требования к опытности исследователя [7]. Кроме того, методика позволяет оценивать кровоток в довольно крупных сосудах, а не в микроваскулярном патологическом русле, диаметр которого составляет около 10–50 мкм [8].
Контраст-усиленное ТРУЗИ (contrast-enhanced-TRUS, CE-TRUS)
«Усиление» изображения во время серошкального УЗИ возможно с помощью специальных контрастных веществ, которые представляют собой стабилизаторы пузырьков газа (воздуха), вводимые внутривенно. Пузырьки газа позволяют визуализировать обширное микрососудистое русло, окружающее опухолевый очаг. Как правило, контраст-усиленное УЗИ выполняется в допплеровском режиме. Такое усиление изображения позволяет делать прицельные заборы тканей из областей, наиболее вероятно содержащих злокачественные клетки (рис. 4).
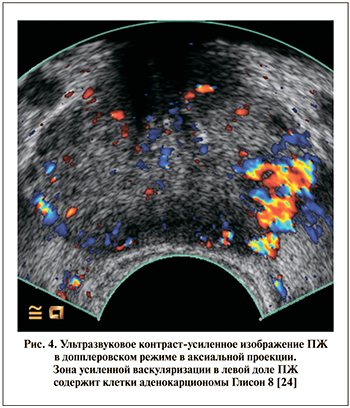
Несколько групп авторов изучали результаты использования данной методики и пришли к неоднозначным выводам. В трех работах показано, что таргетная CE-TRUS-биопсия ПЖ обеспечивает такую же выявляемость РПЖ, как и системная биопсия, при этом количество точек на исследование сокращается вдвое [23–25]. Наиболее крупное исследование принадлежит Mitterberger et al., которые изучили результаты 1776 биопсий и выявили двукратное увеличение «выявляемости на таргетный выстрел» по сравнению с 10-точечной системной биопсией под серошкальным УЗ-наведением (5,1 и 10,8% соответственно) [25]. В более ранней работе той же группы авторов показано увеличение показателя Глисон с помощью CE-TRUS с 5,8 до 6,9, однако в большом проспективном исследовании подтвердить эти данные уже не удалось [24].
Кроме того, в работах других авторов не было показано увеличения предсказанной ценности положительного результата для методики CE-TRUS по сравнению с серошкальным ТРУЗИ [12]. Различия результативности методик могут быть обусловлены выбором техники УЗ-сканирования (В-режим или ЦДК) в сочетании с использованием контраста и опытом врача, выполняющего исследование. На сегодняшний день CE-TRUS-биопсия ПЖ не часто выполняется в клинической практике из-за неоднородности результатов и относительно высокой стоимости контрастного вещества.
Интересной современной вариацией CE-TRUS является контрастное субгармоническое УЗИ ПЖ. Субгармоническая CE-TRUS-биопсия ПЖ была предварительно изучена в клиническом исследовании (55 наблюдений) [26]. Авторы продемонстрировали возможность методики выявлять клинически значимый РПЖ, а также визуализировать патологические очаги в ПЖ у пациентов с негативным результатом МРТ. Дальнейшее изучение методики продолжается.
Трансректальная эластография (transrectal elastography, TRES)
Эластография – это визуализационная методика, позволяющая оценивать различия в плотности тканей на основании УЗИ. Впервые результаты использования эластографии для визуализации образований в ПЖ представлены в 1991 г. [27]. Согласно принципу, лежащему в основе эластографии ПЖ, злокачественные ткани более плотные, чем нормальные (что и реализуется в ходе пальцевого ректального исследования). Большая плотность патологического очага обусловлена более плотным расположением злокачественных клеток, микроангиогенезом, избыточным синтезом коллагеновых волокон в данной зоне (рис. 5) [28]. Данная методика существует в двух вариантах: эластография сдвиговой волны и компрессионная эластография. Различия в плотности тканей могут быть представлены качественно и количественно.
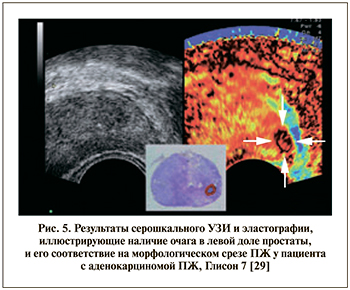
При сравнении результатов TRES с морфологическими отчетами после простатэктомии были получены следующие данные: 74% опухолей, обнаруживаемых в ПЖ после ее удаления, были видны во время TRES [29, 30]. В целом для методики TRES чувствительность составила 60–85%, специфичность 60–95% [31]. Использование TRES позволило увеличить выявляемость рака на 7,1% по сравнению с си-стемным 10-точечным подходом и повысить «выявляемость на таргетный выстрел» в 4,7 раза [32, 33]. Nelson et al. [21] показали, что области ПЖ с аномальной эластичностью в 2 раза чаще содержат участки аденокарциномы по сравнению с тканями нормальной плотности.
Кроме того, убедительными выглядят результаты биопсии под наведением изображения, полученного из слияния данных мультипараметрической МРТ и TRES [34].
Методика имеет свои ограничения, связанные со значительной зависимостью результата от механического нажатия на простату УЗ-датчика, а также сложностью дифференциальной диагностики между злокачественным очагом и доброкачественной гиперплазией. Несомненное преимущество методики – возможность забора биоптатов из подозрительных участков «здесь и сейчас», т.е. в режиме реального времени, а не на основании «замороженной картинки».
Микроультразвуковое исследование (micro-US)
В основе методики micro-US лежит использование ультразвукового датчика высокой частоты (29 MГц). Получаемое изображение имеет разрешение до 70 мкм, может визуализировать микроструктурные компоненты ПЖ и быть использовано для навигации биопсийной иглы. Первый обширный опыт использования данной методики описан Lughezzani et al. [35], которые в 104 наблюдениях сравнили аналитическую ценность micro-US- и МРТ/ТРУЗ-таргетных биопсий ПЖ. Авторы пришли к выводу, что аналитическая ценность micro-US-направленной биопсии не только сопоставима с таковой при методике МРТ/ТРУЗИ-слияния, но и превосходит последнюю в вопросе снижения количества ложноотрицательных результатов и большой предсказанной ценности отрицательного результата (90%). В другой работе [36] показано, что использование micro-US-направленной биопсии увеличивает выявляемость РПЖ на 14% по сравнению с МРТ/ТРУЗ-таргетных биопсией. Еще одна группа исследователей методики micro-US оценила ее чувствительность в 100% и показала, что с помощью высокочастотного УЗ можно лоцировать и таргетно забирать биоптаты даже у тех пациентов, МРТ ПЖ которых не выявило никаких изменений [37]. В настоящее время ведется несколько исследований по выполнению биопсии ПЖ на основе совмещенных изображений МРТ и micro-US в режиме реального времени.
Показатели диагностической значимости различных методик приведены в таблице.

Несмотря на значительную частоту использования биопсии ПЖ, в мире до сих пор не определена идеальная техника ее выполнения и методика визуализации для навигации биопсийной иглы. Длительное время урологи всего мира использовали ультразвуковые методики в различных вариациях для оценки строения ПЖ, выполнения системной, а затем и таргетной биопсии ПЖ. Затем было выявлено, что все ультразвуковые методики не смогли выявить аномальные участки у 40% пациентов с РПЖ. Хотя прицельное наведение по результатам мультипараметрических УЗ-методик повышало вероятность выявления аденокарциномы, таргетный забор в целом не увеличивал уровень выявляемости РПЖ на пациента. Последние годы МРТ ПЖ стала фаворитом в диагностике РПЖ. Стратегия выполнения МРТ перед биопсией ПЖ всем пациентам поддерживается не всеми профессиональными сообществами. Многие авторы считают это исследование избыточным и слишком дорогим, а его специфичность слишком низкой для такой сложной процедуры [38]. Таким образом, поиск других (более точных, дешевых, удобных и просто выполнимых) визуализационных методик для таргетного забора тканей во время биопсии ПЖ продолжается.



