Введение. Пуринергические Р2-рецепторы, основным эндогенным агонистом которых является аденозинтрифосфорная кислота (АТФ), широко распространены в органах и тканях человека и животных [1, 2], в том числе и в мочеполовой системе [3, 4]. В периферической нервной системе в физиологических условиях роль Р2-рецепторов в большинстве случаев не является ведущей, они лишь дополняют или модулируют действие основных нейромедиаторов (ацетилхолина, норэпинефрина). Однако при патологических процессах роль Р2-рецепторов резко возрастает и часто выходит на ведущие позиции в патогенезе того или иного заболевания. В частности, установлено, что пуринергический компонент сократительного ответа мочевого пузыря человека возрастает с 2% в нормальных условиях до 40% при некоторых патологических процессах (интерстициальный цистит, нейрогенный мочевой пузырь, обструкция мочевыводящих путей) [5–8]. Нарушения мочеиспускания в результате обструкции нижних мочевыводящих путей при заболеваниях предстательной железы остаются актуальной урологической проблемой мужчин среднего и старшего возраста. Имеется значительный арсенал средств консервативного лечения таких пациентов, однако эффективность большинства из них очень низка. Хирургическое лечение способно радикально устранять проблему, но может иметь послеоперационные осложнения, нередко требующие дополнительных вмешательств.
В связи с этим раскрытие новых оригинальных механизмов действия потенциальных лекарственных препаратов для терапии подобных состояний – актуальная задача.
Целью нашего исследования было изучение роли Р2-рецепторов в нарушении сократительной активности мочевого пузыря пациентов с обструктивными процессами нижних мочевыводящих путей.
Материалы и методы. В исследовании приняли участие 38 пациентов с установленным диагнозом доброкачественной гиперплазии предстательной железы, преимущественно с обструктивной симптоматикой. Средний возраст пациентов составил 70,6±5,9 года. Длительность заболевания до момента хирургического лечения составила в среднем 5,2±2,6 года. В течение этого периода пациенты находились на медикаментозной терапии (α1А-адреноблокаторы; блокаторы 5α-редуктазы). Перед операцией все пациенты прошли стандартное обследование с использованием обязательных и рекомендованных методов диагностики: IPSS – 19,3±5,9 балла; ПСА – 2,8±1,1 нг/мл; количество остаточной мочи составило 69,6±36,8 мл. Трансректальное УЗИ выявило аденоматозные узлы. Объем предстательной железы составил 93,97±17,26 см3, средняя скорость мочеиспускания по данным урофлоуметрии – 5,1±1,7 мл/с.
На основании результатов проведенного обследования всем пациентам установлен клинический диагноз ДГПЖ. У 33 пациентов заболевание соответствовало 2-й стадии, 5 пациентов имели эпицистостому, наложенную по поводу острой задержки мочи, у 2 из 38 мужчин основное заболевание осложнилось камнями мочевого пузыря.
Показания к чреспузырной аденомэктомии с глухим швом мочевого пузыря или вторично отсроченным глухим швом: неэффективность медикаментозной терапии, значительный объем предстательной железы; наличие эпицистостомы, выраженные нарушения уродинамики нижних мочевыводящих путей с преобладанием обструктивной симптоматики и отказ пациентов от трансуретрального вмешательства.
Материал для экспериментальных фармакологических исследований получали во время хирургического вмешательства.
Все пациенты перед исследованием ознакомились с пакетом документов и подписали информированное согласие на участие в исследовании. Кроме того, на каждого пациента, вошедшего в исследование, клинический куратор проекта заполнял регистрационную карту, в которой указывал урологический статус пациента и подтвержденный диагноз.
На проведение исследования получено одобрение локального этического комитета Казанского ГМУ.
Во время операции, перед выполнением основного этапа (аденомэктомии) из передней стенки мочевого пузыря, верхнего края разреза, забирали образец ткани стенки мочевого пузыря (через все слои). Из этого образца выделяли кусочек размером 0,5×1,5 см, который сразу помещали в охлажденный (4 °С) физиологический раствор Кребса–Хенселейта и доставляли в фармакологическую лабораторию для исследования. Остальную часть ткани отправляли на морфологическое исследование.
Всего было получено 38 образцов ткани мочевого пузыря от 38 пациентов. В силу разных причин (малый размер, отсутствие мышечной ткани, неправильное хранение и др.) образцы ткани 8 пациентов оказались не пригодными для исследований. Таким образом, для фармакологических экспериментов были использованы образцы 30 пациентов.
Фармакологические эксперименты
В фармакологической лаборатории из полученных образцов ткани готовили гладкомышечные препараты размером примерно 2×10 мм. Мышечные препараты помещали в термостатируемый стаканчик с раствором Кребса–Хенселейта (37±0,5°С) объемом 10 мл для регистрации механической активности. Раствор Кребса–Хенселейта имеет следующий состав (в мМ): NaCl 118, KCl 4,7, NaHCO3 25, KH2PO4 1,2, MgSO4•7H2O 1,2, CaCl2•2H2O 1М 2,5, глюкоза 7,8 и в течение всего эксперимента аэрируется газовой смесью 95% кислорода и 5% углекислого газа (рН 7,4). Один конец гладкомышечного препарата жестко фиксировали, другой – прикрепляли к изометрическому датчику механической активности FSG-01 (Linton, Великобритания) с помощью шелковой нити. Запись проводили на компьютере с помощью программы MP100WSW DataAcquisitionSystem (Великобритания). Интерфейс программы разработан компанией Biopack, Великобритания. К препарату прилагали начальную нагрузку в 1 г, затем оставляли в покое на 1 ч для стабилизации, меняя омывающий раствор в стаканчике каждые 15 мин. Стимуляцию электрическим полем (СЭП) проводили с использованием стимулятора DigitimerMultistim D330 (Великобритания) при помощи двух платиновых колец диаметром 2,5 мм, через которые пропущен гладкомышечный препарат, расстояние между кольцами составило 15 мм. Стимуляцию проводили до тех пор, пока сокращение после достижения своего максимума не уменьшится на треть. Частота сокращений – 0,5–32 имп/с, ширина – 0,5 мс, напряжение – 100 В, импульс прямоугольный. Между каждой последующей стимуляцией выдерживали интервал 60 с. При проведении экспериментов с электрической стимуляцией в раствор Кребса–Хенселейта добавляли атропин (1 мкМ) и фентоламин (10 мкМ), чтобы исключить влияние М-холино- и α-адренорецепторов на ответ ткани. Сократительные агенты вносили непосредственно в стаканчик и несколько раз отмывали препарат раствором Кребса–Хенселейта после достижения максимума сокращения. Фармакологическими методами проведена оценка подтипов Р2-рецепторов, представленных в мочевом пузыре человека. Для этого использовали следующие агонисты и антагонисты: АТФ (универсальный агонист всех Р2-рецепторов), альфа-бета-метилен-АТФ (агонист Р2Х-рецепторов, имеет предпочтение к Р2Х1- и Р2Х3-рецепторам), 2-метилтио-АДФ (агонист Р2Y1-рецепторов), АДФ (агонист Р2Y12-рецепторов), УТФ (агонист некоторых подтипов Р2Y-рецепторов), PPADS (универсальный антагонист Р2-рецепторов, в низких концентрациях имеет предпочтение к Р2Х-рецепторам), сурамин (универсальный антагонист Р2-рецепторов), NF023 (антагонист Р2Х1-рецепторов), MRS2500 (антагонист Р2Y1-рецепторов). Кроме этого мы оценивали эффективность лигандов других рецепторов – карбахолина (агонист М- и Н-холинорецепторов), эпинефрина (агонист альфа- и бета-адренорецепторов), гистамина (агонист гистаминовых рецепторов), серотонина (агонист 5-НТ-рецепторов), атропина (антагонист М-холинорецепторов). Оценивали зависимость «частота–сокращение» или «концентрация–сокращение» в зависимости от агента и условия эксперимента. Математическую и статистическую обработку результатов исследований и их наглядное отображение проводили при помощи программного обеспечения Microsoft Excel. Сравнение групп проводили с использованием t-критерия Стьюдента.
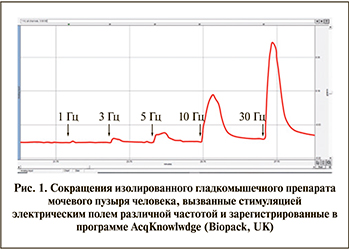
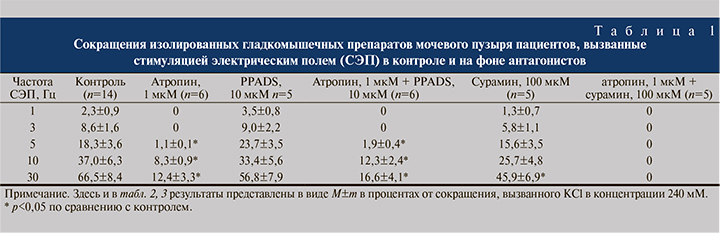
Результаты. Влияние стимуляции электрическим полем (СЭП). Стимуляция электрическим полем частотой 1–20 Гц вызывала частотно зависимые сокращения гладкомышечных препаратов из выделенного образца стенки мочевого пузыря человека (рис. 1). После 20-минутной инкубации ткани с М-холиноблокатором атропином (1 мкМ) сокращения, вызванные низкими частотами (1–5 Гц), не регистрировались, а при частотах 10–30 Гц снижали свою амплитуду на 80% и более. Добавление PPADS в концентрации 10 мкМ после инкубирования ткани с атропином не приводило к каким-либо дополнительным изменениям сократительной активности мочевого пузыря. Добавление в среду неселективного антагониста Р2-рецепторов PPADS (10 мкМ) не оказывало существенного влияния на сокращения стенки мочевого пузыря человека, вызванные СЭП. Инкубирование ткани с другим неселективным антагонистом Р2-рецепторов, сурамином (100 мкМ), приводило к снижению сокращений, вызванных СЭП, примерно на 30% от исходного. Совместное применение сурамина (100 мкМ) и атропина (1 мкМ) полностью угнетало сокращения, вызванные СЭП, при всех использованных частотах стимуляции (табл. 1).
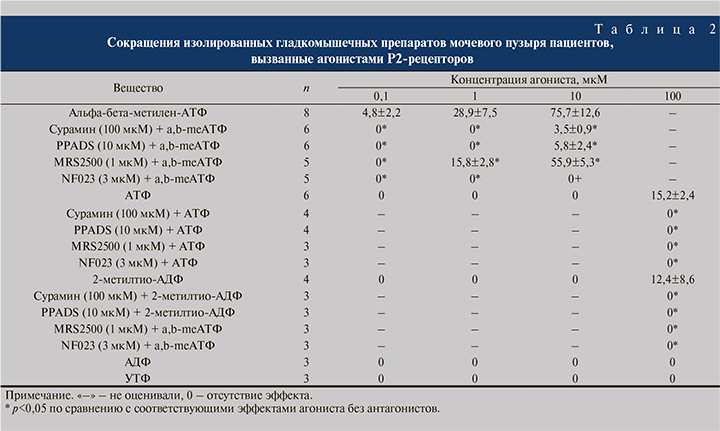
Влияние агонистов и антагонистов Р2-рецепторов. Добавление в инкубационную среду агонистов Р2-рецепторов приводило к различным изменениям сократительной активности образца ткани стенки мочевого пузыря человека. Наибольшее влияние на сократительную деятельность оказал альфа-бета-метилен-АТФ (0,1–10 мкМ), который вызывал концентрационно-зависимые сокращения. АТФ (1–100 мкМ) вызывал небольшие по амплитуде сокращения лишь в самой высокой из использованных концентраций. Аналогично 2-метилтио-АДФ (0,1–10 мкМ) обусловливал сокращения только в самой высокой из использованных концентраций. АДФ и УТФ, оба в концентрациях (1–100 мкМ), не вызывали сокращений образцов ткани из стенки мочевого пузыря человека (табл. 2). Инкубирование ткани мочевого пузыря с PPADS (10 мкМ) или сурамином (100 мкМ) полностью угнетало сократительные ответы, вызванные альфа-бета-метилен-АТФ, АТФ и 2-метилтио-АДФ. На фоне MRS2500 (1 мкМ), селективного антагониста Р2Y1-рецепторов, снижались сокращения, вызванные всеми использованными агонистами, примерно на 10–30%. Установлено, что селективный антагонист Р2Х1-рецепторов, NF023 (3 мкМ), полностью угнетал сокращения, вызванные всеми вышеперечисленными агонистами Р2-рецепторов.
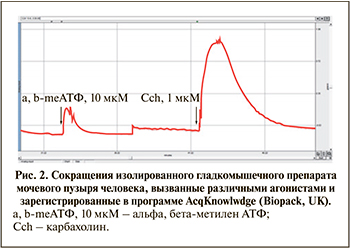
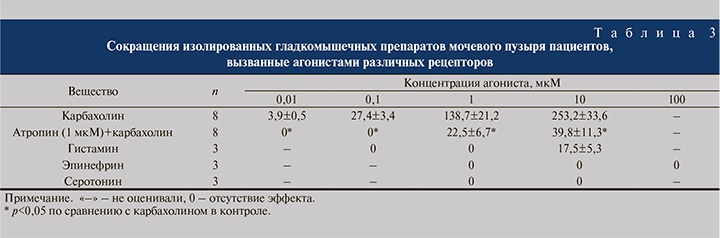
Влияние агонистов других рецепторов. Карбахолин (0,01–10 мкМ) вызывал сильные, концентрационно зависимые сокращения изолированных гладкомышечных препаратов мочевого пузыря человека. По своему эффекту он во много раз превышал эффективность самого активного агониста Р2-рецепторов – альфа-бета-метилен-АТФ. На рис. 2 представлены амплитуды сокращений изолированного мочевого пузыря, вызванных альфа-бета-метилен-АТФ в концентрации 10 мкМ и карбахолином в концентрации 1 мкМ. Инкубирование ткани с атропином (1 мкМ) полностью предупреждало сокращения, вызванные карбахолином в концентрациях до 1 мкМ, и существенно угнетало сокращения, вызванные высокими концентрациями агониста. Гистамин (0,1–10 мкМ) вызывал небольшие сокращения мочевого пузыря только в самой высокой из использованных концентраций. Эпинефрин (1–100 мкМ) и серотонин (0,1–10 мкМ) не вызывали существенных изменений в сократительной активности мочевого пузыря человека (табл. 3).
Обсуждение. Хорошо известно, что в мочевом пузыре человека в физиологических условиях сократительную активность обеспечивают в основном холинергические нервы. Результаты нашего исследования свидетельствуют о том, что то же имеется и у пациентов с обструкцией нижних мочевыводящих путей. При этом так же, как и в физиологических условиях, у пациентов с ДГПЖ имеется небольшой «нехолинергический компонент». Эффект двух неселективных антагонистов Р2-рецепторов, PPADS и сурамина, не позволяет однозначно утверждать или отвергать уча-стие пуринергических нервов, поскольку PPADS не влиял на сокращения, вызванные СЭП, а сурамин их угнетал. Трипаноцидный препарат сурамин имеет массу разнообразных эффектов, среди которых есть и неселективное угнетение активности Р2-рецепторов [9, 10]. Возможно, с иными, не только пуринергическими, влияниями сурамина связан его эффект в наших экспериментах. Ранее было установлено, что в мочевом пузыре лабораторных животных имеются рецепторы Р2Х1, Р2Х3, Р2Y1, Р2Y2, участвующие в сократительной активности [3, 4]. Фармакологическими методами трудно точно определить подтипы Р2-рецепторов, однако проведенные нами исследования дают основания предполагать наличие Р2Х1-, Р2Х3-, Р2Y1-рецепторов в мочевом пузыре человека. В частности, мы показали высокую эффективность агониста Р2Х1- и Р2Х3-рецепторов альфа-бета-метилен-АТФ и эффективность антагониста Р2Х1-рецепторов NF023. Кроме того, мы предполагаем наличие Р2Y1-рецепторов на основании эффективности 2-метилтио-АДФ (агониста этих рецепторов) и MRS2500 (антагониста этих рецепторов).
Исследования последних десятилетий подтверждают возможность использования агонистов и антагонистов Р2-рецепторов в клинической практике. Одним из значительных достижений фармакологии последних десятилетий стало внедрение в клиническую практику антагонистов тромбоцитарных P2Y12-рецепторов (тиклопидин, клопидогрел) в качестве эффективных антиагрегантов [11]. Большое разнообразие и широкая представленность Р2-рецепторов в организме человека делают их весьма привлекательными в качестве потенциальных мишеней действия новых лекарственных препаратов, поэтому исследования в этой области, безусловно, следует продолжать.
Следует, конечно, оговориться, что наше исследование имеет определенные ограничения для корректной интерпретации результатов. Поскольку материал для исследования брался у больных с длительно существующий инфравезикальной обструкцией, это может сказаться на активности рецепторного аппарата в гладких мышцах мочевого пузыря. В последующих исследованиях мы планируем модифицировать дизайн с учетом этого обстоятельства, а также с фокусированием на длительности заболевания и характере получаемой до операции лекарственной терапии. Мы верим, что результаты, описанные в этом исследовании, и наших планируемых исследований станут основанием для поиска новых лекарственных средств, воздействующих посредством влияния на Р2-рецепторы, для комплексного патогенетического лечения заболеваний мочеполовой системы человека.
Заключение. Проведенные нами исследования показали, что изолированные гладкомышечные образцы ткани стенки мочевого пузыря человека отвечают сократительными ответами на СЭП, а также на агонисты холинергических и пуринергических рецепторов. Эти исследования свидетельствуют, что основным подтипом Р2-рецепторов, участвующих в сократительной активности мочевого пузыря человека, в том числе при доброкачественной гиперплазии мочевого пузыря, являются Р2Х1-рецепторы. Эксперименты показали, что определенное влияние на сократительную активность гладких мышц мочевого пузыря имеют также Р2Y1-рецепторы, тогда как остальные подтипы Р2-рецепторов использованными нами фармакологическими методами не выявляются.



