Введение. Несмотря на значительное число клинических и экспериментальных исследований, посвященных изучению этиопатогенеза простатита, наличие европейских и отечественных рекомендаций по диагностике и лечению данной группы заболеваний, существует множество аспектов, которые необходимо учитывать при верификации диагноза и определении тактики лечения пациентов [1, 2]. Вопреки существующей парадигме о преобладании в структуре заболеваемости простатитом абактериальных форм (категории IIIa и IIIb, согласно NIH-NIDDK, 1995), имеются публикации, в которых оспаривается данная точка зрения и обосновывается мнение, в соответствии с которым распространенность бактериального простатита (категории II) в структуре различных форм простатита может быть значительно выше общепризнанной (5–10%) [3–5].
При обследовании пациентов с простатитоподобными симптомами одними из ключевых методов верификации диагноза служат проба Meares–Stamey и препостмассажный тест Nickel [6]. В рутинной практике, ориентируясь на показатели обсемененности (микробной нагрузки) секрета простаты/постмассажной порции мочи и уровень лейкоцитов, клиницист проводит дифференциальную диагностику бактериальных и абактериальных форм заболевания. Однако в некоторых случаях отмечается несоответствие между уровнем микробной нагрузки эксприматов, характером предъявляемых жалоб и данными физикального обследования. Так, при пороговом уровне обсемененности (104–105 КОЕ/мл) секрета простаты/постмассажной порции мочи имеются выраженные простатитоподобные симптомы, в первую очередь боль и дизурические расстройства, при более высоких показателях обсемененности биоматериала клинические проявления и отклонения в объективных показателях, наоборот, не столь существенны.
Формирование органических нарушений в простате при воспалении определяется множеством индивидуальных факторов реактивности организма. Кроме того, при субъективной оценке возникших изменений, которые пациенты озвучивают в виде жалоб, значительную роль играют исходный психоэмоциональный статус, когнитивные способности и ментальность. Тем не менее приоритетным направлением в данной научной работе служит изучение первичного субстрата, опосредующего развитие воспалительной реакции при бактериальном простатите.
Цель исследования: оценить в эксперименте взаимосвязь между показателями обсемененности и степенью патоморфологических изменений ткани простаты при инфицировании «эталонным» уропатогеном E. coli в различных титрах.
Материалы и методы. Этическое заявление. Эксперимент с использованием лабораторных животных разработан и проведен в соответствии с положениями и требованиями, отраженными в международных и отечественных регулирующих руководствах (согласно Rus-LASA), рекомендациями ARRIVE и одобрен локальным независимым этическим комитетом ФГБОУ ВО РостГМУ Минздрава России на основании представленного дизайна (протокол № 16/17) [7–10].
Лабораторные животные. Работа проведена на 16 половозрелых кроликах New Zealand массой 3580 [3480; 3695] г, возраст которых составил 25 [24; 26] мес. Содержание животных в виварии осуществляли в соответствии с ГОСТ 33215-2014 и ГОСТ 33216-2014 [22–23]. Рацион на особь: 150 г сухого гранулированного полнорационного корма, 200 мл жидкости. Период адаптации к новым условиям обитания перед экспериментом – 7 дней.
Уропатоген. В качестве инфицирующего агента использован штамм E. сoli № 32, идентифицированный посредством бактериологического исследования секрета простаты по разработанной методике (патент RU 2452774 C1 № 2011103414/10 от 31.01.2011) у пациентов с простатитом категории II (NIH-NIDDK, 1995), полученным путем проведения пробы Meares–Stamey. Титрование культуры уропатогена осуществляли методом серийных разведений в фосфатно-буферном растворе до достижения концентраций 103, 105, 107 КОЕ/мл за 24 ч до эксперимента.
Рандомизация. После окончания периода адаптации для минимизации ошибок отбора (selection bias) животные случайным образом распределены на 4 группы (по 4 особи в каждой) по основному критерию – инфицирующей дозе уропатогена. В 1-й группе она составила 103 КОЕ/мл, во 2-й – 105 КОЕ/мл, в 3-й – 107 КОЕ/мл. Животным 4-й, контрольной, группы вводили 0,9%-ный раствор NaCl. На постинфекционном этапе c целью снижения количества ошибок, связанных с ходом эксперимента (performance bias), выполняли «ослепление» рабочей группы посредством шифрования каждой инфицированной особи путем присвоения идентификационного кода.
Воспроизведение бактериального простатита в эксперименте. В зафиксированном положении животного на спине под комбинированной анестезией после предварительной обработки наружных половых органов местными антисептиками выполняли топическую трансуретральную инокуляцию инфектанта (1,0 мл) по методике, разработанной J. C. Nickel et al. [11], с помощью катетера Foley (с внесенными конструкторскими изменениями) в простатический отдел уретры (ПОУ), изолируя баллончиком катетера верхние мочевыводящие пути и мочевой пузырь на уровне шейки последнего для предотвращения распространения инокулята. Экспозиция инокулята в ПОУ – 30 мин. После этого катетер удаляли, животных повторно обезболивали и переносили в виварий. Наблюдение за состоянием инфицированной особи осуществляли в течение 2 ч и затем ежедневно в течение всего срока до вивисекции.
Вскрытие выполняли на 1-е, 3-и, 7, 14-е сутки после инокуляции уропатогена. Особей умерщвляли путем интракардиальной инъекции 2%-ного лидокаина (0,5 мл) после предварительной внутривенной анестезии. Выделение урогенитального органокомплекса (УГОК), включившего мочевой пузырь (МП), простатический комплекс (ПК: пропростата (ППр)+простата (Пр)+парапростата (ПаПр)), проксимальную простатическую уретру (ПУ) и семявыносящие протоки (СВП), из полости таза осуществляли через лапаротомный доступ после перевязки кишечника, мочеточников и магистральных сосудов.
Бактериологическое и патоморфологическое исследования. Для бактериологического исследования выделяли биоптаты из 4 фокусов ПК: дистальной половины Пр (1А), пограничного участка между ППр (дистальная треть) и Пр (проксимальная треть) (1В), проксимальной ППр (1С), ПаПр (1D). После гомогенизации биоптатов в аппарате BDTM Medimachine System («Becton, Dickinson and Company, BD Biosciences», США) с 10 мл фосфат-буферного раствора выполняли 10-кратную дилюцию полученной взвеси методом серийных разведений. Последующий посев гомогената проводили на агар MacConkey («HiMedia Laboratories Pvt. Limited», Индия), инкубацию осуществляли при 37°С в течение 24 ч.
При формировании биоптатов для патоморфологического исследования (ПМИ) осуществляли продольные срезы тканей УГОК через все слои: получено 2 параллельных пластинчатых биоптата из медиального (Р1–ПУ, медиальные части ППр, Пр, СВП) и латерального (Р2, латеральные участки ППр, Пр, СВП и ПаПр) участков органокомплекса. Фиксацию участков тканей выполняли в 10%-ном розовом нейтральном забуференном формалине («БликМедиклПродакшн», Россия) в течение 48 ч.
Гистологическую проводку (обезжиривание и обезвоживание, просветление, парафинирование) проводили по стандартной технологии. Срезы из парафиновых блоков получали с помощью ротационного микротома Leica RM 2265 («Leica Microsystems», Германия), окрашивали гематоксилином и эозином («БликМедиклПродакшн», Россия). Микроскопию готовых препаратов проводили с помощью прямого светового микроскопа Leica DM2000 («Leica Microsystems», Германия) в увеличениях х10, х40, х100, х400, фотофиксацию патоморфологических изменений цифровой камерой Leica DFC295 3 Mpx («Leica Microsystems», Германия).
С целью оценки и сопоставления тяжести патоморфологических изменений, зафиксированных в Пр, нами введена балльная система представления выраженности патогистологических изменений в номинальной шкале при визуальном осмотре 5 полей микропрепарата: 0 баллов – отсутствие патологического изменения (признака)/невозможно достоверно оценить наличие изменения (признак); 1 балл – незначительно/минимально выраженные изменения (признак); 2 балла – умеренно-выраженные изменения (признак); 3 балл – максимально выраженные изменения (признак).
Кодировку биоптатов применяли для «ослепления» персонала, проводящего бактериологическое и гистологическое исследования, с целью минимизации ошибок детекции (detection bias).
Статический анализ. Анализ полученных данных проводили с помощью пакетов программного обеспечения Microsoft 365 («Microsoft», США) и Statistica 10.2 («StatSoft Inc.», США). Описательная статистика количественных признаков представлена в виде центральной тенденции медианы (Me) и интерквартильного размаха [LQ; UQ], верхних и нижних пределов (min–max), а также среднего (M) и стандартного отклонения среднего (m). Сравнение независимых переменных в группах проводили с помощью непараметрических U-теста Манна–Уитни и H-теста Крускалла–Уоллиса (one-way ANOVA). Принятые уровни статистической значимости p<0,05 и <0,01.
Результаты. Данные бактериологического исследования показали, что наибольшие совокупные абсолютные/медианные величины обсемененности биоптатов ПК в период с 1-е по 14-е сутки (∑[суммарный] титр, 1А–1D) выявлены в 1-й группе, промежуточные – во 2-й и минимальные – в 3-й группе: 48 lgКОЕ/мл/3,00 [3,00; 3,25] lgКОЕ/мл.
При совокупной погрупповой оценке медианных значений микробной нагрузки анатомических структур ПК (1А–1В) установлено, что в группе 1 она возрастала с 1-х к 3-м и достигала пика на 7-е сутки, но к 14-м суткам снижалась до минимального уровня. В группе 2 отмечена иная картина – максимальный уровень обсемененности зафиксирован на 1-е сутки, с 3-х суток отмечено постепенное снижение, достигшее наименьших значений в группе на 7-е сутки, которое сменилось резким подъемом значений на 14-е сутки до субмаксимальных. Обсемененность биоптатов в группе 3 на 1-е сутки также имела наивысшие значения, незначительно снижалась к 3-м суткам и оставалась на данном уровне до 7-х суток, к 14-м суткам микробная нагрузка уменьшалась до минимальных значений.
Погрупповой анализ значений обсемененности анатомических структур ПК с суточным накоплением (1A/1B/1C/1D – 1–14-е сутки) продемонстрировал, что наибольшая микробная нагрузка в 1-й группе установлена в ПаПр (1D), в свою очередь в Пр и ППр (1А/1В/1С) она была сопоставимой. Во 2-й группе максимальные значения обсемененности определены в пограничном участке Пр и ППр (1В), промежуточные показатели микробной нагрузки определены на сопоставимом уровне в участках Пр (1А) и ПаПр (1D), минимальные отмечены в ППр (1С). Напротив, в 3-й группе наиболее высокие показатели микробной нагрузки выявлены в ППр (1С), переходные значения – в Пр (1А) и пограничном участке Пр и ППр (1В) на сопоставимом уровне, наименьшие показатели обсемененности верифицированы в ПаПр (1D). Соответствующие величины обсемененности представлены в табл. 1.
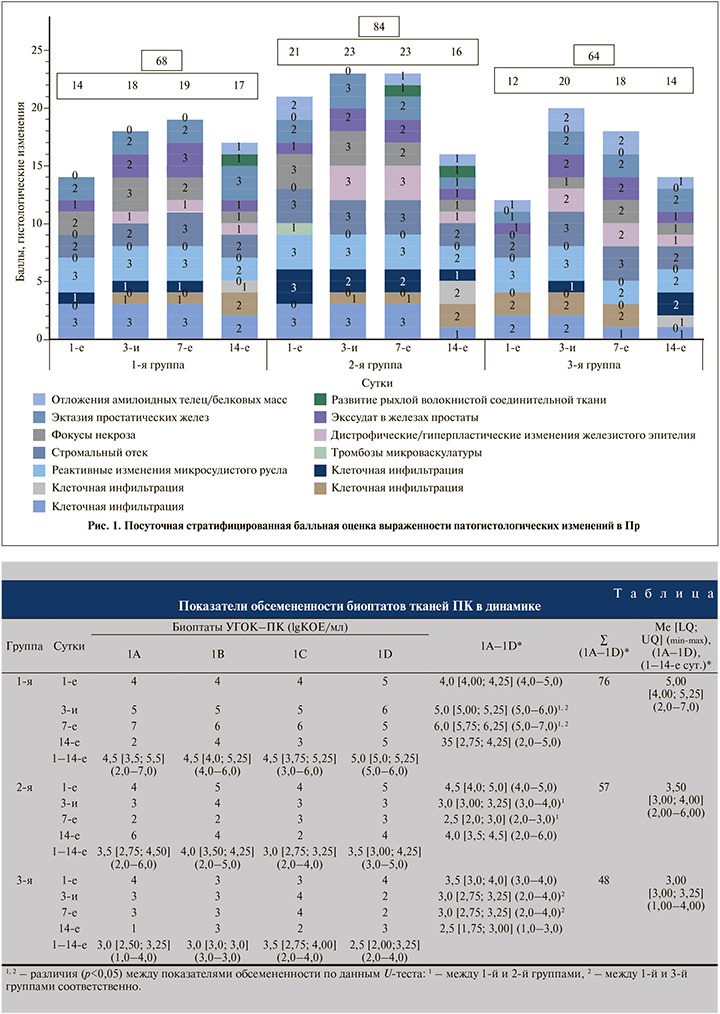
При аналитической оценке показателей микробной нагрузки анатомических структур ПК с сепаратным (1А/1В/1С/1D на 1-е, 3-, 7-, 14-е сутки) и интегративным (1А–1D на 1-е, 3-, 7-, 14-е сутки) посуточным накоплением установлены соответствующие различия между группами (U-критерий, H-тест): 1) при раздельной попарной проверке микробной нагрузки анатомических структур ПК выявлено, что в 1-й группе данный показатель в пограничном участке Пр и ППр (1В) и ПаПр (1D) определен на значимо более высоком уровне, чем в 3-й группе (U-критерий, р<0,05), иных различий в показателях обсемененности в группах не выявлено; ранговое одноблоковое (1-я группа–2-я группа–3-я группа) тестирование дисперсии значений обсемененности различных структур ПК выявило различия между данными показателями в группах только в участке ПаПр (1D) (ANOVA H-тест, р<0,05); 2) в 1-й группе интегративная обсемененность анатомических структур ПК была выше, чем во 2-й и 3-й группах, на 3-и и 7-е сутки (U-критерий, р<0.05); различий значений совокупной обсемененности ПК во 2-й и 3-й группах не зафиксировано (U-критерий, р>0,05).
В 4-й группе (контроль) верифицирована резидентная микрофлора, представленная таксонами Propionibacterium spp., Eubacterium spp., Bacteroides spp. и Enterococcus spp. в виде моно- и бикомпонентных микробных ассоциаций в титрах от 101 до 103 lgКОЕ/мл.
При гистологическом исследовании в участках тканей Пр во всех экспериментальных группах выявлены признаки островоспалительных деструктивных изменений различной интенсивности и обширности, характеризующихся формированием очагов инфильтрации тканей воспалительными клетками (нейтрофилами, макрофагами, в меньшей степени лимфоцитами и эозинофилами), фокусов некроза и дистрофии клеток, дилатацией простатических желез и накоплением в них белковых масс и амилоидных телец, отеком стромы с отложением в ней фибрина, дезинтеграцией интерстиция, а также реактивным полнокровием сосудов с набуханием и десквамацией клеток эндотелия.
Совокупная максимальная степень гистологических изменений в Пр зафиксирована во 2-й группе (∑ [суммарный] балл 84), выраженность поражений Пр в 1-й группе определена как промежуточная (∑ [суммарный] балл 68), а в 3-й группе оказалась наименьшей (∑ [суммарный] балл 64; рис. 1).
Полиноминальный анализ показал, что в 1-й группе выраженность воспалительных изменений постепенно нарастала с минимальных на 1-е сутки (14 баллов) до максимальных на 7-е (19 баллов) и в последующем постепенно снижалась до эпиминимальных (см. рис. 1). Во 2-й группе с 1-х суток отмечены выраженные патоморфологические изменения, которые нарастали к 3-м суткам, достигнув максимального стационарного уровня (23 балла), сохранившегося и на 7-е сутки (с незначительными изменениями структуры патологических изменений), и снижались до минимальных (16 баллов) к 14-м суткам (см. рис. 1). При оценке суммарных баллов градационной шкалы в 3-й группе отмечено резкое скачкообразное нарастание степени патогистологических изменений с минимального уровня на 1-е сутки (12 баллов) до максимального к 3-м (20 баллов) с последующим ступенчатым снижением (см. рис. 1).
Патоморфологические изменения в Пр животных 4-й группы не были верифицированы.
Для сопоставления показателей обсемененности и тяжести островоспалительных поражений ткани Пр определены графические тренды изменения значений микробной нагрузки и номинальных величин патоморфологических изменений на различных сроках эксперимента (рис. 2).
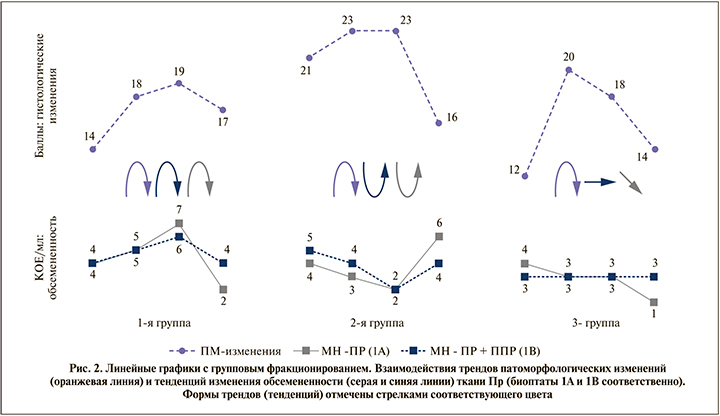
В 1-й группе определен синхронный «параболический» тренд патоморфологических изменений и показателей обсемененности Пр (1А, 1В): нарастание с 1-х до 7-х суток и снижение к 14-м суткам. Во 2-й группе графики тенденций патоморфологических изменений и показателей обсемененности имели схожие формы («трапециевидная» – гистологические изменения, «параболические» – изменения обсемененности), но различались по направленности: степень деструктивных гистологических изменений нарастала к 3-м суткам и имела схожую картину на 7-е, но микробная нагрузка ткани Пр снижалась с 1-х суток, достигнув минимума на 7-е сутки (1А, 1В); к 14-м суткам отмечалась тенденция к разрешению островоспалительных изменений, а микробная нагрузка биоптатов, напротив, возрастала (в биоптате 1А – до максимальных значений). В 3-й группе график тренда, характеризующий гистологические изменения, имел «пиковую» форму за счет резкого увеличения тяжести поражений на 3-и сутки и последующего снижения выраженности гистологических изменений, достигших минимума к 14-м суткам. Однако курватура трендов обсемененности имела совершенно иную форму: микробная нагрузка проксимальной части Пр (1А) ступенчато снижалась с 1-х суток (наивысшие показатели) к 14-м (минимум), а дистальной (1В) – оставалась на одном уровне (комбинированный ступенчато-линейный тренд).
Обсуждение. Анализ данных бактериологического исследования ткани ПК показал парадоксальные результаты. Так, наибольший интегративный показатель обсемененности совокупного ПК выявлен в 1-й группе при инокуляции минимальным исследуемым титром уропатогена 103 КОЕ/мл (∑ lgКОЕ/мл – 76). Вместе с тем при инфицировании более высокими титрами E. coli (105 и 107 КОЕ/мл) совокупный показатель обсемененности ПК во 2-й группе оказался на 25% ниже, чем в 1-й, в 3-й группе – на 37% и был минимальным в данной экспериментальной серии. Следует также отметить, что по отношению к исходной инфицирующей дозе только в 1-й группе отмечено повышение медианного показателя обсемененности ПК – 103 против 105 КОЕ/мл, которое может свидетельствовать о прогрессирующем размножении уропатогена в инфицированных тканях. В свою очередь во 2-й и 3-й группах зафиксировано снижение медианных показателей – 105 против 103,5 КОЕ/мл и 107 против 103 КОЕ/мл соответственно. Таким образом, не определено увеличения микробной нагрузки тканей ПК по отношению к стартовому инфицирующему титру.
Можно предположить, что при инокуляции низкого титра (103 КОЕ/мл) каузативного уропатогена ответ иммунной системы не так активен, как в случае инокуляции патогенных концентраций. Следствием этого может стать постепенное повышение бактериальной обсемененности тканей ПК при увеличении срока наблюдения, в течение которого происходит антигенная презентация и активация клеточных и гуморальных звеньев иммунитета в фокусах воспаления, в то время как при инокуляции более высоких титров (105 и 107 КОЕ/мл) иммунная реакция может носить рапидный характер и обеспечивать подавление деления и диссеминации уропатогенов в тканях ПК (Пр) либо его активную элиминацию.
При оценке номинальных показателей формирования патоморфологических изменений в биоптатах Пр (детально описанных нами ранее) во всех тестируемых группах с 1-х суток зафиксировано островоспалительное поражение ткани Пр различной интенсивности, наиболее выраженное во 2-й группе [4]. Полученные к 3-м суткам данные свидетельствовали о нарастании тяжести воспалительного процесса в тканях Пр, причем во 2-й и 3-й группах изменения оказались «пиковыми». С 7-х суток во всех группах отмечена рассинхронизация показателей: в 1-й группе выраженность патоморфологических изменений нарастала, достигнув максимума на данном контрольном сроке, во 2-й группе совокупно не отмечено изменений в тяжести течения деструктивного процесса (вариации отмечены только в характере поражений); в 3-й группе, напротив, определена тенденция к снижению выраженности патоморфологических изменений. Тем не менее к 14-м суткам во всех группах зафиксировано разрешение активного воспалительного процесса, при этом во 2-й группе, несмотря на максимальную выраженность поражения на 3–7-е сутки по отношению к другим группам, к окончанию срока наблюдения установлены минимальные изменения, в 1-й и 3-й группах практически соответствовали инициальным.
Непосредственное соотнесение результатов (номинальных интерпретаций и трендов) бактериологического и патоморфологического исследований позволило установить, от каких параметров в первую очередь зависит тяжесть воспалительных изменений: от изначального титра уропатогена или уровня микробной нагрузки тканей.
- Для 1-й и 3-й групп зафиксированы следующие точки «сопряжения»: выявление в обеих группах островоспалительных изменений в тканях на 1-е сутки и практически полный регресс до начальных показателей на 14-е сутки: оба графика тенденций (обсемененность и патоморфологические изменения) совпадали в начальной и конечной точках. В 1-й группе пик изменений констатирован на 7-е сутки, тогда как в 3-й группе максимальные изменения выявлены на 3-и сутки, а к 7-м суткам отмечено уменьшение выраженности патоморфологических изменений. Тем не менее в 1-й группе показатели микробной нагрузки тканей Пр (1А, 1В) на данных сроках продолжали нарастать и изменялись синхронно с увеличением тяжести поражений; в 3-й группе, напротив, несмотря на нарастание деструктивных изменений, показатели обсемененности Пр постепенно снижались (1А)/оставались неизменными (1В). Таким образом, в 3-й группе, в отличие от 1-й, не установлено взаимосвязи между обсемененностью и степенью воспалительных поражений в Пр.
- 2-я группа: уже с 1-х суток отмечена значительно более интенсивная суммарная степень деструктивных поражений по номинальной шкале относительно таковых в 1-й и 3-й группах. Выраженность патоморфологических изменений нарастала к 3-м суткам и оставалась на таком уровне до 7-х суток, а к 14-м значительно регрессировала до минимальных значений. Тем не менее сопоставление формы трендов, характеризующих тканевые поражения и обсемененность, выявило абсолютное несоответствие кривых графических тенденций: при нарастании воспаления (3-и и 7-е сутки) снижались показатели микробной нагрузки тканей (1А, 1В) и, напротив, к конечному сроку наблюдения отмечалось разрешение островоспалительных изменений в тканях при увеличении обсемененности тканей Пр.
По итогам работы следует выделить несколько ключевых моментов:
1) только при минимальной инфицирующей дозе (103 КОЕ/мл) отмечено синхронное нарастание деструктивных изменений по мере увеличения обсемененности;
2) наличие сопоставимых по тяжести деструктивных изменений в Пр в 1-й и 3-й группах при условии 4-степенной разницы в первоначальной инфицирующей концентрации уропатогена (103 против 107 КОЕ/мл соответственно);
3) несмотря на то что максимальные суммарные и медианные показатели обсемененности зафиксированы в 1-й группе, наиболее значительные патоморфологические изменения в Пр определены во 2-й группе при более низких показателях суммарной микробной нагрузки;
4) отмечены различия в реактивности изменений в пораженных тканях: в 1-й и 3-й группах определена торпидная реакция, характеризующаяся формированием умеренных островоспалительных поражений в ответ на внедрение уропатогена на 1-е сутки со значительным повышением к 3-м суткам и рапидная – во 2-й группе, сопровождавшаяся развитием активного воспалительного деструктивного процесса уже с 1-х суток эксперимента.
Схожие данные приводят J. C. Nickel et al. [11] при оценке результатов собственного изучения бактериального простатита на крысах Sprague-Dawley. Авторы установили, что у всех особей в группе наблюдения на 3-и сутки после инокуляции E. coli K-235 (108 КОЕ/мл) в тканях Пр верифицирован альтерирующий агент в различных концентрациях и деструктивные изменения, характерные для простатита категории I. Через 7 нед. примерно в 50% наблюдений в группе сравнения из биоптатов Пр уропатоген не был выделен, а в тканях Пр не зафиксировано изменений, характерных для простатита категории II [11]. Позднее Y. S. Lee et al. [12] привели данные, свидетельствовавшие, что через 4 нед. после инфицирования крыс Wistar штаммом E. coli Z17 (108 КОЕ/мл) у 58,6% животных рост тестируемого уропатогена в ткани Пр при бактериологическом исследовании отсутствовал, а в микропрепаратах при патоморфологическом исследовании активные фокусы/поствоспалительные патогистологические изменения, характерные для деструктивного поражения Пр, не зафиксированы.
Объединив вышепредставленные данные, можно заключить: степень патоморфологических изменений не зависит от изначальной величины инокулируемого титра. Тем не менее нельзя с уверенностью утверждать, что тяжесть деструктивного поражения напрямую определяется уровнем накопления микробной массы в поражаемом органе. Следует также учесть несколько факторов, которые могут оказывать существенное влияние на вариабельный характер течения воспалительного процесса, а именно: индивидуальные особенности реактивности иммунной системы каждой особи, антагонистические взаимодействия уропатогенной и резидуальной микрофлоры, антибактериальные (бактериостатические) свойства секрета простаты.
Заключение. Результаты исследования позволяют предположить, что данные изучения биоматериала пациентов с простатитоподобными симптомами не всегда в полной мере отражают тяжесть воспалительных поражений в ткани простаты при бактериальной инвазии. Нами показано, что при низких инфицирующих титрах в предстательной железе формируются очаги, по степени и тяжести деструктивных изменений сопоставимые с таковыми при введении более высокой патогенной дозы альтерирующего агента. Высокий титр уропатогена не всегда приводит к значительному накоплению бактериальной массы в тканях, что в свою очередь может влиять на показатели обсемененности секрета простаты при его бактериологическом исследовании, тем не менее обусловливает появление воспалительного поражения ткани простаты.
Следует учесть, что экстраполирование результатов данного исследования на человека не может являться абсолютно доказанным. Трансляция соответствующих данных требует дальнейшего углубленного изучения с применением иммунологических и иммуногистохимических методик.



