Доброкачественная гиперплазия предстательной железы (ДГПЖ) – это широко распространенное социально значимое заболевание, прогрессирующее с возрастом. Данным заболеванием страдают около 50% мужчин в возрасте 60 лет и почти 90% в возрасте 85 лет. Около 30% пациентов переносят тот или иной вид оперативного лечения по поводу данного заболевания, а риск развития острой задержки мочи с достижением 70 лет увеличивается в 5 раз [1, 2].
Основным методом лечения симптомов нижних мочевыводящих путей (СНМП), обусловленных ДГПЖ, является медикаментозная терапия препаратами групп альфа-адреноблокаторов, ингибиторов 5α-редуктазы и др. При неэффективности медикаментозной терапии пациенту показано оперативное лечение.
«Золотым» стандартом оперативного лечения ДГПЖ является трансуретральная резекция простаты (ТУРП). Доля осложнений после ТУРП составляет 11,1% и увеличивается с объемом предстательной железы [3]. Выполнение ТУРП требует проведения пациенту анестезиологического пособия, что делает методику неприменимой в отношении пациентов с отягощенным соматическим статусом. Применение прочих эндоскопических, открытых и лапароскопических методов оперативного лечения ДГПЖ также связано с аналогичными ограничениями.
Все вышеперечисленное делает особенно актуальным использование минимально инвазивных хирургических методов (МИХМ) лечения ДГПЖ. Одним из таких методов является суперселективная эмболизация артерий предстательной железы (эмболизация простатических артерий; ЭПА). Суть метода заключается в выполнении под рентгеноскопическим контролем суперселективной катетеризации ветвей простатических артерий и таргетной доставки эмболизационного препарата в сосудистую сеть простаты до достижения полной остановки кровотока. Лечебный эффект в данном случае достигается за счет асептического некроза ткани простаты и уменьшения объема предстательной железы.
Введение. Применение ЭПА в клинической практике.
В 2000 г. J. S. DeMeritt et al. [4] выполнили эмболизацию правой нижней пузырной артерии 76-летнему мужчине с неразрешимой макрогематурией, обусловленной ДГПЖ. Была выполнена транскатетерная артериальная эмболизация правой нижней пузырной артерии с использованием поливинилалкоголя до полной деваскуляризации предстательной железы. По результатам 12-месячного наблюдения отмечено, что суммарный балл по шкале IPSS снизился с 24 до 13, а объем простаты уменьшился на 40% – с 305 до 190 см3.
Первые в России результаты клинического применения ЭПА при ДГПЖ были представлены А. И. Неймарком и соавт. в 2009 г. За период с 2004 по 2009 г. ЭПА была проведена 38 пациентам с ДГПЖ и тяжелыми сопутствовавшими заболеваниями, не позволившими проводить традиционное оперативное лечение. Эмболизация была успешно выполнена всем 38 пациентам, у них улучшилось качество мочеиспускания, уменьшился объем простаты, 4 пациента были избавлены от цистостомического дренажа [5].
В работе Carnevale et al. двум пациентам была выполнена ЭПА с использованием микросфер 300–500 µm. Спустя 6 мес. в обоих наблюдениях констатировали уменьшение степени инфравезикальной обструкции, уменьшение объема простаты и объема остаточной мочи. Позже, в 2011 г., те же авторы предоставили среднесрочные результаты лечения тех же пациентов: объем простаты не увеличился, а качество мочеиспускания через 30 мес. наблюдения оказалось аналогичным значению 6-месячного показателя [6, 7].
В 2011 г. J. M. Pisco et al. опубликовали результаты исследования, в котором оценивалась эффективность ЭПА у больных с СНМП, обусловленными ДГПЖ. Процедура была технически успешной для 14 из 15 пациентов, при этом значительно снизилась балльная оценка по шкале IPSS, улучшилось качество жизни, увеличилась пиковая скорость мочеиспускания и уменьшился объем предстательной железы. При увеличении наблюдаемой группы до 104 человек было подтверждено значительное снижение обструктивной и ирритативной симптоматики [8, 9].
В 2011 г. Д. Г. Курбатов на съезде Американской урологической ассоциации (AUA) первым из России представил доклад о совместных с А. И. Неймарком и соавт. межцентровых результатах выполнения ЭПА в лечении ДГПЖ больших объемов. Затем в 2013, 2014, 2018 гг. Д. Г. Курбатов и соавт. опубликовали суммарные данные лечения 106 пациентов с объемом простаты более 80 см3 [10–14].
В 2015 г. А. И. Неймарк и соавт. сообщили о результатах выполнения ЭПА с 2004 по 2014 г. 59 пациентам с ДГПЖ, средний возраст которых составил 68,2±6,2 года, а объем простаты варьировался от 35 до 296 см3. После эмболизации статистически значимо уменьшилась выраженность симптомов по шкале IPSS, увеличился показатель максимальной скорости потока мочи (Qmax), объем простаты в среднем уменьшился на 53% (p<0,01), объем узлового образования на 47% (p<0,01) [15, 16].
В исследовании F. C. Carnevale et al. трем группам пациентов выполнялись соответственно ТУРП, классическая ЭПА и эмболизация простаты по усовершенствованной технологии – PErFecTED (Proximal Embolization First Then Embolize Distal); продемонстрировано существенное преимущество последней перед ТУРП при оценке выраженности СНМП по шкале IPSS через 12 мес. наблюдения: 3,6±2,9 в группе PErFecTED-эмболизации против 6,1±8,6 у пациентов, которым была выполнена ТУРП. У пациентов после ЭПА и PErFecTED-эмболизации не встречались осложнения, которые были при ТУРП (недержание мочи [26,7%], разрыв простатической капсулы [6,7%], ретроградная эякуляция [100%], повторная госпитализация в связи с гематурией). [17, 18].
Совокупный опыт исследовательских групп МНОЦ МГУ им. М. В. Ломоносова, кафедры урологии и андрологии ФФМ МГУ им. М. В. Ломоносова, НИИ клинической хирургии РНИМУ им. Н. И. Пирогова, кафедры урологии и андрологии с курсом специализированной хирургии АГМУ, Барнаул, отделения андрологии и урологии ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава РФ на сегодняшний день составляет более 1000 выполненных оперативных вмешательств [19–21].
ЭПА является методом с доказанной эффективностью и с 2019 г. включена в клинические рекомендации Минздрава РФ по лечению ДГПЖ.
Материалы и методы. Сотрудниками МНОЦ МГУ им. М. В. Ломоносова и кафедры урологии и андрологии МГУ им. М. В. Ломоносова совместно с НИИ клинической хирургии РНИМУ им. Н. И. Пирогова суперселективная эмболизация артерий предстательной железы выполняется с 2013 г.
В настоящее исследование вошли 168 пациентов, пролеченных методом ЭПА с 2013 по 2020 г. Средний возраст пациентов составил 69,3±8,1 года, а средний объем простаты был равен 98±21,2 см3. У 27 пациентов отведение мочи осуществлено посредством цистостомического дренажа. Наблюдение проводилось в течение 24 мес., контрольные осмотры – через 3, 6, 12 и 24 мес. после ЭПА. Алгоритм предоперационного обследования и дальнейшего контроля включал определение объема простаты путем выполнения ТРУЗИ или МРТ, объема остаточной мочи с помощью УЗИ, определение уровня ПСА крови, урофлоуметрию, определение степени выраженности СНМП с помощью опросников IPSS и IPSS-QoL.
Основным показанием стали невозможность выполнения оперативного лечения в связи с высоким анестезиологическим риском, отягощенный соматический статус, невозможность выполнения открытого или эндоскопического лечения. При определении тактики лечения учитывалось также желание пациента избежать открытого или трансуретрального вмешательства и сохранить антеградную эякуляцию. Критериями включения в данное исследование были объем простаты более 60 см3, отсутствие эффекта от консервативной терапии в течение 6 мес., значение индексов по шкале IPSS >18 баллов и по шкале IPSS-QoL >3 баллов, Qmax <13 мл/с, острая или хроническая задержка мочи в анамнезе, наличие цистостомы, возраст более 65 лет. Противопоказания к применению ЭПА: лекарственная непереносимость рентгенконтрастного препарата, а также выраженный атеросклероз и сосудистые аномалии развития в области бифуркации аорты, наружной и внутренней подвздошных артерий.
Все операции выполнены одной опытной хирургической бригадой. Во всех случаях был использован трансфеморальный доступ. Все операции выполнены на рентгеноскопической установке Toshiba MS INFINIX VC-i. Для эмболизации использовались микропроводники диаметром 4–5 Fr и микрокатетеры диаметром 2–2,8 Fr. В качестве эмболизационного материала использовались гидрогелевые микро-сферы диаметром 100–300 и 300–500 µm, а также микрочастицы PVA диаметром от 100 до 500 µm.
Для статистической обработки результатов использовалась программная среда IBM SPSS Statistics. 23.
Результаты. Билатеральная эмболизация простатических артерий успешно выполнена 146 пациентам, 22 больным была выполнена унилатеральная ЭПА в связи с анатомическими особенностями. К 149 пациентам применен односторонний трансфеморальный доступ, 19 больным потребовалась пункция контрлатеральной бедренной артерии в связи с техническими трудностями. На ранних этапах исследования пациентам выполнялась селективная эмболизация простатических артерий без суперселективной катетеризации капсулярных и стромальных ветвей простатической артерии; данная техника была применена к 17 (10,1%) больным, классическая суперселективная ЭПА выполнена 67 (39.9%), PErFecTED-эмболизация была успешно выполнена 84 (50%) пациентам. В ходе 24-месячного контроля у наблюдаемых пациентов была отмечена выраженная положительная динамика по сравнению с исходными результатами по показателям IPSS, максимальной скорости мочеиспускания, объема остаточной мочи, объема простаты и ПСА (табл 1.)

Техника PErFecTED была предпочтительной к использованию во всех наблюдениях после 2014 г., однако ее применение не всегда было возможным в связи с особенностями ангиоархитектоники простатической артерии [22]. В рамках исследования проведен сравнительный анализ PErFecTED и классической ЭПА. При отборе пациентов из контрольных групп были исключены пациенты, с выполненной селективной эмболизацией простатической артерии без суперселективной катетеризации капсулярных и стромальных ветвей, пациенты с цистостомами, а также пациенты после унилатеральной ЭПА. При сравнительном анализе клинической эффективности классической ЭПА и PErFecTED выявлена большая эффективность последней в клинических группах в 46 и 56 человек соответственно (табл. 2).

В рамках исследования дополнительно изучался вопрос выбора оптимального эмболизационного препарата для достижения максимальной эффективности суперселективной эмболизации простаты и снижения частоты развития осложнений. Для выполнения ЭПА нами использовались гидрогелевые микросферы диаметром 100–300 и 300–500 µm, а также микрочастицы PVA диаметром от 100 до 500 µm. Для анализа отобраны пациенты после классической суперселективной эмболизации простатических артерий. При отборе пациентов контрольных групп были исключены пациенты после селективной эмболизации простатической артерии без суперселективной катетеризации капсулярных и стромальных ветвей, пациенты с цистостомами, пациенты после унилатеральной ЭПА, а также пациенты, которым была выполнена PErFecTED-ЭПА. В сформированные контрольные группы вошли 29 пациентов, для которых использовались гидрогелевые микросферы диаметром 100–300/300–500 µm, и 38 пациентов, к которым в качестве эмболизационного препарата применялись микрочастицы PVA диаметром от 100 до 500 µm.
Полученные результаты свидетельствуют о сопоставимости показателей клинической эффективности применения обоих видов эмболизационного препарата с небольшим преимуществом микросферического эмболизата (табл. 3).
При анализе структуры ранних послеоперационных осложнений отмечено, что в группе пациентов, которым выполнялась эмболизация микрочастицами PVA, осложнения, связанные с непреднамеренной эмболизацией анастомозов простатической артерии, встречались чаще (см. рисунок). По нашему мнению, это связано с частым применением в качестве эмболизационного препарата микрочастиц PVA небольшого диаметра – 100 и 200 µm, что подтверждается данными других исследований [23].
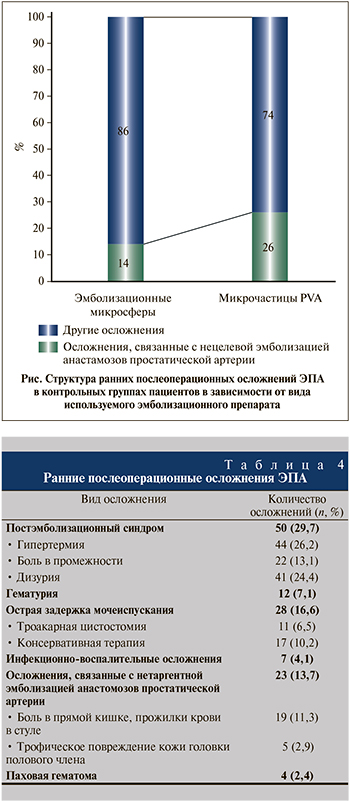
Осложнений суперселективной эмболизации простатических артерий выше II степени по классификации Clavien–Dindo не было отмечено ни у одного пациента. Все выявленные за период наблюдения осложнения были полностью купированы консервативной терапией и не потребовали активной хирургической тактики. К наиболее частым осложнениям ЭПА в раннем послеоперационном периоде отнесены постэмболизационный синдром (субфебрилитет, дизурия, боль в промежности) – был отмечен у 50 пациентов, а также острая задержка мочеиспускания (ОЗМ) – у 28 пациентов.
В раннем послеоперационном периоде у 4 больных была выявлена паховая гематома в месте пункции бедренной артерии. Кроме того, отмечено ограниченное количество осложнений, ассоциированных с непреднамеренной эмболизацией анастомозов простатической артерии (табл. 4).
В 6 случаях у пациентов с симптомами нижних мочевыводящих путей, обусловленными ДГПЖ, после билатеральной и унилатеральной ЭПА удовлетворительного клинического результата получено не было, что, вероятнее всего, связано с массой коллатералей простатической артерии с другими артериями малого таза. Среди больных с цистостомическим дренажем адекватное восстановление самостоятельного мочеиспускания зафиксировано у 23 больных, от 4 пациентов клинический эффект достигнут не был.
Заключение. Данные нашего исследования, а также международный опыт свидетельствуют: суперселективная эмболизация простатических артерий – это эффективный и безопасный метод малоинвазивного лечения ДГПЖ. PErFecTED-эмболизация является более эффективным методом по сравнению с классической ЭПА. Вопрос выбора оптимального эмболизационного препарата продолжает сохранять свою актуальность. Клиническая эффективность суперселективной эмболизации простатических артерий в лечении ДГПЖ составила 94,04%. Считаем ЭПА наиболее предпочтительным методом оперативного лечения для пациентов пожилого возраста с отягощенным соматическим статусом и методом выбора для пациентов высокого анестезиологического риска.



