Введение. Острое почечное повреждение является широко распространенным опасным для жизни состоянием и остается серьезной проблемой здравоохранения с высоким уровнем смертности пациентов. Острое почечное повреждение встречается у 1 из 5 госпитализированных пациентов [1]. У пациентов, перенесших острое почечное повреждение, достоверно повышен относительный риск развития хронической болезни почек и терминальной почечной недостаточности, формирования острого ренокардиального синдрома, увеличение заболеваемости и смертности от кардиоваскулярной патологии [2].
Одну из главенствующих позиций среди этиологических факторов острого почечного повреждения занимает удлинение временного интервала интраоперационного пережатия почечных артерий при урологических операциях на паренхиме почек. Решением данной проблемы может выступать фармакологическое прекондиционирование, которое позволит, во-первых, увеличить допустимый период ишемии, во-вторых, будет способствовать снижению частоты постоперационных осложнений, как следствие – уменьшению риска формирования острого почечного повреждения [3, 4].
Как правило, ишемическое повреждение почек происходит неравномерно, преимущественно в корковом слое. При переходе на анаэробный гликолиз, снижении продукции АТФ и внутриклеточного pH с дальнейшей перегрузкой клеток кальцием, генерацией активных форм кислорода и апоптоза в большей степени повреждаются эпителиальные клетки проксимальных канальцев. Данные изменения в свою очередь провоцируют активацию ренин-ангиотензин-альдостероновой системы, как результат – снижение скорости клубочковой фильтрации (СКФ) [5]. Таким образом, в патогенезе острого почечного повреждения первична дисфункция эпителиальных клеток канальцев, которая приводит к нарушению фильтрационной функции почек.
Ранее были исследованы эффекты фармакологического прекондиционирования эритропоэтином при ишемии почек и выявлено его выраженное цитопротективное действие. Однако применение его в максимальной дозе для достижения лучшего эффекта было ограничено развитием нежелательного явления, а именно стимулирования эритропоэза [6]. Для предупреждения данного нежелательного явления перспективным представляется использование модифицированных форм эритропоэтина, оказывающих цитопротективное действие и вызывающих минимальное число нежелательных эффектов. Одной из таких модификаций является карбамилированный дарбэпоэтин, характеризующийся выраженным прекондиционирующим эффектом и низким риском эритроцитоза [7]. Также для увеличения антиишемического эффекта в эксперименте перспективна возможность использования модифицированных форм эритропоэтина в комбинации с L-этоксидолом, который обладает антиишемическими свойствами поскольку является антиоксидантом и участником малатного звена цикла Кребса [8].
Цель работы: установить эффективность эритропоэтина и карбамилированного дарбэпоэтина в разных дозах, экспериментально обосновать возможность повышения лечебных свойств карбамилированного дарбэпоэтина при одновременном применении левовращающего стереоизомера этоксидола.
Материалы и методы. В качестве тест-системы использованы половозрелые мыши-самцы. Животных содержали в стандартных условиях вивария в системе индивидуально вентилируемых клеток «Tecniplast» при автоматически контролируемых температуре и влажности при циркадном 12-часовом режиме освещения день/ночь. Содержание животных и экспериментальные манипуляции отвечали международным рекомендациям Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (1986), а также правилам лабораторной практики при проведении доклинических исследований в РФ в соответствии с Принципами надлежащей лабораторной практики [9–12] и приказа Министерства здравоохранения «Об утверждении правил надлежащей лабораторной практики» № 199н от 01.04. 2016.
Перед экспериментом самцы мышей линии CD-1 методом рандомизации разделили на 9 групп по 10–15 голов (табл. 1). Статистически значимые выбросы в измеряемых параметрах оценивались по критерию Шовене, определялись как критерий исключения [13], подвергались статистическому триммингу и выводились из эксперимента эвтаназией в углекислотной камере. Эти исключенные из эксперимента животные заменялись повторными опытами – так, что общее количество животных, включенных в выборку группы, было равно 10. В эксперименте исследовались L-этоксидол (Letox) – субстанция левовращающего энантиомера этилметилгидроксипиридина малата (ВНЦ БАВ, г. Старая Купавна); карбамилированный дарбэпоэтин (CDEPO) (ООО «ФАРМСТАНДАРТ»); препарат сравнения эритропоэтин альфа – EPO («Эпокрин», ФГУП «Гос.НИИ ОЧБ» ФМБА России) в субэритропоэтической (50 МЕ/кг) и эритропоэтической (500 МЕ/кг) дозах [14]. Производные эритропоэтина вводили трижды с интервалом в 2 дня, за 7 дней до моделирования ишемического состояния [15]. При выборе доз эритропоэтинов основывались на данных, представленных в [15–18]. Letox вводили за 30 мин до операции и через 12 ч после нее (T1/2 8 ч) [19]. В исследование использованы позитивный контроль – мыши после односторонней нефрэктомии без лечения, и негативный контроль – мыши с односторонней нефрэктомией без лечения, у которых моделировалась 30-минутная ишемия. Распределение животных по группам и режим дозирования исследуемых веществ обобщены в таблице.
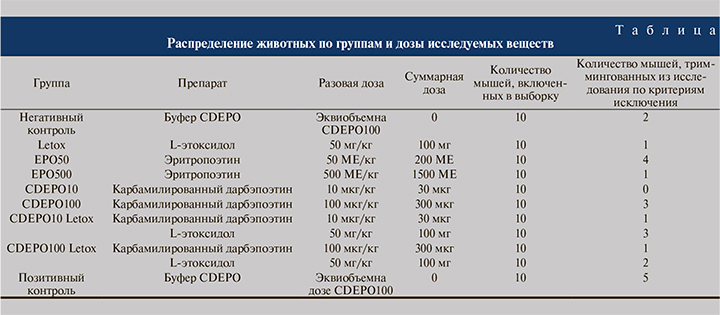
Ишемия почки была воспроизведена по методике [20].
Животных наркотизировали внутрибрюшинным введением золетила (50 мг/кг) и ксилазина (20 мг/кг). Сразу после введения в наркоз осуществляли забор крови (контрольные значения уровня креатинина) из ретроорбитального синуса в количестве 150 мкл (рис. 1a). Мышь фиксировали клейкой лентой к операционной доске (рис. 1b). Хирургические манипуляции выполняли под препаративным микроскопом. Проводили срединную послойную лапаротомию, что открывало доступ сразу к обеим почкам (рис. 1c).
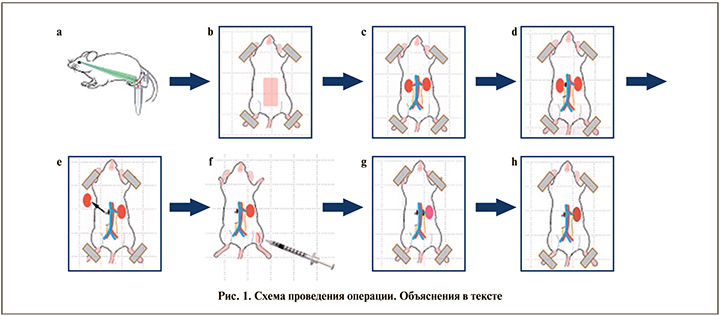
На правый мочеточник, почечную артерию и вену накладывали лигатуры, почку резецировали (рис. 1d, 1e). После этого в бедренную вену вводили препарат (рис. 1f). Далее на левую почечную артерию и вену накладывали клипсу на 30 мин (рис. 1g). Успешность ишемии подтверждалась постепенным равномерным потемнением почки (рис. 1h). Каждое животное помещали в индивидуальную метаболическую клетку для сбора мочи. Через 24 ч у животных интраоперационно измеряли уровень микроциркуляции в единственной почке и брали кровь из правого желудочка сердца для определения уровня креатинина в плазме. Скорость клубочковой фильтрации рассчитывали по формуле:

Уровень микроциркуляции измеряли в перфузионных единицах (ПЕ) и осуществляли с помощью аппаратно-программного комплекса MP100 (Biopac System, Inc., США) с модулем лазерной допплеровской флоуметрии LDF100C и поверхностного датчика TSD143. Регистрацию и обработку результатов проводили с помощью программного обеспечения AcqKnowledge версии 4.2.
Статистический анализ. Расчет среднего арифметического (M) и 95% доверительный интервал (CI) проводили в программе MS Excel 2016. Распределение значений показателей оценивали по критериям Шапиро–Уилка и Колмогорова–Смирнова. Межгрупповое сравнение проводили с помощью критерия Манна–Уитни, а для сравнения нескольких выборок использовали критерий Краскела–Уоллиса. Для сравнения повторяющихся измерений применяли дисперсионный анализ. Различия были определены при 0,05-ном уровне значимости в программе GraphPadPrism 5.0. Для удобства графического отображения результатов использована комбинированная гистограмма, на которой планками погрешностей отложены среднее арифметическое значение (M) и его 95% CI, а их цифровые значения (M±CI) дополнительно продублированы в столбцах.
Результаты. Односторонняя нефрэктомия характеризуется повышением функциональной нагрузки на оставшуюся почку, что выражалось в высоких значениях параметров микроциркуляции (1415±184 ПЕ) и СКФ (0,77±0,03 мл/мин) и совпадало с данными литературы [24]. Полученные значения не противоречат литературным данным и свидетельствуют об успешности ее воспроизведения [21–24]. Примечательно, что показатели СКФ, измеренные сразу после моделирования ишемии, не имели диагностической ценности из-за высокой статистической дисперсии величин, в связи с этим не были представлены. Микроциркуляция в единственной почке и СКФ через 24 ч после 30-минутной ишемии была снижена более чем в 2 раза относительно средних значений (р<0,05 при сравнении показателей групп позитивного и негативного контроля; рис. 2).

Препарат сравнения EPO оказывал нефропротекторное действие в субэритропоэтической (50 МЕ/кг) и эритропоэтической (500 мг/кг) дозах, что проявлялось в более благоприятных значениях параметров микроциркуляции и СКФ (р<0,05 при сравнении с группой негативного контроля, рис. 2). Стоит отметить, что выявлен дозозависимый эффект, что проявлялось в значимых отличиях СКФ и микроциркуляции (р<0,05 при сравнении групп EPO50 и групп EPO500, рис. 3).
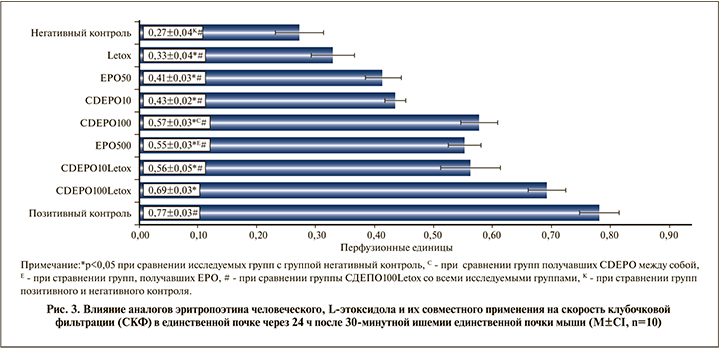
Исследование аналога эритропоэтина CDEPO свидетельствует об аналогичной препарату сравнения дозозависимой нефропротективной эффективности (р<0,05 при сравнении групп негативного контроля, CDEPO10 и CDEPO100; см. рис. 3). Введение L-этоксидола защищало единственную почку от ишемии только по параметру микроциркуляции (р<0,05) при сравнении с показателем группы негативного контроля (рис. 3), но не обеспечивало сохранение скорости клубочковой фильтрации (p>0,05) при сравнении с группой негативного контроля (рис. 3). Совместное применение CDEPO в низкой дозе и Letox выявило определенное синергическое фармакологическое действие, что проявлялось в более благоприятных значениях параметров микроциркуляции и СКФ (p<0,05) при сравнении с группами CDEPO10, Letox, негативного контроля (рис. 2 и рис. 3). При совместном назначении высоких доз CDEPO в высокой дозе и Letox эффект препаратов по изучаемым параметрам оказался наиболее выраженным (p<0,05) при сравнении со всеми исследуемыми группами лечебного воздействия), однако обеспечил полную защиту единственной почки от ишемически- реперфузионного воздействия в данной модели (p>0,05) при сравнении с группой позитивного контроля (рис. 2 и рис. 3).
Заключение. Выбранная модель ишемии единственной почки имеет преимущество перед ишемией двух почек в сокращении широких границ физиологической нормы в 2 раза, в связи с чем оставшаяся почка становится уязвимой к патологии [20–24]. Такая уязвимость увеличивает терапевтическое окно для нефропротективных агентов, обеспечивая преимущество в возможностях ранжирования веществ по степени фармакологической эффективности. L-этоксидол продемонстрировал недостаточную фармакологическую эффективность в данной модели, но достаточное влияние, обеспечившее значимое увеличения эффективности разных доз негемопоэтического аналога эритропоэтина человеческого. Выявленное явление синергизма L-этоксидола и разных доз карбамилированного дарбэпоэтина трудно объяснить суммацией или аддицией ввиду близких цифровых значений, что требует дополнительных целевых исследований. Предположительный синергизм достигается за счет воздействия на различные структуры и компоненты клетки. Ишемия–реперфузия после односторонней нефрэктомии позволила раскрыть нефропротективный потенциал субэритропоэтической и эритропоэтической доз эритропоэтина [20], статистически (p<0,05) сопоставимый с дозозависимой эффективностью карбамилированного дарбэпоэтина. Приемлемым терапевтическим эффектом обладают высокие дозы предварительно введенного эритропоэтина, однако побочное гемопоэтическое действие существенно ограничивает его применение в клинической практике. Выходом может быть применение карбамилированного дарбэпоэтина, оказывающего сопоставимое фармакологическое действие, но лишенного нежелательного побочного гемопоэтического эффекта. Примечательно, что фармакотерапевтический потенциал карбамилированного дарбэпоэтина может быть увеличен применением препаратов из других групп, что подтверждено выявленным синергизмом при совместном применении с L-этоксидолом.
Таким образом, экспериментально обоснована целесообразность профилактики ишемически-реперфузионных повреждений почек аналогами эритропоэтина человеческого и их комбинации с производными этилметилгидроксипиридина.



