Введение. Почечнокаменная болезнь (ПКБ) – одно из самых распространенных заболеваний в мире, его встречаемость в США за последние 30 лет увеличилась в 2 раза, а распространенность среди населения, согласно данным исследования National Health and Nutrition Examination Survey, с 2007 по 2010 г. составила 8,8% [1]. По данным Минздрава России, в РФ ежегодный прирост заболеваемости ПКБ составляет 3%. Данное заболевание наравне с ожирением и сахарным диабетом 2 типа (СД2) можно назвать неинфекционной пандемией XXI в.
Основным проявлением ПКБ является образование свободных или закрепленных камней в почечных чашечках и лоханке, что следует дифференцировать с диффузным кальцинозом почечной паренхимы, именуемым нефрокальцинозом [2]. Выделяют несколько видов камней в зависимости от их химической структуры (рис. 1). Самая большая группа – это камни на основе фосфата и оксалата кальция, на них приходится около 70–80%; далее следуют струвитные/инфекционные (фосфаты магния и аммония) камни, составляющие 10–15%; на конкременты из мочевой кислоты (МК) также приходится 10–15%, на цистиновые камни и камни, сформированные на фоне приема лекарственных препаратов (триамтерен, индинавир, ингибиторы ксантиноксидазы, например аллопуринол, и др.), – около 2% [3].
Актуальность исследования ПКБ за последние два десятилетия неуклонно растет. В первую очередь это связано с обнаружением связи между метаболическим синдромом (МС) и ПКБ. Так, пациенты, страдающие 3 и более компонентами МС, имеют более высокие шансы образования камней в почках [4]. Прежде всего речь идет о камнях на основе МК, именно они ассоциированы с ожирением и СД2, а сам уровень МК может повышаться при употреблении фруктозы [5]. Данный процесс обусловлен высокой энергозатратностью метаболизма фруктозы, что требует большого запаса АТФ, сопровождающегося накоплением МК [6, 7]. Мы предполагаем, что это явление лежит в основе накопления МК у Homo Sapiens, что служит фактором, напрямую повышающим риск формирования камней на основе МК, особенно с учетом воздействия внешних факторов, стремительно меняющихся в последние несколько десятилетий. Чтобы эта информация стала более понятной и применимой на практике, необходимо детально разобрать метаболизм МК.

1. Физиологические аспекты развития ПКБ
1.1. Метаболизм МК
Мочевая кислота – это конечный продукт пуринового обмена у человека и высших приматов, который выводится вместе с мочой. Подавляющее большинство других млекопитающих обладает ферментом уриказой (уратоксидаза – медьсодержащий фермент из класса оксидоредуктаз, выступающих катализатором окисления МК до аллантоина при распаде пуриновых оснований у животных), который у человека и человекообразных обезьян отсутствует вследствие некоторых мутаций, что обусловливает повышенный базальный уровень МК у человека по сравнению с другими видами млекопитающих [8]. Мочевая кислота одновременно может являться как индуктором образования активных форм кислорода, в частности, при неалкогольной жировой болезни печени, так и антиоксидантом, обеспечивая более половины всей антиоксидантной емкости крови, что также связано с ее повышенным уровнем у человека [9].
1.2. Механизм образования камней
Механизм образования камней на основе МК определяется тремя ключевыми элементами: физико-химическими свойствами МК, кислотно-основным равновесием мочи и нутриентным статусом. Последние два элемента модифицируемы, и поддержание их гомеостаза лежит в основе предупреждения развития ПКБ.
1.2.1. Физико-химические свойства МК
Мочевая кислота является конечным продуктом распада пуриновых нуклеотидов, слабой кислотой, ее pKa (константа кислотности – количественная мера силы кислоты в растворе) при 37°C составляет 5,8.
Определяющее значение для диссоциации кислоты в данном случае играет pH (крови, мочи, спинномозговой жидкости) – величина, способная меняться даже в зависимости от количества выпитой жидкости и употребляемой пищи, небольшие же колебания считаются нормой и есть у всех людей. Это информация к вопросу о необходимости употребления воды, даже в отсутствие жажды. Опасны периоды длительного смещения pH в кислую сторону, например, при продолжительной диарее, сопровождающейся потерей бикарбоната. Так, наиболее неблагоприятное влияние оказывает моча с pH ≤5,5: она является чрезмерно кислой, что способствует протонированию МК (протонирование – это добавление протона (H+) к атому, молекуле или иону). При нормальном значении рН жидкостей МК может быть представлена еще и в форме своей мононатриевой соли – урата натрия. При значении рН >5,75 преобладает натриевая соль МК. Протонированная МК плохо растворима, что само по себе способствует образованию преципитатов и камней на основе МК, однако это же служит фактором риска образования смешанных камней с участием фосфатов и оксалатов, следствием чего может стать развитие ПКБ [10–12] (рис. 2). Иными словами, меняется понимание патогенетического вклада МК в формирование разных видов камней. И тот факт, что образование фосфатных или оксалатных камней происходит с большей вероятностью при повышенном уровне МК, повышает ее значимость в патогенезе ПКБ.
1.2.2. Кислотно-основное равновесие
Как было показано выше, pH мочи – довольно вариабельная величина. Она служит численной мерой кислотно-основного равновесия. Чтобы колебания pH мочи не выходили за границы оптимальных значений, существуют буферные системы, самой важной из которых является аммониевая. Выделяют два места, где NH4+ (NH4+ – устойчивый, положительно заряженный ион аммония) выделяется в просвет нефрона: проксимальный каналец и медуллярную собирательную трубочку [13]. Выделение NH4+ происходит при участии специального транспортера Na+/H+-антипортера 3 [sodium–hydrogenantiporter/exchanger 3, NHE3]. NHE – это группа мембранных белков, основная функция которых заключается в осуществлении трансмембранного обмена избыточного внутриклеточного Н+ на внеклеточный Nа+, что эффективно предотвращает накопление избытка кислот в клетках с высокой метаболической активностью. Кроме того, Na+/H+-антипортер способствует поддержанию клеточной формы и объема клетки. Активация данного антипортера обусловлена влиянием фермента протеинкиназы C (proteinkinase C, PKC), а ингибирование происходит под воздействием протеинкиназы A (proteinkinase A, PKA) [14, 15]. Проявлением нарушения работы данного антипортера является уменьшение буферной емкости мочи, что приводит к смещению баланса в кислую строну, т.е. к уменьшению pH мочи.
Непосредственным стимулятором Na+/H+-антипортера-3 является инсулин, и, как и во всем организме, проблема инсулинорезистентности актуальна и здесь [16]. Она как один из компонентов МС в данном случае служит прямой причиной снижения экскреции ионов NH4+.
 1.2.3. Нутриентный статус
1.2.3. Нутриентный статус
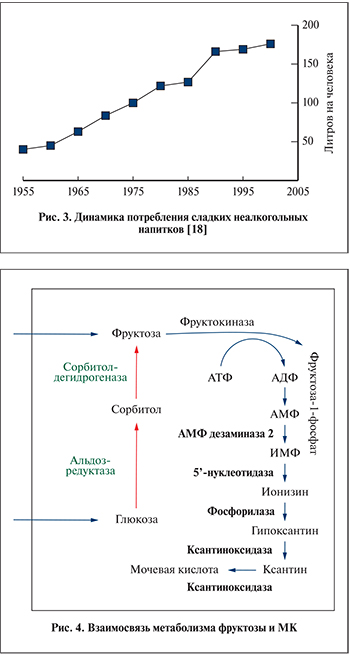
За последние 3–4 десятилетия произошло очень сильное изменение пищевого поведения человека. Масса белка, употребляемого ежедневно, упала, а доля «быстрых» углеводов выросла, увеличив суточный калораж. Продукты с быстрыми углеводами в первую очередь изготовлены из глюкозно-фруктозного сиропа, крайне активное использование которого в пищевой промышленности обусловлено дешевизной его производства из кукурузы. Наиболее часто данный сироп добавляется в сладкие газированные напитки и кондитерские изделия. За счет этого употребление фруктозы в последние 40 лет выросло на 30% [17] (рис. 3).
Помимо этого идет автоматизация разных процессов как бытового, так и производственного уровня, служащая причиной уменьшения физической активности человека. Гиподинамия и повышенный калораж являются факторами риска накопления избыточного жира и развития МС впоследствии за счет изменения энергетического баланса в пользу избыточно поступающих энергетических ресурсов.
2. Взаимосвязь фруктозы и МК
Поступающая вместе с пищей фруктоза может существовать в трех видах: полисахарида (фруктан), дисахарида (сахароза: глюкоза и фруктоза) и моносахарида (свободная фруктоза). Свободная фруктоза из просвета кишечника переносится в кровь благодаря транспортерам ГЛЮТ-5 (глюкозный транспортер, тип 5) и ГЛЮТ-2 (глюкозный транспортер, тип 2), расположенным на апикальной и базолатеральной сторонах энтероцитов соответственно [19]. Другие формы предварительно подвергаются расщеплению в просвете кишечника до моносахаридов. Дальнейшее поглощение фруктозы из системы воротной вены в основном определяется транспортером ГЛЮТ-2, экспрессия которого наиболее выражена на гепатоцитах, что определяет орган, преимущественно метаболизирующий этот моносахарид [20].
Поступление глюкозы происходит аналогичным способом, однако дальнейшее поглощение глюкозы и фруктозы гепатоцитами различно, как и различны их метаболические превращения при наличии сахарного диабета.
2.1. Отличие метаболизма фруктозы и глюкозы в гепатоцитах
Первым этапом метаболизма фруктозы в гепатоцитах является образование фруктозо-1-фосфата под действием фосфофруктокиназы-1 (фруктокиназы), аналогично под действием глюкокиназы из глюкозы образуется глюкоза-6-фосфат. Однако регуляция этих двух ферментов различна. Активность глюкокиназы зависит от уровня инсулина и концентрации АТФ, т.е. от энергетической потребности печени. Эти два фактора определяют, какое количество глюкозы задержится в печени, а какое поступит в системный кровоток. В отличие от глюкокиназы фруктокиназа менее зависима от уровня инсулина, что приводит к бесконтрольному захвату фруктозы печенью и малому поступлению фруктозы в системный кровоток [21].
2.2. Фруктокиназа как причина продукции мочевой кислоты
Образование фруктоза-1-фосфата под действием фруктокиназы – крайне энергозатратный процесс, вызывающий уменьшение количества АТФ в клетке на 23%, при том что последующее восполнение запаса АТФ в норме занимает 40 мин [7]. АТФ в данной реакции служит донором фосфата и превращается в АДФ. Снижение уровня внутриклеточного фосфата впоследствии стимулирует фермент АМФ-дезаминазу-2, стимулирующую продукцию МК [22].
Синим цветом показаны реакции превращения аденозиновых нуклеозидов в МК, оранжевым цветом – реакции полиолового шунта. ИМФ – инозинмонофосфат (рис. 4).
Самое большое количество фруктокиназы содержится в печени. На почки приходится половина от активности фруктокиназы печени и совсем малая активность – на головной мозг, сердце и мышцы [23]. Таким образом, учитывая особенности регуляции и распределения фруктокиназы, логично, что основное количество МК образуется в печени, откуда и поступает в системный кровоток. Ряд исследований также подтверждает, что употребление фруктозы вызывает увеличение сывороточного уровня МК [24–26]. Также отмечается, что увеличение продукции МК возможно за счет не только деградации аденозиновых нуклеозидов, но и увеличения биосинтеза пуринов de novo [27].
2.3. Эндогенная продукция фруктозы
Поступающая в организм глюкоза может быть утилизирована тремя путями: превращением в гликоген (1), в жирные кислоты (2) и пентозофосфатным путем (3). В норме так и происходит, однако при СД концентрация глюкозы вырастает настолько, что этих путей становится недостаточно. Одним из вариантов уменьшения уровня глюкозы является полиоловый шунт, потребляющий до 30% всей глюкозы крови при СД [28].
Полиоловый шунт включает две реакции: образование из глюкозы сорбитола, а из сорбитола – фруктозы, катализируемые альдозредуктазой и сорбитолдегидрогеназой соответственно. Однако окисление сорбитола во фруктозу лимитировано инсулинозависимым ферментом сорбитдегидрогеназой (рис. 4). Сорбитол относится к классу спиртов, и ему свойственна выраженная гидрофильность, не позволяющая легко диффундировать сквозь клеточную мембрану, следствием чего является его накопление в том месте, где он образуется, т.е. внутриклеточно. А это в свою очередь служит причиной повышения осмотического давления внутри клетки и осмотического стресса [28, 29]. Данное явление может лежать в основе диабетической ретинопатии, способствующей развитию катаракты, нейропатий, микроангиопатий и диабетической почечной дисфункции [30, 31].
Полиоловый шунт существует и в норме, однако его продуктивность крайне незначительная и полученная таким образом фруктоза посредством фосфорилирования и образования фруктоза-1-фосфата возвращается в пентозофосфатный путь, т.е. на физиологичный путь метаболизма всех углеводов. При избытке же глюкозы активность данного шунта становится бесконтрольной, что значительно увеличивает концентрацию фруктозы в крови.
Патологическое воздействие гиперурикемии, обусловленное повышенной концентрацией фруктозы, не ограничивается ПКБ, а имеет и системное воздействие. Например, МК ингибирует фосфорилирование эндотелиальной синтазы оксида азота (NO-синтаза), стимулированное инсулином, что уменьшает продукцию такого важного вазодилятатора, как NO [32]. Этот аспект патологического влияния избытка МК мы рассмотрим в отдельной работе.
Объективные научные данные свидетельствуют о вреде употребления избыточного количества фруктозы, однако вездесущая и продолжительная по времени реклама фруктозы как безопасной и полезной замены глюкозы при СД продолжает воздействовать на умы обывателей и сегодня. Независимо от этого дешевизна глюкозно-фруктозного сиропа стимулирует производителей все чаще использовать его в своих продуктах. Оба фактора способствуют экзогенному поступлению фруктозы в организм. Следующий за этим рост уровня фруктозы в крови индуцирует продукцию МК, не только являющейся причиной образования камней в почках на ее основе, но и создающей условия для формирования смешанных фосфатно-оксалатных камней. Наилучшим способом снижения риска развития ПКБ является снижение потребления продуктов на основе глюкозно-фруктозного сиропа, т.е. большинства кондитерских изделий, изготовленных промышленным способом, так как это будет способствовать приведению композитного состава тела к норме, ликвидации ожирения, а вместе с ним и ряда коморбидных заболеваний. И важно сделать акцент на том, что даже полное исключение фруктозы из рациона пациентов, страдающих СД2, на фоне гипергликемии приведет к активации компенсаторных механизмов, таких как полиоловый шунт, который функционирует нефизиологично в патологических условиях, а это будет способствовать метаболизации глюкозы во фруктозу и, соответственно, росту уровня МК со всеми вытекающими последствиями. Кроме того, в условиях инсулинорезистентности, которая сопровождает большинство пациентов с абдоминальным ожирением и СД2, под влиянием повышенной концентрации МК снижается и синтез, и активность NO, а это будет не только негативно влиять на всю эндотелиальную систему сосудов, но и приводить к ожидаемой эректильной дисфункции, что принципиально снижает качество жизни и является предиктором угрожающих состояний.
Перечисленные в статье механизмы помогают понять, как на клеточном уровне фруктоза стимулирует рост уровня МК и как с этим связано образование камней в почках, а знание механизмов позволяет подобирать оптимальное лечение или необходимую профилактику в той или иной ситуации.



