Введение. Радикальная цистэктомия (РЦ) с различными методами кишечной деривации мочи остается «золотым» стандартом хирургического лечения больных мышечно-инвазивным раком мочевого пузыря (РМП) [1, 2]. До эры малоинвазивной хирургии данная операция выполнялась открытым доступом. За последние десятилетия в клиническую практику внедрена и активно выполняется лапароскопическая и робот-ассистированная РЦ (РАРЦ) [3–7]. РАРЦ впервые была выполнена еще в 2003 г. [8], и с этого момента количество подобных вмешательств постоянно росло. Так, количество РАРЦ в США с 2002 по 2012 г. увеличилось с 0,7 до 18,5% [9]. Высокая стоимость роботической системы и самой операции, значительная продолжительность вмешательства и отсутствие отдаленных функциональных и онкологических данных служили вероятным сдерживающим фактором широкого применения РАРЦ. Однако оптимистично настроенные роботические хирурги продолжали выполнять РАРЦ, совершенствовать технику операции и наращивать клинический опыт. В дальнейшем проведенные проспективные рандомизированные исследования показали, что РAРЦ позволяет достигать идентичных с открытой РЦ онкологических и функциональных результатов, но с меньшим количеством осложнений [10–13]. Данная операция состоит из двух основных этапов: экстирпации мочевого пузыря (МП) с тазовой лимфодиссекцией и кишечной деривации мочи. При этом основная часть осложнений наблюдается при второй части РАРЦ и зависит от способа отведения мочи (илеокондуит или ортотопическая цистопластика). Вначале большинство авторов прибегали к экстракорпоральному формированию резервуара через минилапаротомный доступ, что позволяло уменьшать время операции. Однако при этом нарушались принципы малоинвазивности РАРЦ и требовалась мобилизация мочеточников на значительном протяжении, что приводило к их деваскуляризации и увеличению риска развития сужений уретерокишечных анастомозов. За последние годы некоторые урологи продемонстрировали возможность интракорпорального отведения мочи, что исключало выполнение мини-лапаротомии, длительного воздействия на кишечник и значимой послеоперационной боли [7, 13–16]. Кроме того, у женщин удаленный препарат можно извлечь трансвагинально. При РАРЦ с ортотопической деривацией мочи чаще выполняется реконфигурированная U-образная цистопластика с тубулярным участком, с которым анастомозируются мочеточники [3–7, 13–16]. Описаны также методики создания Y- или W-образного мочевого резервуара или ортотопическая цистопластика по методу клиники Padua [17–19]. В отечественной периодической литературе отсутствуют публикации о результатах РАРЦ с ортотопической цистопластикой за исключением единичных клинических наблюдений. Недостаточно освещены основные технические этапы этого сложного хирургического вмешательства.
Целью настоящей работы было подробное описание этапов РАРЦ с ортотопической цистопластикой и анализ ее ближайших результатов.

Материалы и методы. В центре урологии с робот-ассистированной хирургией Мариинской больницы с июня 2018 по сентябрь 2019 г. РАРЦ с интракопоральной илеоцистопластикой выполнена 16 больным (табл. 1). Предоперационное обследование включило лабораторные анализы, МСКТ легких и брюшной полости, МРТ малого таза с внутривенным контрастированием и остеосцинтиграфию. Также всем пациентам выполнялась уретроцистоскопия для уточнения размеров и локализации опухоли, исключения поражения шейки МП и простатического отдела уретры, гистологической верификации образования.
При выполнении РАРЦ придерживались определенной последовательности действий, выделяя три основных этапа: укладку больного на операционном столе с установкой роботических портов, РЦ с тазовой лимфодиссекцией, ортотопическую цистопластику.
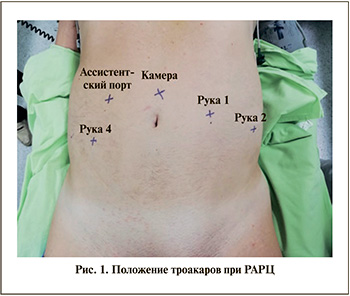 Укладка больного и установка роботических портов
Укладка больного и установка роботических портов
Операцию проводили в роботической операционной с использованием системы Da Vinci Si. Больных укладывали в дорсальное литотомическое положение с уложенными вдоль тела руками, нижние конечности отводили в стороны для подведения робота. Далее операционный стол устанавливали в положение Тределенбурга под углом 40–45°, обрабатывали хирургическое поле, устанавливали желудочный зонд и уретральный катетер. По срединной линии на 5 см выше пупка проводили первый троакар для камеры. После инсуфляции брюшной полости до 12 мм рт.ст. устанавливали два роботических порта по линии пупка: левый на 8 см, правый на 10–11 см от средней линии. Третий из них располагался на 8 см латеральнее левого порта и на 5 см выше гребня подвздошной кости. На кишечном этапе операции последний заменяли на 15 см троакар, что обеспечивало оптимальный доступ для резекции тонкой кишки и межкишечного анастомоза сшивающим аппаратом. С обеих сторон от правого роботического троакара устанавливали два ассистентских порта (рис. 1).
 Радикальная цистэктомия с тазовой лимфодиссекцией
Радикальная цистэктомия с тазовой лимфодиссекцией
После подключения робота выполняли осмотр брюшной полости, иссекали имеющиеся спайки, мобилизовывали сигмовидную кишку и отводили ее и петли тонкой кишки краниально. Вначале идентифицировали мочеточники на уровне пересечения с подвздошными сосудами и выделяли их на протяжении нижних третей до юкставезикального участка с максимальным сохранением периуретеральной клетчатки. После наложения клипсы геми-лок мочеточники пересекали. Раннее клипирование приводит к их пассивному расширению, что в дальнейшем облегчает выполнение уретерокишечного анастомоза. Затем выделяли семявыносящие протоки и семенные пузырьки, проводили мобилизацию МП кзади от пузырьков до фасции Денонвиля, которую вскрывали и дальнейшую диссекцию выполняли между ней и прямой кишкой (рис. 2, а). Мобилизацию задней поверхности простаты проводили кпереди от преректальной жировой клетчатки во избежание травмы прямой кишки. При нервосберегающей РЦ семенные пузырьки отделяли ближе к простате, что позволяет избегать повреждения нервно-сосудистых пучков, располагающихся латеральнее и близко к ним. После отделения МП сзади от прямой кишки осуществляли его мобилизацию с двух сторон, латеральнее от пупочной связки до эндопельвикальной фасции (рис. 2, б). Используя комбинацию острой и тупой диссекций, полость между латеральной стенкой МП и боковой стенкой таза расширяли до достижения тазовой фасции, которую вскрывали, а простату выделяли с двух сторон. Используя 4-ю руку, МП отводили в противоположном направлении, что позволяет хорошо визуализировать сосуды МП, клипировать и пересекать их (рис. 2, в). Выделение МП сбоку заканчивали на верхнелатеральной части простаты рядом с семенными пузырьками при сохранении нервно-сосудистых пучков. Дальнейшую нервосохраняющую диссекцию при РЦ выполняли по аналогичной методике, как при робот-ассистированной простатэктомии. Далее выделяли сосудистые ножки простаты, которые рассекали между клипсами геми-лок. Мочевой проток и медиальные пупочные связки коагулировали биполярным диссектором и пересекали, выделяли переднюю стенку МП и простаты (рис. 2, г). Дорсальный венозный комплекс перевязывали и пересекали, проводили диссекцию апикальной части простаты и уретры. После пересечения уретры на катетер Фолея ближе к МП накладывали клипсу геми-лок для исключения попадания мочи с опухолевыми клетками в операционную рану (рис. 2, д). Удаленный препарат помещали в эндомешок. Далее всем больным выполняли расширенную тазовую лимфодиссекцию, объем которой включал выделение и удаление лимфоузлов из запирательной ямки – по ходу подвздошных артерий и вен до бифуркации аорты.
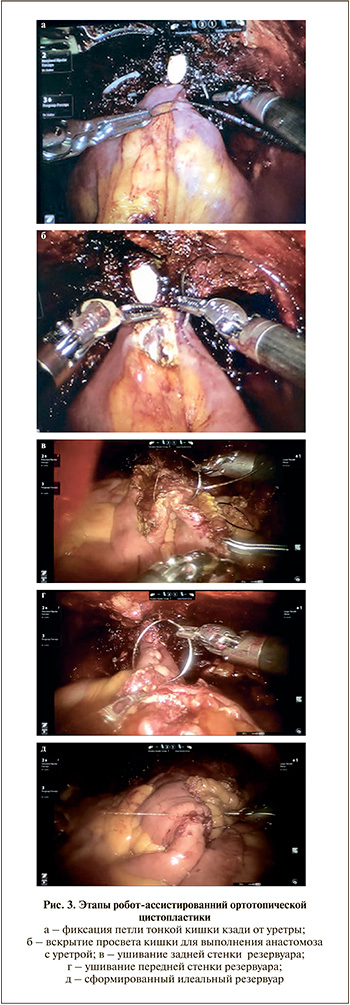
 Интракорпоральная ортотопическая цистопластика
Интракорпоральная ортотопическая цистопластика
После удаления МП робот отсоединяли от портов, меняли положение Тределенбурга до 10–15°. Обратно подключали роботическую систему. Отступив более 25 см от илеоцекального угла, резецировали 40 см подвздошной кишки. Проходимость кишки восстанавливали анастомозом «бок в бок» аппаратным швом. Подвздошную кишку опускали в малый таз, подтягивая ее к уретре, помечали наиболее дистальную часть петли, которую фиксировали к парауретральным тканям сзади (рис. 3, а). В этой зоне вскрывали просвет кишки на протяжении 1,5 см, выполняли уретро-резервуарный анастомоз нитью 3/0 Stratafix и устанавливали катетер Фолея 20 Шр (рис. 3, б). Два дистальных участка используемой кишки по 15 см каждый укладывали U-образно, а проксимальную часть длиной 10 см оставляли тубулярной. Первые два сегмента детубуляризовали по антибрыжеечному краю, вначале непрерывным швом ушивали задние, далее передние края детубуляризованной кишки и заканчивали формирование резервуара (рис. 3, в–д). Левый мочеточник проводили через мезоколон сигмовидной кишки. Оба мочеточника имплантировали в тубулярный сегмент резецированной кишки по методу Nesbit, устанавливали double-J-стенты (рис. 4, а, б). В конце операции для проверки герметичности резервуара заполняли его стерильным раствором. В малый таз устанавливали дренаж, извлекали роботические инструменты и отсоединяли робот. Макропрепарат удаляли через расширенную троакарную рану.
В послеоперационном периоде проводили инфузионную и антибактериальную терапию, профилактику тромбоэмболических осложнений. На 10-е сутки выполняли ретроградную цистограмму, при герметичности резервуара удаляли стенты и выписывали больных на амбулаторное лечение. Оценивали такие показатели, как время операции, объем кровопотери, количество интра- и послеоперационных осложнений, сроки госпитализации, процент дневной и ночной континенции.
Результаты. Все операции были завершены робот-ассистированным доступом. Пятнадцати больным РМП проведена интракорпоральная ортотопическая илеоцистопластика, пациентке с микроцистисом и постлучевым сигмоидно-пузырным свищом – резекция сигмовидной кишки с аугментационной илеоцистопластикой. Время операции колебалось от 320 до 560 мин, в среднем составив 380 мин. Объем кровопотери варьировался от 80 до 200 мл, гемотрансфузия не проводилась.
Ближайшие 30-дневные осложнения наблюдались у 7 (43,7%) больных, из них у 4 (25%) – I–II классов по Clavien–Dindo, у 3 (18,7%) – III–IV классов по Clavien–Dindo (табл. 2). В связи с негерметичностью мочеточниково-кишечного соустья двум больным проводилась пункционная нефростомия, третьему – перкутанное дренирование обеих почек ввиду несостоятельности уретрорезервуарного анастомоза. Одному пациенту с желудочно-кишечным кровотечением и снижением уровня гемоглобина потребовалась гемотрансфузия.
Поздние 90-дневные осложнения имели место у 6 (37,5%) больных (см. табл. 2). У двоих из них наблюдалась инфекция верхних мочевыводящих путей (ВМП), они были госпитализированы в стационар. Пациент 76 лет умер от острого инфаркта миокарда (V класс осложнений по Clavien–Dindo), но при патологическом исследовании состояние резервуара и ВМП было признано удовлетворительным.


Патоморфологическое исследование установило рТ2-стадию 6 больным, рТ3 – 8 и рТ4 – 1. У 3 (18,7%) пациентов также был выявлен рак предстательной железы, у 1 (6,3%) – позитивные лимфоузлы. У 13 (81,3%) из 16 пациентов наблюдалось полное удержание мочи, остальные 3 (18,7%) использовали 1–2 прокладки в день. Ночная континенция составила 56,3%.
Средний период наблюдения за больными после РАРЦ составил 7,6 мес. (от 2 до 13 мес.). Случаев местного рецидива опухоли не было. Отдаленные метастазы имели место у пациента с позитивными лимфоузлами после РЦ, он умер спустя 7 мес. после операции.
Обсуждение. Радикальная хирургия РМП с деривацией мочи остается сложным разделом современной урологии. При оперативном лечении больных мышечно-инвазивным РМП наряду с открытым доступом с 2003 г. активно используется робот-ассистированный. Преимущества данной операции: минимальная кровопотеря, раннее восстановление функции кишечника, короткое время госпитализации и низкий процент стриктур мочеточниково-кишечных анастомозов [3–7, 14–19]. Однако РЦ с кишечной деривацией мочи независимо от применяемого доступа остается сложным хирургическим вмешательством с довольно высоким процентом послеоперационных осложнений. Так, при открытой РЦ, несмотря на оптимизацию техники и улучшение результатов операции, смертность колеблется от 0 до 8%, частота осложнений – от 48 до 74% [20, 21].
За последнее десятилетие робот-ассистированный доступ все чаще применяется при РЦ и позволяет снижать периоперативную морбидность этой операции [3–7, 10–14, 20, 21]. Высокий процент осложнений при РАРЦ также связан с кишечной деривацией мочи и используемым методом ее отведения. Большинство урологов вначале выполняли экстракорпоральную деривацию мочи из-за технических сложностей интракорпоральной реконструкции илеорезервуара и значительного увеличения продолжительности операции по сравнению с открытой РЦ. В дальнейшем постепенно увеличивалось количество клиник, использовавших интракорпоральную деривацию мочи при РАРЦ. Об этом наглядно свидетельствуют данные Международного консорциума по изучению результатов РАРЦ [15, 16]. Так, в 2014 г. был проведен сравнительный анализ результатов РАРЦ, выполненных 935 пациентам, 167 из которых проводилось интра- и 768 – экстракорпоральное отведение мочи [15]. В первой группе наблюдалось сравнительное снижение общего количества осложнений (41/49%, p=0,059), в том числе желудочно-кишечных (10/23%, р<0,001), и низкий процент гемотрансфузии (7/16%, р=0,02). В работе [16] представлены данные ретроспективного анализа РАРЦ у 2432 больных. Из них 1094 (51%) деривация мочи выполнялась интракорпоральным доступом, который в 2005 г. использовался в отношении только 9%, в 2016 г. –97% больных. Однако это произошло за счет увеличения количества интракорпоральных илеокондуитов – с 2 до 81%, а частота проведения ортотопической цистопластики за те же годы выросла с 7 до 17%. При сравнении результатов деривации мочи двумя доступами в первой группе время операции было меньше (357/400 мин), наблюдался низкий объем кровопотери (300/350 мл) и процент переливания крови (5/13%; во всех случаях p<0,001). Кроме того, количество осложнений высокой степени по Клавьену после интракорпоральной деривации мочи достоверно снизилось с 25% в 2005 г. до 6% в 2015 г. (p<0,001), но оставалось стабильным после экстракорпорального отведения мочи – 13 и 14% соответственно.
Данные Международного консорциума по изучению результатов РАРЦ показывают, что в течение последнего десятилетия резко увеличилось количество интракорпорально выполняемых дериваций мочи [16]. Однако интракорпоральное формирование илеорезервуара остается сложным продолжительным хирургическим вмешательством и имеет достоверно длительную кривую обучения. По данным [22], опыт 30 вмешательств позволяет достигать приемлемого уровня владения техникой РАРЦ. M. M. Desai et al. [6] сообщали о значимых улучшениях показателей РАРЦ после первых 15 операций. Так, среднее время РАРЦ уменьшилось с 527 до 375 мин (p<0,001), объем кровопотери – с 550 до 200 мл (p<0,001), сроки госпитализации – с 10 до 7 дней (p=0,028), частота осложнений – с 60 до 36% (p=0,057). Другие авторы также указывают на сравнительно короткие кривые обучения для РАРЦ [5, 23].
В настоящее время РАРЦ с интракорпоральным отведением мочи выполняется в крупных центрах роботической хирургии и урологами с достаточным опытом в кишечной деривации мочи. Отрицательной стороной первых РАРЦ является достоверно длительное время операций по сравнению с открытой РЦ, в основном за счет их кишечного этапа. Для снижения продолжительности РАРЦ и повышения ее эффективности различными авторами предлагались модификации илеальных резервуаров. Среди них наиболее легким и непродолжительным по времени является формирование неоцистиса нерастворимыми титановыми степлерами [8], которые, однако, могут быть причиной снижения объема МП и образования камней. Другие авторы предлагают использовать сегмент кишки меньшей длины и модифицированную конфигурацию резервуара [16, 19].
Робот-ассистированная РЦ с интракорпоральной ортотопической цистопластикой в нашей клинике выполнена 16 больным. Ближайшие онкологические и функциональные результаты данного вмешательства были опубликованы нами ранее [24]. Несмотря на лимитированное количество операций, мы определили основные этапы робот-ассистированной РЦ и интракорпоральной ортотопической цистопластики.
Заключение. В настоящее время при оперативном лечении больных мышечно-инвазивным РМП наряду с открытой Р, активно применяется РАРЦ. При РАРЦ с интракорпоральной деривацией мочи этапы операции необходимо выполнять последовательно, что позволяет уменьшать время операции и количество послеоперационных осложнений.



