Введение. Радикальная цистэктомия является основным рекомендованным оперативным методом лечения мышечно-инвазивного рака мочевого пузыря. Выбор способа отведения мочи чрезвычайно важен, влияет на дальнейшее качество жизни пациента и вероятность развития отдаленных последствий. Выведение уретерокутанеостом является наименее травматичным для пациента способом деривации мочи, что особенно актуально для отягощенных пациентов с высоким операционно-анестезиологическим риском. В то же время есть риск развития инфекции мочевых путей и прогрессирования хронической почечной недостаточности в случае выведения мочеточников на кожу. Анатомически обоснована кишечная пластика с формированием резервуара мочи, замещающего накопительную функцию мочевого пузыря. При этом как при гетеротопической, так и при ортотопической пластике мочевого пузыря производится имплантация мочеточников в полость резервуара.
Техническая многогранность оперативных вмешательств по кишечной пластике мочевого пузыря обусловливает высокий риск отдаленных осложнений. Развитие местной ишемии в зоне уретерорезервуароанастомоза, натяжение тканей с формированием рубцово-склеротического процесса служат предрасполагающим фактором образования стриктур (проходимость для мочи контрастного вещества или сруны-проводника частично сохранена) и облитераций (проходимость полностью отсутствует) мочеточника в зоне его соустья с мочевым резервуаром [1]. В то же время одной из причин сужения мочеточника может быть и местный рецидив онкологического процесса, поэтому в мировой литературе используется термин «доброкачественная стриктура мочеточниково-кишечного анастомоза» для описания истинных стриктур мочеточника вне связи с онкорецидивом [2].
Частота развития отдаленных осложнений цистэктомии может достигать 70% в зависимости от способа деривации мочи [3]. Стриктуры и облитерации уретерорезервуароанастомоза встречаются в 8–15% наблюдений, возникая преимущественно в первые 2 года после операции [4–7]. Развитие нефро- и уретеролитиаза, связанного с сужением мочеточника, описывается у 11–20% пациентов [8–10] с частотой рецидивов в течение 5 лет до 63% [11]. Основным диагностическим признаком появления стриктуры уретерорезервуароанастомоза является наличие уретерогидронефротической трансформации при контрольных обследованиях. Около 78% пациентов с выявленными сужениями уретерорезервуароанастомоза имеют клинические проявления в виде болей в поясничной области либо развития острого обструктивного пиелонефрита с необходимостью дренирования почки путем пункционной нефростомии [12].
Диагноз стриктуры или облитерации уретерорезрвуароанастомоза при нормальных показателях креатинина крови ставится на основании выполненного рентгеновского исследования почек с контрастированием (экскреторной урографии, компьютерной томографии) либо антеградной пиелоуретерографии при наличии нефростомы. Для исключения рецидива онкопроцесса целесообразны выполнение магнитно-резонансной томографии малого таза, а также цитологическое исследование и анализ мочи на маркеры рака мочевого пузыря.
Согласно рекомендациям Европейской ассоциации урологов, «золотым» стандартом оперативной коррекции стриктур и облитераций мочеточниково-кишечных анастомозов является реконструктивная пластика с реимплантацией мочеточников в полость резервуара [13]. Результативность данного вмешательства, по данным литературы, достигает 76–92% [14, 15]. В то же время использование минимально инвазивных эндоурологических (рентген-эндоскопических) методик длительное время оставалось дискутабельным ввиду наличия разных данных об их эффективности, способах воздействия на рубцовую ткань, виде и длительности послеоперационного дренирования.
Длительное время рентген-эндоскопические методы лечения стриктур и облитераций уретерорезервуароанастомозов находили применение только в отношении пациентов с тяжелыми сопутствовавшими заболеваниями, которым были противопоказаны открытые способы коррекции. К важным факторам, влияющим на успех операции, относятся протяженность стриктуры, функция почки, степень бактериурии, давность первичного вмешательства, наличие в анамнезе лучевой терапии [16, 17].
Баллонная дилатация – довольно распространенный способ малоинвазивного лечения проходимых стриктур уретерорезервуароанастомоза. Ее эффективность при стриктурах протяженностью менее 1 см может достигать 15–67% в течение первых месяцев после воздействия [17, 18], однако вероятность рецидива рубцевания при длительном наблюдении крайне высока, достигая 95% в течение 3 лет, а при более протяженных сужениях – и в течение 1 года [14, 19].
Эндоуретеротомия «холодным» ножом не получила широкого распространения ввиду ее дискутабельной эффективности и развития лазерных технологий. Тем не менее в опубликованных исследованиях Poulakis et al. продемонстрировали успешное выполнение первичной «холодной» эндоуретеротомии 60,5% пациентов при трехлетнем наблюдении [16].
Не нашло широкого применения в клинической практике для рассечения стриктур уретероэнтероанастомозов использование электрохирургического баллон-катетера Acucise. По результатам исследования Lin et al., при двухлетнем наблюдении эффективность метода составила 30% [20], в работе Milhoua et al. положительный результат отмечен лишь у 1 пациента из 28 спустя 11 мес. после вмешательства [12].
Внутреннее стентирование мочеточника в качестве монотерапии также не является методом лечения стриктур мочеточниково-кишечных анастомозов. Оно обеспечивает дренирование почки без необходимости нефростомии, улучшая качество жизни пациента. Однако необходимость регулярной смены внутренних стентов, довольно частая их миграция, инкрустация вплоть до камнеобразования ограничивают их использование в случаях, когда способы оперативной коррекции сужений мочеточника не применимы или не эффективны даже при использовании металлических и нитиноловых стентов длительного стояния [21]. По данным исследования Liatsikos et al., эффективность внутреннего дренирования металлическими стентами в ближайший послеоперационный период составляет порядка 70,8%, однако в течение 4 лет наблюдения адекватная проходимость мочеточников наблюдалась лишь у 22,7% пациентов [22].
Благодаря непрерывному технологическому совершенствованию новые лазерные технологии нашли свое применение в коррекции стриктур уретерорезервуароанастомозов. Применение гольмиевого лазера позволяет достигать желаемого эффекта проходимости мочеточника в 32–85% наблюдений [23–25]. В течение 3 лет наблюдений эффективность гольмиевой инцизии составляла 32–33% [26].
Для профилактики рецидива рубцевания Katims et al. производили гольмиевую инцизию стриктур уретерорезервуароанастомозов на 1 см проксимально и дистально локализации сужения на всю глубину фиброзной ткани до жировой клетчатки с последующим введением в область рассеченной стриктуры раствора триамцинолона. Операция дополнялась баллонной дилатацией до 24 Fr и шинированием мочеточника внутренним стентом или антеградным нефростомическим интубирующим дренажем. Эффективность такой техники составила 83,3% при общем количестве наблюдений 24 в течение 30 мес. [27].
Разнородность данных по эффективности лечения стриктур и облитераций уретерорезервуароанастомозов требует поиска новых оптимальных способов их оперативной коррекции. Перспективным направлением является использование современных тулиевых лазеров, в том числе тулиевого волоконного лазера, для рассечения рубцовых тканей, а также возможность продолжительного «тандемного» дренирования верхних мочевых путей двумя внутренними стентами для профилактики рецидива фиброза [28].
Материалы и методы. Суммарно с 2018 по 2021 г. во 2-м урологическом отделении ГКБ им. Д. Д. Плетнева на лечении находились трое пациентов с полными облитерациями уретерорезервуароанастомозов после ранее перенесенной цистэктомии с ортотопической пластикой мочевого пузыря и уретерорезервуароанастомозом по Уоллесу. У двух пациентов возникновение рубцового осложнения отмечено в течение 1 года после цистэктомии. У одного больного облитерация развилась спустя 17 лет после первичной операции, при этом триггером к появлению сужения послужила перенесенная за год до этого операция по поводу колоректального рака. Всем пациентам первым этапом была установлена чрескожная пункционная нефростома по поводу атаки острого пиелонефрита. Рецидив онкопроцесса был исключен. Протяженность стриктуры у всех пациентов не превышала 1,0 см. Оперативное лечение производилось в литотомическом положении больного под рентген-эндоскопическим контролем после предварительного антеградного проведения до области облитерации рабочей и страховой струн-проводников с возможностью доставки специального катетера со встроенным оптоволоконным световодом (“Karl Storz”) для выполнения реканализации мочеточника «на свет». В двух наблюдениях рассечение рубцовых тканей производилось при помощи электрохирургии, в одном – лазерное рассечение рубцовых тканей и их выпаривание отечественным тулиевым лазером Fiberlase U1 («ИРЭ-Полюс») под эндоскопическим контролем. В последующем производилось бужирование мочеточника мочеточниковыми бужами 10–16 Fr. Дренирование почки осуществлялось путем установки двух внутренних стентов диаметром 6 Fr каждый, сроком на 6 (2 больных) и на 2 мес. (1 больной)
Результаты и их обсуждение. Средняя продолжительность оперативного вмешательства составила 46,6 мин. У одного пациента отмечено обострение пиелонефрита в послеоперационном периоде, обусловленное наличием полирезистентной микрофлоры по данным бактериологического исследования мочи. Использование антибиотиков резерва позволило добиться купирования атаки пиелонефрита. Всем пациентам в послеоперационном периоде на 2–3-и сутки производилось удаление нефростомического дренажа. Через 6 мес. выполнялась контрольная резервуароскопия с уретероскопией с целью определения эффективности реканализации мочеточника (2 пациента). Всеми пациентами достигнут адекватный диаметр уретерорезервуароанастомоза, произведено удаление внутренних стентов. У одного пациента (2-месячное стентирование после реканализации) отмечена атака острого пиелонефрита через 2 мес. после удаления внутренних стентов, что потребовало выполнения повторной пункционной нефростомии. При обследовании выявлен рецидив облитерации уретерорезервуароанастомоза, в связи с чем пациенту в последующем повторно произведена эндоскопическая реканализация мочеточника с установкой двух внутренних стентов сроком на 6 мес. По данным контрольной мультиспиральной компьютерной томографии, через 6 мес. после удаления внутренних стентов нарушения оттока мочи из почек у пациента не выявлено.
Всеми пациентами достигнут адекватный диаметр уретерорезервуароанастомоза после удаления внутренних стентов. У двух пациентов сохраняется адекватный пассаж контрастного вещества по обоим мочеточникам на протяжении 42 и 37 мес. после первичной реканализации (по данным контрольной компьютерной томографии и экскреторной урографии). У одного пациента после повторно выполненной эндоскопической реканализации мочеточника с установкой двух внутренних стентов сроком на 6 мес. рецидивирования стриктуры не отмечается на протяжении 28 мес. наблюдения.
Выбор оптимального метода оперативного лечения стриктур и облитераций уретерорезервуароанастомозов после ранее перенесенных цистэктомий носит сложный, зачастую индивидуальный, характер. Выполнение открытой реконструктивной пластики мочеточнико-кишечного соустья часто лимитировано соматическим состоянием пациентов, их нежеланием повторно подвергаться тяжелому, продолжительному оперативному вмешательству. Научно-технический прогресс в развитии эндоскопического оборудования, расходного материала, лазерных аппаратов дал возможность успешно производить реканализацию мочеточника малоинвазивными методами. Использование комбинированного ретроградного и антеградного доступов к области облитерации дало возможность производить рассечение рубцовых тканей «на свет» («cut to the light») при помощи электрохирургии либо лазерной энергии. Это позволило максимально восстанавливать анатомический ход мочеточника без расхождения ориентиров по плоскости. Подобная техника оказалась возможной благодаря малой протяженности облитерации (до 1,0 см) и наличию у больных предварительно сформированного нефростомического хода (предустановленные нефростомические дренажи). Длительное шинирование мочеточника двумя внутренними стентами диаметром 6 Fr каждый служило профилактикой как раннего, так и отдаленного рецидива стриктуры. Малое число наблюдений требует дальнейшего изучения эффективности эндоскопической коррекции облитераций и стриктур уретерорезервуароанастомозов с пролонгированным шинированием мочеточника двумя внутренними стентами после перенесенной ортотопической пластики мочевого пузыря.
В подавляющем большинстве литературных источников приводятся данные по рентген-эндоскопическому лечению проходимых стриктур уретерорезервуароанастомозов. Особенностью нашей работы является изучение возможностей подобной хирургии для лечения полных облитераций уретерорезервуароанастомозов. Наш прежний опыт рентген-эндоскопической реканализации при неонкологических облитерациях верхних мочевых путей [29] позволил расширить возможности минимально-инвазивной интервенционной хирургии для ликвидации подобных осложнений ортотопической пластики мочевого пузыря.
Приводим одно из собственных клинических наблюдений.
Во 2-е урологическое отделение ГБУЗ «ГКБ им. Д. Д. Плетнева» Департамента здравоохранения г. Москвы в июне 2018 г. госпитализирован пациент П. 54 лет. В 2016 г. впервые в жизни отметил примесь крови в моче. 22.09.2016 больному выполнена уретроцистоскопия, при которой на правой стенке с переходом на переднюю и дно мочевого пузыря определяется солидная инфильтративная опухоль диаметром до 3,5 см с буллезным отеком слизистой, произведена трансуретральная резекция мочевого пузыря. Морфологическое заключение: фрагменты стенки мочевого пузыря с разрастанием уротелиальной карциномы 3-й степени клеточной анаплазии (G3) с инвазией в подслизистый слой до границы с внутренней частью мышечного слоя. 05.07.2017 выполнены цистпростатвезикулэктомия, расширенная лимфаденэктомия, пластика мочевого резервуара сегментом тонкой кишки по Штудеру и уретерорезервуароанастомозом по Уоллесу. Морфологическое заключение: опухоль представлена низкодифференцированной (G3) переходноклеточной карциномой, врастающей в стенку мочевого пузыря на глубину до 1 см вплоть до мышечного слоя без прорастания окружающей жировой клетчатки. Край резекции со стороны мочеточников и лимфоузлы интактны. Больному был выставлен послеоперационный клинический диагноз «рак мочевого пузыря pT3aN0M0». Спустя 8 мес. пациент стал отмечать тупые боли в поясничной области справа, периодически возникающую лихорадку до 380С. При контрольном ультразвуковом исследовании диагностирована гидронефротическая трансформация справа, в связи с чем 19.04.2018 выполнена чрескожная пункционная нефростомия справа. По данным выполненной антеградной пиелоуретерографии справа выявлена картина облитерации нижней трети правого мочеточника.
С целью восстановления анатомической проходимости правого мочеточника принято решение выполнить эндоскопическую реканализацию правого мочеточника.
Больному проведено стандартное комплексное клиниколабораторное обследование. Отклонений в клиническом анализе крови выявлено не было. В биохимическом анализе крови отмечена незначительная азотемия (креатинин – 147 мкмоль/л, мочевина – 8,6 ммоль/л). В посеве мочи диагностирована бактериурия Klebsiella pneumoniae 107 КОЕ/мл и Enterococcus faecalis 105 КОЕ/мл.
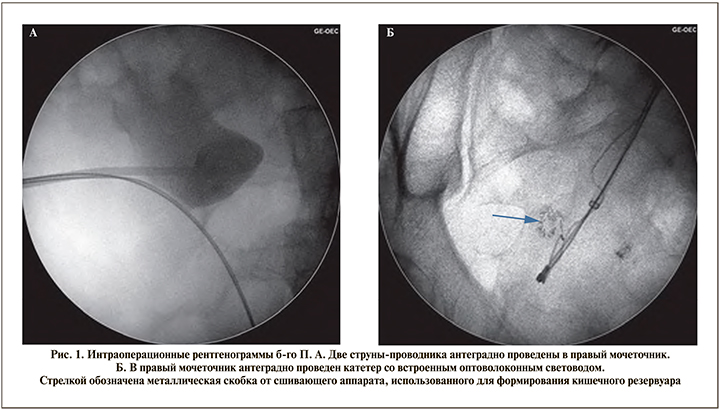
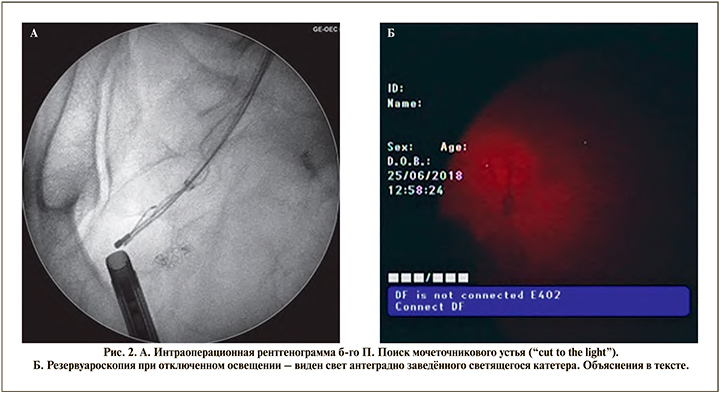

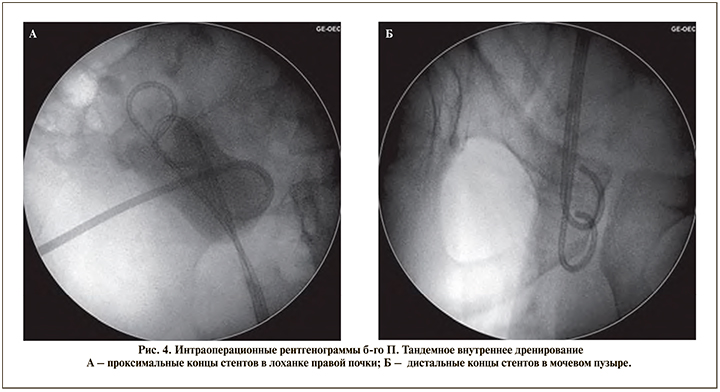
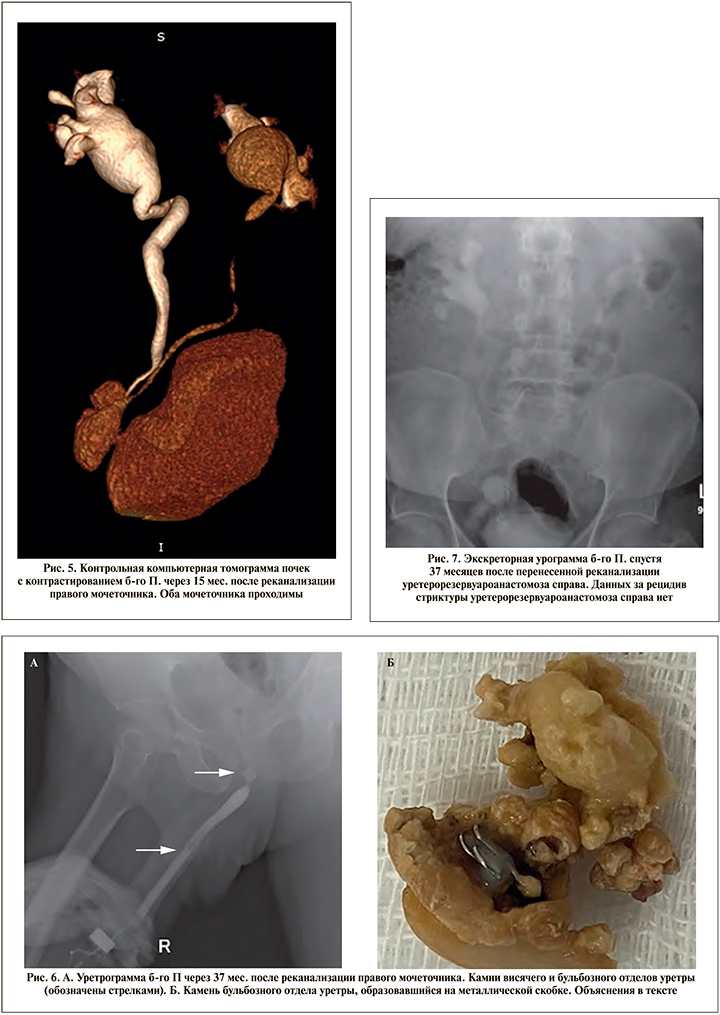
Оперативное вмешательство выполнено под эндотрахеальным наркозом в условиях рентген-операционной в литотомическом положении пациента. Первым этапом произведено контрастирование чашечно-лоханочной системы с последующим антеградным проведением двух струн-проводников (рабочей и страховой) до уровня облитерации мочеточника. В дальнейшем по струне-проводнику к области облитерации антеградно доставлен катетер с встроенным оптоволоконным световодом размером 7 Fr (рис. 1). Вторым этапом произведена трансуретральная резервуароскопия гибким цисто- и резектоскопом. Визуализировать устье правого мочеточника не представилось возможным, в связи с чем резервуароскопия выполнена с выключенным осветителем и параллельной антеградной подсветкой ранее проведенного в мочеточник катетера со встроенным световодом (рис. 2). Визуализировано место предполагаемого устья правого мочеточника, рассеченного путем монополярной электрохирургии «на свет» («cut to the light»). Визуализирован просвет мочеточника с находящимися внутри него антеградно заведенными струнойпроводником и светящимся катетером (рис. 3). Струна-проводник выведена через уретру наружу, и выполнено бужирование мочеточника при помощи мочеточниковых бужей 10–16 Fr. Просвет мочеточника сформирован адекватно. Протяженность облитерации составила не более 1 см. С целью шинирования мочеточника в правую почку установлено два внутренних стента диаметром 6 Fr (рис. 4) сроком на 6 мес., после удаления которых нарушения оттока мочи из почек зафиксировано не было. По данным контрольной компьютерной томографии с контрастированием, выполненной спустя 1 год и 3 мес. после удаления внутренних стентов, мочеточники проходимы, признаков рецидивирования стриктуры правого мочеточника выявлено не было (рис. 5).
При дальнейшем наблюдении через 3 года после выполненной реканализации уретерорезервуароанастомоза в отсутствие клинических проявлений со стороны почек (креатинин – 136 мкмоль/л, мочевина – 7,4 ммоль/л) у больного развилась острая задержка мочеиспускания и диагностированы камни уретры, которые, по-видимому, образовались на отторгнувшейся металлической скобке от сшивающего аппарата, использованного для формирования кишечного резервуара в 2017 г. Пациенту выполнена уретрорезервуароскопия, при которой в висячем отделе уретры выявлен конкремент размером 1 см и в бульбозном отделе размером до 2 см выполнена тулиевая волоконная уретролитотрипсия, литоэкстракция (рис. 6). Также пациенту выполнена уретероскопия ригидным уретеропиелоском 8 Fr, при которой проходимость неоустья оценена как адекватная. Данных за рецидив онкопроцесса выявлено не было. При контрольном обследовании данных за рецидив сужения уретерорезервуароанастомоза не получено (рис. 7).
Заключение. Рентген-эндоскопическое лечение как первичных, так и рецидивных непротяженных облитераций уретерорезервуароанастоза после перенесенной ортотопической пластики мочевого пузыря позволяет добиваться адекватной проходимости мочеточника при условии пролонгированного его шинирования двумя внутренними стентами в течение 6 мес.



