Пролапс тазовых органов (ПТО) – распространенное патологическое состояние, заболеваемость которым увеличивается среди женщин пожилого возраста. J. Wu et al. [1] отметили, что к 2050 г. 43,8 млн женщин будут страдать по крайней мере одним из видов пролапса гениталий. Коррекция пролапса гениталий включает активное наблюдение, физические упражнения для укрепления мышц тазового дна, использование пессариев, а также оперативное вмешательство.
Хирургическое лечение ПТО постоянно совершенствуется. Изначально использовался исключительно трансвагинальный доступ, при котором частота рецидива пролапса превышала 27% [2]. С момента использования синтетических протезирующих материалов данный показатель начал снижаться [3]. Открытая трансабдоминальная сакрокольпопексия с использованием сетчатого протеза служит «золотым» стандартом лечения пролапса гениталий — опущения матки и/или свода влагалища, где необходима апикальная фиксация пролапса [4]. Данный подход способен обеспечивать переднюю и апикальную поддержку с отличными долгосрочными результатами [5–7]. На сегодняшний день сакрокольпопексия выполняется преимущественно из лапароскопического доступа. С появлением роботической хирургической системы da Vinci (Intuitive Surgical, Inc., Sunnyvale, CA) у хирурга появилось больше возможностей для восстановления нормальной анатомии тазового дна [8–11].
Многие хирурги используют трансвагинальный доступ для коррекции ПТО, при этом ведутся многочисленные исследования, сравнивающие различные доступы. Так, Maher et al. [12] провели проспективное рандомизированное сравнительное исследование, в котором сакрокольпопексию выполняли трансабдоминальным и трансвагинальным доступами. Авторы показали, что обе операции обеспечили значительное улучшение качества жизни пациенток, однако по различным объективным показателям трансабдоминальный доступ был предпочтительнее.
Braun et al. [13] провели исследование, сравнив коррекцию пролапса гениталий влагалищным доступом с трансабдоминальной сакрокольпопексией и симультанной ампутацией матки. В результате открытое вмешательство было признано более эффективным вариантом лечения. Разработка специальных синтетических протезирующих устройств была призвана улучшить результаты коррекции пролапса, однако их следует применять только по показаниям в экспертных центрах в связи с риском развития серьезных осложнений [14].
Несмотря на то что сакрокольпопексия выполняется с 1957 г., впервые данная методика была описана Lane в 1962 г. [15].
Показания к сакрокольпопексии
Наличие у больной симптомов пролапса гениталий, которые могут приводить к снижению качества жизни, расстройствам мочеиспускания и дефекации, а также неэффективность или невозможность проведения консервативного лечения (например, наличие ограничений к применению пессариев или рецидивирующее изъязвление слизистой оболочки влагалища при их использовании), равно как возникновение осложнений ПТО служат показанием к оперативному лечению.
Каждой пациентке следует проводить полное обследование с целью уточнения характеристики пролапса, что считается определяющим фактором при выборе оперативного пособия. Пациенткам с передним и апикальным пролапсом гениталий больших размеров или пациенткам с рецидивирующим ПТО можно рекомендовать выполнение сакрокольпопексии. Также данный метод подойдет пациенткам с пролапсом культи влагалища [16]. Следует информировать больных, что даже при выполнении сакрокольпопексии может понадобиться сопутствующая пластика влагалищным доступом, особенно при наличии ректоцеле значимых размеров.
Показания к робот-ассистированной сакрокольпопексии (РАС)
Решение о применении роботической техники зависит от нескольких факторов. Например, если у пациентки в анамнезе есть операции на брюшной полости и можно предположить наличие обширного спаечного процесса, установка троакаров может оказаться технически сложной. Пациентки с ожирением также не идеальные кандидатки для роботической операции. Следует учитывать не только характеристики больной и ее предпочтения в выборе операции, но и опыт хирурга.
Преимущества и недостатки РАС
Многочисленные сравнительные исследования выявили ряд преимуществ робот-асситированной хирургии по сравнению со стандартным открытым доступом. Среди них: минимальная интраоперационная кровопотеря, незначительный послеоперационный болевой синдром, короткие сроки пребывания в стационаре [17–19].
Для хирурга роботический доступ позволяет увеличить обзор операционного поля, а 3D-визуализация структур малого таза помогает детально проводить каждый этап операции. Специальные инструменты дают возможность работать в глубине таза, что вместе с хорошим обзором является существенным преимуществом для хирурга, а сидячее положение и эргономика консоли обеспечивают комфорт.
Робот-ассистированная операция имеет ряд особенностей, не характерных для других хирургических методик. Некоторые авторы отмечают недостатки роботической системы, такие как отсутствие обратной тактильной связи [23]. К минусам данной техники можно отнести увеличение операционного времени из-за необходимости точного позиционирования пациента, стыковки и расстыковки роботической системы. Увеличение времени операции может быть значимым фактором риска для пациентов с высоким риском неблагоприятных исходов [21].
Предоперационная подготовка
Следует обсудить с пациенткой возможность выполнения симультанной гистерэктомии. Хирург также должен оценить базовый операционный риск пациентки и предупредить о возможных интра- и послеоперационных осложнениях. Индивидуальный подход к каждому больному обеспечивает выбор наиболее адекватной лечебной тактики и метода хирургического лечения.
Ход операции
Положение пациентки. После выполнения комбинированной анестезии пациентку фиксируют специальными ремнями, используют подкладки, чтобы избежать сдавления и повреждения нервных окончаний. Мочевой пузырь дренируют катетером Foley.
Хирургический инструментарий:
- монополярные ножницы;
- биполярный пинцет;
- зажим;
- иглодержатель;
- ассистентские инструменты – ирригатор, кишечный граспер и др.;
- инструменты для выполнения гистерэктомии.
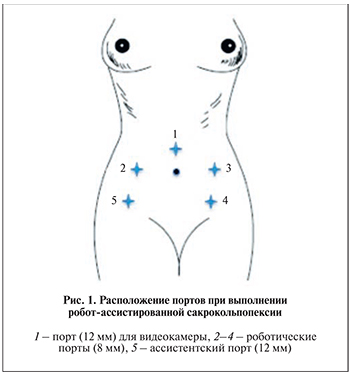 Установка роботических портов. Роботические порты обычно располагают в конфигурации «W» с портом камеры, находящимся параумбиликально. Расстояние между портом камеры и лобковым симфизом должно составлять примерно 16–18 см. При большем расстоянии у хирурга не будет необходимого доступа к малому тазу. Наложение пневмоперитонеума достигается при помощи иглы Вереша или путем установки оптического порта открытым способом по срединной линии, на 2 см выше пупка по методу Hassaw. Остальные порты вводят под контролем зрения. Все порты устанавливают на расстоянии не менее 9 см друг от друга, чтобы обеспечить достаточное пространство для стыковки с роботом и предотвратить «конфликт» роботических рук. Два 8-миллиметровых порта располагают симметрично, с двух сторон по среднеключичной линии на уровне пупка; третий порт (8 мм) устанавливают в левой подвздошной области по среднеключичной линии, ассистентский порт (12 мм) размещают по передней подмышечной линии на 3 см выше гребня правой подвздошной области (рис. 1). Рабочую консоль робота располагают у ножного конца стола, между ног пациентки. Ассистент хирурга, как правило, располагается справа от операционного стола.
Установка роботических портов. Роботические порты обычно располагают в конфигурации «W» с портом камеры, находящимся параумбиликально. Расстояние между портом камеры и лобковым симфизом должно составлять примерно 16–18 см. При большем расстоянии у хирурга не будет необходимого доступа к малому тазу. Наложение пневмоперитонеума достигается при помощи иглы Вереша или путем установки оптического порта открытым способом по срединной линии, на 2 см выше пупка по методу Hassaw. Остальные порты вводят под контролем зрения. Все порты устанавливают на расстоянии не менее 9 см друг от друга, чтобы обеспечить достаточное пространство для стыковки с роботом и предотвратить «конфликт» роботических рук. Два 8-миллиметровых порта располагают симметрично, с двух сторон по среднеключичной линии на уровне пупка; третий порт (8 мм) устанавливают в левой подвздошной области по среднеключичной линии, ассистентский порт (12 мм) размещают по передней подмышечной линии на 3 см выше гребня правой подвздошной области (рис. 1). Рабочую консоль робота располагают у ножного конца стола, между ног пациентки. Ассистент хирурга, как правило, располагается справа от операционного стола.
Спорным остается вопрос о необходимости симультанной ампутации матки (удалении тела матки с сохранением ее шейки). В большинстве стран ампутация матки считается стандартной процедурой при коррекции ПТО, несмотря на то что опущение матки является следствием, а не причиной пролапса. Многие женщины отказываются от ампутации матки, аргументируя это желанием сохранить детородную функцию и верой в важную роль матки в получении сексуального удовлетворения. Однако при выраженном опущении матки и отсутствии заинтересованности пациентки в сохранении органа данная процедура может быть выполнена.
 В начале операции рассекают брюшину над куполом влагалища. Следует соблюдать осторожность при выделении матки, стенок мочевого пузыря, чтобы избегать травматических повреждений органов, которые могут приводить к развитию таких осложнений, как мочеполовые свищи, мочевой перитонит, уринома, острый обструктивный пиелонефрит и др. Таким же образом выполняется диссекция между стенкой влагалища и брюшиной. При повреждении стенки влагалища последняя должна быть закрытой несколькими рядами рассасывающихся швов. Повреждения прямой кишки могут произойти при обширном спаечном процессе или при невнимательности хирурга. Различные методы, такие как ограниченная диссекция задней стенки влагалища и ретракция вверх влагалища, помогают избегать этого осложнения.
В начале операции рассекают брюшину над куполом влагалища. Следует соблюдать осторожность при выделении матки, стенок мочевого пузыря, чтобы избегать травматических повреждений органов, которые могут приводить к развитию таких осложнений, как мочеполовые свищи, мочевой перитонит, уринома, острый обструктивный пиелонефрит и др. Таким же образом выполняется диссекция между стенкой влагалища и брюшиной. При повреждении стенки влагалища последняя должна быть закрытой несколькими рядами рассасывающихся швов. Повреждения прямой кишки могут произойти при обширном спаечном процессе или при невнимательности хирурга. Различные методы, такие как ограниченная диссекция задней стенки влагалища и ретракция вверх влагалища, помогают избегать этого осложнения.
После визуализации шейки матки ее тело отсекают с использованием электрокоагуляции. Крестцово-маточные связки, являющиеся важной частью поддерживающего аппарата органов таза, сохраняют. Шейку матки ушивают непрерывным швом викрилом 2–0. Тело матки удаляют из брюшной полости с использованием морцеллятора (рис. 2).
Рассечение крестцового мыса. Крестцовый мыс находится чуть ниже бифуркации общих подвздошных артерий, левая общая подвздошная вена располагается медиальнее, чем артерии, – это важно знать, чтобы избегать ее повреждения при подходе к мысу. Визуализируют мочеточники во избежание их травматизации. После мобилизации сигмовидной кишки послойно рассекают ткани, покрывающие мыс, вплоть до надкостницы крестца. Выделяют примерно 4–5 см его поверхности (рис. 3). При повреждении сосудов малого таза и начинающемся кровотечении необходимо усилить инсуфляцию газа до 20 мм рт.ст. и ушить источник кровотечения рассасывающимися шовными материалами, также можно применять клипсы Hem-o-Lock [22].
Крепление и натяжение сетки. Сетка должна соответствовать основным требованиям, предъявляемым к имплантам: быть легкой, гибкой, пористой [23]. Форма сетки может быть разной, чаще всего она сконфигурирована в форме «Y». Через ассистентский порт в брюшную полость проводят полипропиленовый сетчатый протез. Сетку крепят к стенке влагалища любыми рассасывающимися шовными материалами. Сначала фиксируют переднюю часть сетки, при этом хвост «Y» может располагаться свободно, что позволит в дальнейшем регулировать натяжение сетки. Одно «плечо» Y-образного протеза крепят к задней поверхности шейки матки (рис. 4, а). Аналогично выполняют фиксацию второго «плеча» протеза к передней поверхности шейки матки (рис. 4, б). Оставшуюся часть сетки проводят под мочевым пузырем, в ранее созданном экстраперитониальном тоннеле, на уровне крестцового выступа и фиксируют к надкостнице мыса крестца несколькими швами нерассасывающегося материалы (рис. 4, в).

 Натяжение сетчатого протеза является важным этапом операции. Если она располагается слишком свободно, результаты операции будут неудовлетворительными. Однако, если сетка натянута больше, чем надо, пациентка в последующем будет испытывать дискомфорт и интенсивный болевой синдром. При создании идеального положения сетчатого протеза оперирующему хирургу необходимо зафиксировать последний к надкостнице крестца, подтягивая купол влагалища на уровень крестцового мыса. Швы не должны быть расположены глубоко, чтобы избежать повреждения сосудов. Есть сообщения о возникновении дисцита после выполнения сакрокольпопексии, что обусловлено, по-видимому, нахождением шовного материала в междисковом пространстве [24]. Для предотвращения такой ситуации следует использовать рассасывающиеся монофиламентные материалы. Также дисцит можно предотвращать, избегая наложения швов на дисковое пространство, ориентируясь только на продольную связку, не погружая иглу глубоко. После закрепления сетки ее излишки срезают. Завершающим этапом операции служит экстраперитонизация сетчатого протеза (рис. 5).
Натяжение сетчатого протеза является важным этапом операции. Если она располагается слишком свободно, результаты операции будут неудовлетворительными. Однако, если сетка натянута больше, чем надо, пациентка в последующем будет испытывать дискомфорт и интенсивный болевой синдром. При создании идеального положения сетчатого протеза оперирующему хирургу необходимо зафиксировать последний к надкостнице крестца, подтягивая купол влагалища на уровень крестцового мыса. Швы не должны быть расположены глубоко, чтобы избежать повреждения сосудов. Есть сообщения о возникновении дисцита после выполнения сакрокольпопексии, что обусловлено, по-видимому, нахождением шовного материала в междисковом пространстве [24]. Для предотвращения такой ситуации следует использовать рассасывающиеся монофиламентные материалы. Также дисцит можно предотвращать, избегая наложения швов на дисковое пространство, ориентируясь только на продольную связку, не погружая иглу глубоко. После закрепления сетки ее излишки срезают. Завершающим этапом операции служит экстраперитонизация сетчатого протеза (рис. 5).
Послеоперационные осложнения
Послеоперационные осложнения могут развиваться при любом методе выполнения сакрокольпопексии (см. таблицу). К ним относятся: риск выполнения кольпотомии, цистостомии, травмы мочеточника, энтеротомия, а также протрузии и перфорации сетки. Наиболее распространенным осложнением остается инфекция мочевыводящих путей (МВП) [25].
Клинические результаты
Объективные показатели эффективности лечения. Serati et al. [27], проведя систематический обзор литературы, установили, что 84–10% пациенток полностью восстанавливаются после РАС. В мета-анализе результатов 21 исследования общая частота рецидивов составила 6,4% (3,4, 0,4 и 2,6%, передний, задний и апикальный пролапс соответственно). Частота повторных операций составила примерно 3%, причем в 63,6% это была задняя кольпорафия [28]. Среди 246 пациенток при наблюдении продолжительностью более 24 мес. частота рецидивов апикального пролапса составила 0,8% [29].
Субъективная оценка лечения пациентками. Elliott et al. [30] сообщили, что уровень удовлетворенности операцией пациенток составил порядка 97%, а 96% будут рекомендовать операцию знакомым. Та же группа ученых сообщила о таком показателе эффективности лечения, как отсутствие симптомов пролапса в анкете PFDI-20, в 95% случаев. Другие авторы сообщили о 90–100%-ном уровне субъективного улучшения [31, 32].
Собственные результаты. На кафедре урологии МГМСУ им. А. И. Евдокимова с 2010 по 2016 г. прооперированы 28 больных с пролапсом гениталий (POP-Q – 3–4). Использовалась система da Vinci S/Si (Intuitive Surgical, Inc., Sunnyvale, CA). Продолжительность операции в среднем составила 120 (110–150) мин, кровопотеря – 50 (35–100) мл. Конверсии не было ни в одном наблюдении. Уретральный катетер всем пациенткам удаляли на 2-е сутки после операции. Послеоперационный болевой синдром, в течение 2–3 недель, имел место у 4 (14,3%) пациенток. После контроля самостоятельного мочеиспускания и проведения ультразвукового исследования мочевого пузыря для измерения объема остаточной мочи (в норме <100 мл) пациенток выписывали. Время пребывания в стационаре в среднем составило 3 сут.
Робот-ассистированная сакрокольпопексия по сравнению с открытой. В ретроспективном исследовании Siddiqui et al. сравнивали роботическую (n=198) и открытую (n=413) сакрокольпопексию [33]. Установлено, что объективные и субъективные результаты лечения практически не различались. Так, через год женщины, перенесшие РАС, отмечают схожие симптоматические и анатомические результаты по сравнению с таковыми, перенесшими открытую сакрокольпопексию.
Робот-ассистированная сакрокольпопексия по сравнению с лапароскопической. Шесть исследований. Сравнение традиционной лапароскопии с робот-ассистированной операцией проведено в 6 исследованиях: одном рандомизированном контролируемом [28], одном проспективном [34] и четырех ретроспективных [32–37]. Эти исследования существенно отличаются друг от друга, что делает невозможным объединение результатов. Тем не менее можно отметить близкие объективные и субъективные результаты этих двух операций. Робот-ассистированная, или лапароскопическая, операция может быть расценена как минимально инвазивная методика в лечении апикального пролапса гениталий, однако имеется риск рецидива цистоцеле при наличии множественных дефектов пубоцервикальной фасции [38].
После внедрения во врачебную практику роботических технологий робот-ассистированная хирургия тазового дна заняла определенное место в лечении пролапса гениталий. Выбор РАС зависит от многих факторов: желания пациента, опыта хирурга и возможностей самой клиники. Однако наши данные и результаты мировых исследований указывают на снижение кровопотери и уменьшение сроков госпитализации по сравнению с открытой операцией. В то же время с учетом небольшего количества исследований и разнородности данных требуется дальнейшее изучение этого метода.



