Введение. С болезнями предстательной железы (БПЖ) ассоциировано существенное ухудшение физического и психоэмоционального состояния заболевших мужчин, а также снижение качества их жизни. Согласно данным статистики, за период с 2003 по 2013 г. число мужчин, страдающих БПЖ, увеличилось на 72,4% (с 774 687 до 1 335 188 человек), а количество впервые выявленных случаев БПЖ – на 28,5% (с 214 815 до 276 039). В целом БПЖ составляют 15,3% от всех заболеваний мочеполовой системы [1].
Рак предстательной железы (РПЖ) – одно из наиболее часто регистрируемых злокачественных новообразований у мужчин среднего и пожилого возраста. Ежегодно во всех странах мира суммарное количество новых случаев РПЖ достигает 550–600 тыс. [2]. В России абсолютное количество случаев РПЖ, впервые выявленных в течение 2016 г., составило 34 955, суммарная численность пациентов, которые находились на учете по данному поводу в конце 2016 г., была равной 202 604, т.е. почти в 2 раза больше, нежели в 2010 г. [3].
При ДГПЖ наблюдается повышенная фокальная пролиферация стромальных и эпителиальных периуретральных клеток простаты, что приводит к увеличению объема органа, сдавлению простатического отдела уретры и неповрежденной ткани предстательной железы, появлению и постепенному нарастанию клинической симптоматики заболевания. Субъективные и объективные признаки ДГПЖ неспецифичны и связаны с инфравезикальной обструкцией. Реализация механического и динамического компонентов последней обусловливает нарушение мочеиспускания, ишемизацию и снижение силы сокращений гладкой мускулатуры стенки мочевого пузыря, застой мочи и ее инфицирование, формирование пузырно-мочеточникового рефлюкса. Таким образом, существенно повышается риск инфекционно-воспалительного поражения почечных структур, нарушений мочеобразования, острой задержки мочи [4].
Причиной инфравезикальной обструкции может быть не только доброкачественная пролиферация стромальных клеток простаты, но и ряд других форм патологии, приводящих к подпузырному уменьшению диаметра просвета уретры, например РПЖ, особенно на ранних стадиях его развития. Сходство симптоматики затрудняет дифференциальную диагностику в подобных случаях.
Наличие или отсутствие злокачественного перерождения паренхимы предстательной железы устанавливается в процессе гистологического исследования образцов паренхимы органа, полученных при биопсии. При обнаружении в биопсийном материале признаков РПЖ выполняются патоморфологическое стадирование опухоли, количественная оценка злокачественного поражения простаты, идентификация признаков периневральной инвазии малигнизированных клеток и инвазии семенных пузырьков [2]. Для патоморфологического стадирования РПЖ применяется шкала Глисона [5], детализированная и усовершенствованная на Конференции согласия ISUP (International Society of Urological Pathology) патологов и урологов США и Канады, которая состоялась в Сан-Антонио в 2005 г. В результате была создана модифицированная версия шкалы Глисона, используемая в настоящее время [6].
Для количественной оценки степени злокачественного поражения предстательной железы также необходим биопсийный материал, в котором учитывают общую численность позитивных проб, относительное количество малигнизированной ткани в отдельных столбиках биоптата и всем биопсийном материале в целом, максимальное процентное содержание злокачественно перерожденной паренхимы, абсолютную длину (мм) участка опухолевой ткани в каждом из столбиков.
Полученные данные коррелируют с объемом разрастания, степенью вероятности экстракорпоральной инвазии злокачественных клеток, положительного хирургического края при радикальном оперативном лечении РПЖ и биохимического рецидива после вмешательства [7].

В настоящее время результаты гистологического исследования полученного при биопсии материала предстательной железы остаются главным критерием дифференциальной диагностики доброкачественных и злокачественных поражений паренхимы простаты.
Первичная биопсия показана в следующих случаях: уровень общего ПСА сыворотки крови 4 нг/мл и более или превышение возрастного референсного максимума; наличие признаков нарушения структуры предстательной железы, выявленных при пальцевом ректальном исследовании (ПРИ; зоны уплотнения, узелки, бугристость, повышенная плотность поверхности органа и др.) и/или при трансректальном УЗИ (ТРУЗИ; участки гипо-, гипер- или изоэхогенности, гиперваскуляризации и др.) [8–11].
Определение в сыворотке крови уровня ПСА является в настоящее время обязательным методом диагностики и мониторинга заболеваний предстательной железы, ассоциированных с риском злокачественных или доброкачественных нарушений тканевого роста [2]. Необходимость ПСА-теста у лиц, страдающих хроническим простатитом, ДГПЖ и др., обусловлена тем, что данные расстройства могут быть не основной, а только сопутствующей патологией злокачественного перерождения клеточных структур предстательной железы.
Простатспецифический антиген представляет собой гликопротеид с молекулярной массой 30 кДа. Вещество образуется в клетках эпителиального слоя, выстилающего внутреннюю поверхность стенок ацинусов и канальцев простаты. Он обладает протеазной активностью по отношению к фибринонектину и семиногелинам-1 и -2 – белкам семенной жидкости. Лизирование этих белков – одна из важнейших функций ПСА, направлено на снижение вязкости образующейся спермы. Часть синтезированного ПСА попадает в кровь. Эта часть весьма незначительна у здоровых мужчин и увеличивается при РПЖ, что послужило основанием для использования лабораторных ПСА-тестов в диагностике РПЖ.
По данным Д. Ю. Пушкаря и соавт. (2003), Ю. Г. Аляева и соавт (2007), J. E. Oesterling et al. (1993), физиологически оптимальным уровнем ПСА в сыворотке крови следует считать 0–2,5 нг/мл у 40–49-летних мужчин, 0–3,5 нг/мл – у 50–59-летних, 0–4,5 и 0–6,5 нг/мл у лиц в возрасте 60–69 и 70–79 лет соответственно [13–15].
Существующие затруднения при дифференцировании злокачественных и доброкачественных поражений органа связаны с тем, что повышение сывороточной концентрации ПСА характерно не только для РПЖ, но и для доброкачественных гипербиотических нарушений тканевого роста, острого хронического воспаления паренхимы, ишемии простаты, состояний после ПРИ и др. Интерпретация значений ПСА особенно затруднительна в случаях, когда концентрация данного аналита в сыворотке варьируется от 4 до 10 нг/мл [16].
Для повышения диагностических возможностей ПСА-тестирования в настоящее время применяется его расширенная схема, в которую кроме определения сывороточной концентрации ПСА включена качественная и количественная детекция в сыворотке крови свободной фракции ПСА, а также расчет ряда показателей – плотности ПСА (D ПСА), отношения свободного и общего ПСА (f/tПСА), индекса здоровья простаты (PHI) [16–18].
Цель настоящего исследования: оценить степень соответствия результатов определения показателей ПСА и выявляемости доброкачественных и злокачественных поражений предстательной железы при ее первичной биопсии.
Материалы и методы. Отбор пациентов – участников исследования, выполненного с 15.04.2015 по 18.05.2017, проведен среди мужчин, впервые обратившихся за медицинской помощью в связи с ощущаемыми ими расстройствами мочеиспускания, общей утомляемостью, болевыми ощущениями в надлобковой области или промежности, появлением красноватого окрашивания мочи.
Критериями включения в исследование пациентов с обозначенными выше жалобами считали:
- наличие у них одного из двух или обоих признаков;
- повышение сывороточного уровня ПСА;
- обнаружение структурных изменений в ткани предстательной железы при ПРИ и/или ТРУЗИ.
Добровольно принять участие в исследовании согласились 65 мужчин в возрасте от 47 до 84 лет (медиана – 70 лет).
Сывороточный уровень общего и свободного ПСА определяли в пробах крови, взятых натощак из локтевой вены иммунохемолюминисцентным методом на анализаторе Immulite 2000 XPi (США), применив для этого готовые наборы реагентов для определения ПСА («Siemens Healthcare Diagnostics»).
После этого у всех участников рассчитывали плотность ПСА (D ПСА), у лиц с концентрацией общего ПСА в сыворотке крови от 4 до 10 нг/мл вычисляли PHI и f/t ПСА.
Забор биопсийного материала производили из 10–12 точек в условиях трансректальной ультразвуковой навигации. Для обезболивания применяли местноанестезирующий гель «Катеджель», активными составляющими которого являются хлоргексидина дигидрохлорид и лидокаина гидрохлорид. Для предупреждения инфекционно-воспалительных осложнений использовали антибактериальные препараты фторхинолонового ряда второго или третьего поколения (ципрофлоксацин, левофлоксацин) [19]. Полученный материал направляли на цитологическое исследование, по результатам которого судили о наличии или отсутствии признаков той или иной формы новообразования в ткани предстательной железы.
У всех больных морфологически подтвержденной ДГПЖ проявлениям доброкачественной гиперплазии сопутствовали признаки хронического простатита с умеренной степенью активности, очаговым фиброзом стромального компонента, тенденцией к кистозной трансформации желез.
Для обработки полученных данных применяли методы вариационной статистики, пакет прикладных программ «STATISTICA. 6», содержащихся в «Microsoft Excel 2010». Различия считали значимыми при р<0,05.
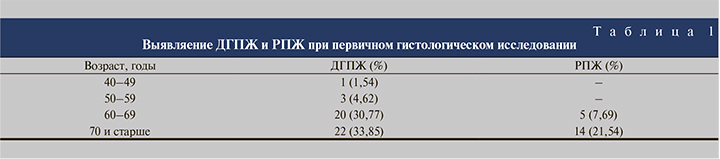
Результаты и обсуждение. РПЖ при первичном гистологическом исследовании, как видно из табл. 1, был выявлен примерно в 30% случаев. Прослеживалась четкая зависимость частоты РПЖ от возраста: данная форма патологии была морфологически верифицированной только для лиц старше 60 лет, причем у пациентов в возрасте 70 лет и старше РПЖ встречался втрое чаще, чем у 60–69-летних обследованных.
Гистологическим вариантом РПЖ во всех случаях была ацинарная аденокарцинома с показателем Глисона, равным 7,39±0,31 (медиана 7). У большинства пациентов (19 человек из 21) с морфологически верифицированным РПЖ одновременно были выявлены сопутствующие ДГПЖ и хронический простатит.
В табл. 2 средние показатели сывороточного уровня ПСА сопоставлены с данными о характере поражения предстательной железы, полученными при первичном гистологическом изучении биоптатов (табл. 2).
Согласно данным, представленным в табл. 2, для пациентов с гистологически подтвержденным ДГПЖ более характерным было варьирование уровня ПСА в сыворотке крови в пределах 2–10 нг/мл, а значение показателя больше 10 нг/мл встречалось в 2 раза реже. У лиц с РПЖ наблюдалась противоположная картина: сывороточная концентрация ПСА превышала 10 нг/мл в 1,7–2,5 раза чаще, чем находилась в пределах 2–10 нг/мл (p>0,05; табл. 2).
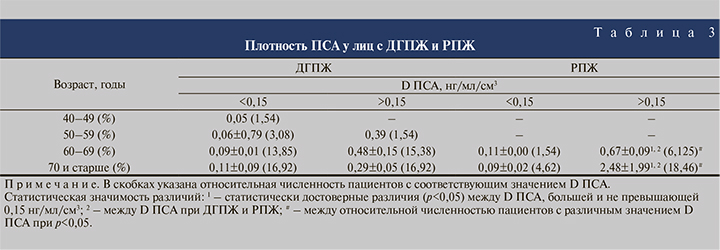
Согласно данным, представленным в табл. 3, на фоне ДГПЖ у 60–69-летних пациентов число случаев с плотностью ПСА (D ПСА) менее 0,15 нг/мл/см3 не отличалось достоверно от такового, когда D ПСА равнялось в среднем 0,48±0,15 нг/мл/см3. В той же возрастной категории у большинства (6,125%) лиц с РПЖ значение показателя в 4,47 раза превысило 0,15 нг/мл/см3 (р<0,05).
У 12 из 14 больных РПЖ старше 70 лет величина D ПСА составила 2,48±1,99 нг/мл/см3, что в 5 раз больше плотности ПСА при ДГПЖ и в 16 раз выше 0,15 нг/мл/ см3 (р<0,05).
В нашем исследовании было установлено, что у 35 (55,38%) пациентов концентрация общего ПСА сыворотки варьировалась в диапазоне 2–10 нг/мл (образно называемом «серой зоной»).
Об аналогичных результатах лабораторного обследования пациентов, выполненного после первого обращения за медицинской помощью, сообщалось в публикациях многих авторов [20–26].
К важнейшим выводам исследователей относятся следующие: во-первых, при изучении биопсийного материала ткани ПЖ у лиц с концентрацией общего ПСА сыворотки от 2 до 10 нг/мл степень выявляемости признаков злокачественного перерождения эпителиоцитов органа весьма низкая (менее 30 %); во-вторых, результаты подобного рода вносят существенные затруднения в разработку плана дальнейшей курации пациентов. Эти затруднения связаны, в частности, с сомнениями в необходимости первичной биопсии ПЖ с учетом отмеченной выше низкой результативности последней [22].
В таких случаях, как подчеркивают ряд авторов [20–26], важное значение имеет определение значений расчетных показателей – PHI и f/t ПСА, отличия которых от определенных пороговых величин позволяют обосновать целесообразность биопсии и гистологического изучения образцов ткани ПЖ у мужчин с жалобами на расстройства мочеиспускания, общие и/или местные проявления интоксикации и другие симптомы наличия новообразования в предстательной железе.
В настоящее время пороговым значением PHI считается 25. Во многих публикациях подчеркивается важность сопоставления PHI с этой величиной и отмечается весьма устойчивая связь между характером поражения (доброкачественное или злокачественное) и значением индекса – бо́льшим или меньшим, чем 25 [15, 18, 22, 23, 27–29].
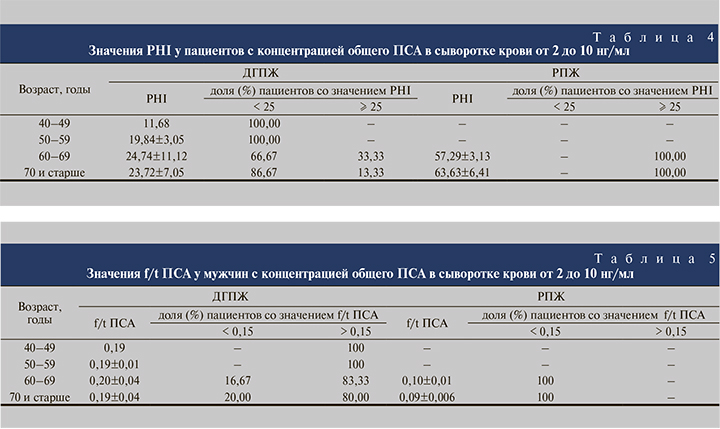
В ходе нашего исследования установлено, что во всех возрастных группах у пациентов с сывороточным уровнем общего ПСА от 2 до 10 нг/мл морфологически верифицированная ДГПЖ чаще была ассоциирована с величиной PHI, не превышавшей 25 (табл. 4). Рак предстательной железы был гистологически подтвержден у 9,23% пациентов-участников с концентрацией общего ПСА в сыворотке от 2 до 10 нг/мл. Во всех случаях значение PHI превышало 25 в 2–2,5 раза.
За пороговую величину f/t ПСА в настоящее время принимается 0,15. Отмечены тенденция к превышению порога у лиц с доброкачественными заболеваниями простаты и сниженные значения показателя при злокачественном перерождении ткани железы [21].
В настоящей работе, согласно данным табл. 5, в случаях с гистологически подтвержденной ДГПЖ показатель f/t равнялся в среднем 0,19±0,01–0,20±0,04, превысив пороговый уровень (0,15) у 4 из 5 мужчин в возрасте старше 60 лет и у всех участников от 47 до 59 лет. Отношение свободного и общего ПСА у пациентов с РПЖ составило 0,09±0,006–0,10±0,01.
Выводы
- При первичном гистологическом исследовании, выполненном в связи с повышением в сыворотке крови уровня общего ПСА, РПЖ выявляется примерно в 30% случаев.
- Возраст мужчин от 60 лет и старше следует расценивать как фактор риска злокачественного перерождения ткани простаты. Вероятность малигнизации эпителиоцитов предстательной железы у мужчин старше 70 лет выше, чем у 60–69-летних.
- Плотность ПСА при морфологически верифицированном РПЖ статистически значимо превышает таковую у мужчин с ДГПЖ и пороговое значение показателя в 85% случаев.
- Определение PHI и f/t ПСА позволяет повысить точность прогнозирования злокачественного поражения простаты, корректировать показания к гистологическому исследованию, снизить частоту неоправданных биопсий.
- Для уточнения показаний к первичной биопсии предстательной железы в случаях с варьированием концентрации ПСА в сыворотке крови от 2 до 10 нг/мл требуется определение дополнительных расчетных показателей – плотности ПСА, индекса здоровья простаты, отношения свободного и общего ПСА.



