Актуальность. Гипоспадия – один из самых распространенных пороков развития мочеиспускательного канала у мальчиков и встречается в среднем у 1:125–1:150 новорожденных мальчиков [1, 2].
Предложено более 300 различных операций, несмотря на это, требующий хирургического лечения, этот порок не получил своего окончательного разрешения и до сих пор остается актуальной проблемой детской урологии, а частота уретра-дермальных фистул (УДФ) в раннем и отдаленном послеоперационном периодах остается довольно высокой, достигая 30–48% [3–5].
Каждый вид вмешательства дает определенное число осложнений, что требует пересмотра лечебной тактики и решения данной проблемы. Одной из частых причин УДФ является попадание мочи в операционную рану и скопление тканевой жидкости вокруг и внутри неоуретры [6–8].
Не вызывает сомнений, что для предупреждения развития инфекции и усиления регенераторной способности ткани наибольшее значение имеет разработка методик, препятствующих попаданию мочи в неоуретру, и способа местного воздействия на неоуретру посредством различных лекарственных препаратов [9–10]. Данной проблеме уделяется мало, и анализ литературы показал, что за последние 10 лет достоверных данных по данной патологии недостаточно.
Целью настоящего исследование стало сравнение результатов лечения послеоперационных осложнений при гипоспадии у детей.
Материалы и методы. На базе кафедры детской хирургии ТашПМИ в период с 2010 по 2018 г. по методике одноэтапной балапениальной неоуретропластики прооперированы 123 ребенка с различными формами гипоспадии в возрасте от 6 мес. до 16 лет. Всем больным оперативное вмешательство выполнялось впервые. У всех пациентов для дренирования мочевого пузыря и неоуретры использовали обтурационно-дренирующий промывающей катетер (ОДПК) собственной конструкции [11]. У пациентов контрольной группы (n=63) для промывания неоуретры использовали раствор хлоргексидина или диоксидина (0,5–1%) объемом 4–5 мл, медленно вводили через промывающий микрокатетер (см. рисунок). Основной группe (n=60) неоуретру промывали раствором диоксидина (0,5–1%) объемом до 4–5 мл, через 25–30 мин в просвет неоуретры через микрокатетер вводили 0,02%-ный водный раствор антиоксиданта дибунола, способствующий усилению процесса местной регенерации.
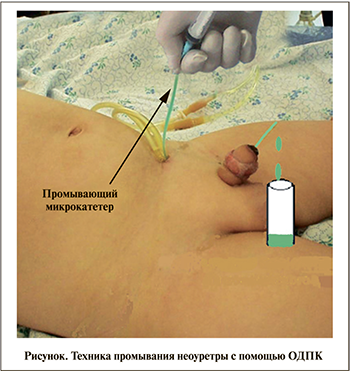 В 1-е сутки после операции канал неоуретры через микрокатетер промывали антисептическими растворами. При этом слизь и детрит кожи через множественные отверстия катетера эвакуировались кнаружи. Основную группу составили 60 пациентов, им тоже перед выполнением уретропластики в мочевой пузырь установили ОДПК.
В 1-е сутки после операции канал неоуретры через микрокатетер промывали антисептическими растворами. При этом слизь и детрит кожи через множественные отверстия катетера эвакуировались кнаружи. Основную группу составили 60 пациентов, им тоже перед выполнением уретропластики в мочевой пузырь установили ОДПК.
Применение ОДПК практически полностью исключает возможность попадания мочи в просвет неоуретры в послеоперационном периоде.
В послеоперационном периоде наряду с общепринятыми методами лечения проведена местная обработка неоуретры 0,02%-ным водным раствором антиоксиданта дибунола, способствующим усилению процесса местной регенерации [12] (см. рисунок).
Определение в элюате уровня тиобарбитуровой кислоты-активных продуктов (ТБК-АП) при спонтанной генерации ВРФК проводили по методу И. Д. Стальной и соавт. [13].
Измерение концентрации ТБК-АП в индуцируемых системах: аскорбатзависимой и НАДФН-зависимой генераций ВРФК проводили по методу Ю. И. Губского [14]. Количество ацилгидроперекисей (АГП) липидов оценивали по методу В. В. Гаврилова, М. И. Мишкорудной (1983). Через проксимальный конец промывающего катетера (см. рисунок) вводится 10 мл физиологического раствора, элюат выделяется наружу, собирается в стерильную пробирку и направляется в лабораторию.
Изучение активности супероксиддисмутазы проводили по методу P. H. Mirsa, I. Fridovich [15] в модификации О. С. Брусова и соавт. Антипероксидную активность (АПА) элюата оценивали по его способности разрушать 1%-ный раствор перекиси водорода в условиях in vitro при 37°С в течение 1 ч. Количество оставшейся перекиси водорода определяли пергманганатометрическим методом М. А. Королюк и соавт. (1988). Фракцию пептидов средних молекул в элюате (СМП) определяли спектрофотометрически по методу Н. И. Габриэлян и В. И. Липатовой [16]. На 2–5–8-й дни послеоперационного периода проведены биохимические исследования элюата раневой поверхности. Полученные данные обрабатывались с помощью приложения MS Excel. По таблице Стьюдента определяли вероятность ошибки (Р), соответствовавшую данному числу наблюдений и значению достоверного интервала (M±SD. Различия между сравниваемыми величинами признавались доставерными при p<0,05.

Результаты и обсуждение. Результаты обследования больных контрольной группы представлены в табл. 1. Получившие лечение традиционным способом, которым произведена одноэтапная неоуретропластика, были включены в контрольную группу. Им на 2–5–8-й дни после операции проводились биохимические исследования элюата. В основной группе исследование проводили в аналогичные сроки. Содержание свободного малонового диальдегида (СМДА) в элюате имело только тенденцию к снижению (р>0,05). Снижение уровня аскорбатзависимой генерации высокореакционных форм кислорода (АЗГВРФК) к 8-му дню носило статистически значимый характер (p<0,05), а НАДФН-зависимая генерация высокореакционных форм кислорода (НЗГВРФК) в элюате больных контрольной группы также имела тенденцию к снижению (табл. 3).
Важно отметить, что интенсивность генерации ВРФК в спонтанном состоянии и при инициировании аскорбатом и НАДФН различна по уровню. Соотношение СМДА/АЗГ, СМДА/НЗГ и АЗГ/НЗГ были соответственно равны 0,25; 0,014 и 0,025, что свидетельствует о наибольшем инициировании ВРФК ферментативным путем. Видимо, это связано с вымыванием активаторов генерации НЗГВРФК при восстановлении тканей после балапениальной неоуретропластики.
Известно, что в процессе взаимодействия высокореактивных форм кислорода и липидных молекул образуются промежуточные продукты окисления ацилгидропероксиды (АГП). В структуре молекул ненасыщенных жирных кислот имеются двойные связи, служащие мишенью для ВРФК. Количество АГП пересчитывается на количество липидов. В контрольной группе на 2-е и 5-е сутки отмечено высокое содержание АГП (в пределах 0,067–0,064 Е/мг липидов). В результате традиционной терапии наблюдалось недостоверное снижение уровня АГП к 8-му дню в 1,10 раза относительно исходного (p>0,05).
В контрольной группе образование УДФ констатировали у 11 (17,4%) пациентов (табл. 1). Увеличение содержания в элюате продуктов взаимодействия ВРФК с молекулами липидной и белковой природы привело к росту количества низкомолекулярных токсичных компонентов в элюате, что, несомненно, отразилось на состоянии АПА.
Таким образом, исследование в элюате накопления продуктов взаимодействия ВРФК с молекулами белковой и липидной природы показало различную интенсивность и направленность изменений. Необходимость включения антиоксиданта в лечение больных с гипоспадией в послеоперационном периоде прежде всего связана с увеличением в элюате количества токсических продуктов, обладающих цитостатическим и цитотоксическим действиями.
Использование дибунола при орошении неоуретры у больных основной группы привело к снижению генерации ВРФК. Данный способ обработки послеоперационного поля после неоуретропластики использован в отношении 60 детей На 5-й день после операции содержание СМДА в элюате снизилось относительно исходного уровня в 1,2 раза (p<0,05). Исходный уровень генерации ВРФК у больных контрольной и основной групп был сопоставимым. Подобное было характерно и для других показателей элюата. Содержание СМДА в элюате основной группы на 8-е сутки снизилось относительно исходного уровня в 1,88 раза (p<0,01).
В результате применения предлагаемого способа лечения у больных основной группы отмечалось достоверное снижение генерации АЗГ ВРФК в элюате, которое к 8-му дню после операции было ниже исходного уровня в 2,15 раза (p<0,05) (табл. 4). Интенсивность НЗГВРФК в элюате основной группы исходно была сопоставимой с показателями контрольной группы.
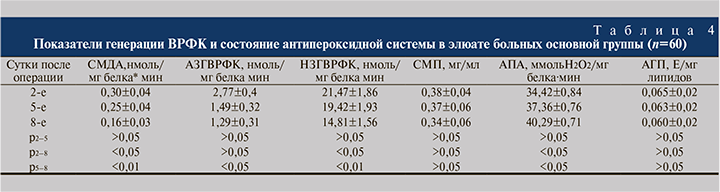
Однако в динамике лечения в элюате при индуцировании ферментзависимой генерации НЗГВРФК накопление продуктов свободнорадикального окисления было значительно меньше и на 8-й день лечения оно было ниже исходного уровня в 1,45 раза (р<0,01). Важно отметить, что увеличение количества продуктов взаимодействия ВРФК с молекулами белковой и липидной природы сопровождалось ответной компенсаторной реакцией системы АП (антипероксидантной) защиты. Активность АП защиты относительно исходно уровня к 5-м и 8-м суткам выросла в основной группе соответственно в 1,09 и 1,17 раза (р<0,05).
Позитивное воздействие проявлялось снижением частоты формирования УДФ с 17,4 до 6,6%. Отмеченные результаты привели к уменьшению потребности в повторных оперативных вмешательствах в 2,6 раза (табл. 2).
Таким образом, включение в протокол традиционного способа лечения промывания неоуретры раствором водорастворимого АО привело к снижению генерации ВРФК и увеличению мощности АПА.
Выводы
1. Основная причина образования УДФ после одноэтапной неоуретропластики – это скопление детритов кожи, сгустков крови, а также продуктов взаимодействия высокореактивных форм кислорода, снижающих регенерацию тканей неоуретры.
2. Использование способа промывания неоуретры и водорастворимого антиоксиданта дибунола для местной обработки внутренней поверхности ее снижает генерацию АФК, усиливает регенеративные процессы, что снижает частоту формирования УДФ с 17,4 до 6,6%, т.е. в 2,6 раза.



