Введение. Одной из распространенных задач в практике оперирующего уролога является выбор метода дренирования верхних мочевыводящих путей. Мочеточниковые стенты используются как для временного, так и для длительного дренирования верхних мочевыводящих путей при обструкции, вызванной мочекаменной болезнью либо злокачественными новообразованиями [1, 2]. Этот тип дренирования является методом выбора, несмотря на все возможные осложнения, связанные с использованием данного типа дренажей. Инкрустация стентов и образование биопленок на их поверхности способствуют длительной персистенции инфекции мочевыводящих путей [3]. Стент-ассоциированные инфекции являются одними из самых распространенных (от 25 до 40%) внутрибольничных инфекций [4, 5].
Агрегация кристаллических отложений происходит как на поверхности стентов, так и в развивающейся бактериальной биопленке. Это приводит к образованию кристаллических бактериальных биопленок с накоплением множества микроорганизмов, встроенных в матрицу из метаболитов и кристаллизованных компонентов мочи [6].
Кристаллические формации на поверхности катетера блокируют его просвет, приводя к несостоятельности его дренажной функции, вызывая гипертензию в вышележащих отделах мочевыводящих путей, повышая риск возникновения пиелонефрита, сепсиса и инфекционно-токсического шока [7]. Все доступные типы катетеров уязвимы для этой проблемы, и в настоящее время нет эффективных методов для ее предотвращения или контроля [8]. Создание новых материалов для изготовления мочеточниковых стентов и покрытий, наносимых на их поверхность, существенно ограничено такими требованиями, как легкость установки, рентгенконтрастность, сочетание достаточной для комфортного нахождения в организме мягкости со способностью поддерживать заданные просвет и структуру, устойчивость к миграции, биологическая инертность, резистентность к инкрустации и контаминации микрофлорой, способность сохранять вышеуказанные свойства в течение всего срока дренирования [9]. Результаты тестирования многочисленных типов катетеров in vitro и in vivo остаются весьма противоречивыми. Мочеточниковый стент с идеальными свойствами до сих пор не создан. В связи с этим исследование эффективности применения методов с использованием физической энергии для воздействия на мочеточниковый стент является малоизученным и перспективным вопросом.
Цель исследования: оценка эффективности и безопасности применения экстракорпорального акустического воздействия ультразвуковым амплитудно-модулированным сигналом для профилактики инкрустации мочеточниковых стентов в хроническом эксперименте.
Материалы и методы. В качестве экспериментальных животных использованы 10 половозрелых беспородных собак (самки) средним весом 18,64±1,44 кг в возрасте от 3 до 4 лет без признаков травматических повреждений и соматических заболеваний.
Животных содержали в отдельном помещении в металлических клетках в условиях регулируемого искусственного освещения, температура воздуха составляла в среднем 25°С, собаки получали полнорационный корм и питьевую фильтрованную воду без ограничений. Условия содержания животных и порядок работы с ним строго соответствовали положениям, принятым Европейской конвенцией по защите позвоночных животных, используемых для исследовательских и иных научных целей, Федерацией европейских ассоциаций по науке о лабораторных животных, Международным советом по науке о лабораторных животных, законодательству Российской Федерации. Исследование получило одобрение локального этического комитета Омского государственного медицинского университета (протокол № 107 от 02.10.2018).
Все животные выдержали карантин в течение 5 сут., были предварительно обследованы на наличие инфекции мочевыводящих путей (общий анализ мочи, посев мочи на микрофлору с определением чувствительности к антибактериальным препаратам).
После премедикации (сульфат атропина – 0,1 мг/кг подкожно) и общей анестезии (Propofol 1%, 10 мг/кг, в/в; Zoletil 100, 8 мг/кг, в/в) животным выполняли нижнесрединную лапаратомию. Тупым путем выделяли мочевой пузырь от окружающих тканей и поднимали его на двух держалках. По передней стенке мочевого пузыря осуществляли продольный разрез длиной 3 см, не повреждая шейки. Далее визуализировали устья правого и левого мочеточников. В устье левого мочеточника вводили струну-проводник, достигая полостной системы левой почки. По ней в устье левого мочеточника устанавливали мочеточниковый полиуретановый стент 5 CH длиной 20 см. Пальпаторно контролировали корректность установки стента в просвете мочеточника и лоханке левой почки. Аналогичным образом стентировали правый мочеточник (рис. 1). Ушивали мочевой пузырь непрерывным двурядным швом. Послойно накладывали швы на лапаротомную рану. Обрабатывали кожные швы раствором бриллиантовой зелени. Накладывали асептическую повязку, бандаж.
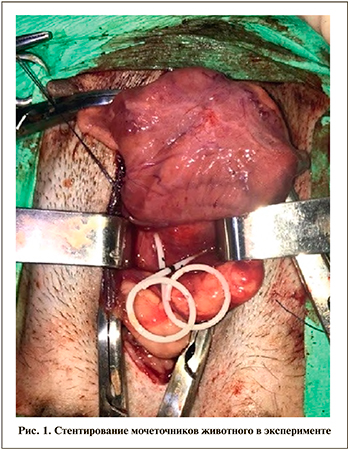
После выполненной операции животным вводили раствор Цефтриаксона 40 мг/кг внутривенно 1 раз в день в течение 7 сут., а также назначали симптоматическую терапию.
На 7-е, 14, 21 и 28-е сутки контролировали лабораторные показатели крови и мочи, выполняли УЗИ мочевыводящих путей. На 10-е и 28-е сутки выполняли бактериологическое исследование мочи.
Коллективом авторов был рассчитан, спроектирован и изготовлен ультразвуковой генератор, основным принципом работы которого служила генерация амплитудно-модулированного ультразвукового сигнала (рис. 2, А), рабочая часть которого выполнена в виде плоского диска диаметром 30 мм из титанового сплава ВТ3-1 (рис. 2, Б). Излучатель конструктивно размещен в корпусе типа «пистолет». Физические характеристики ультразвукового воздействия: Am – 10 мкм, f – 20 кГц, мощность –30 Вт [10].
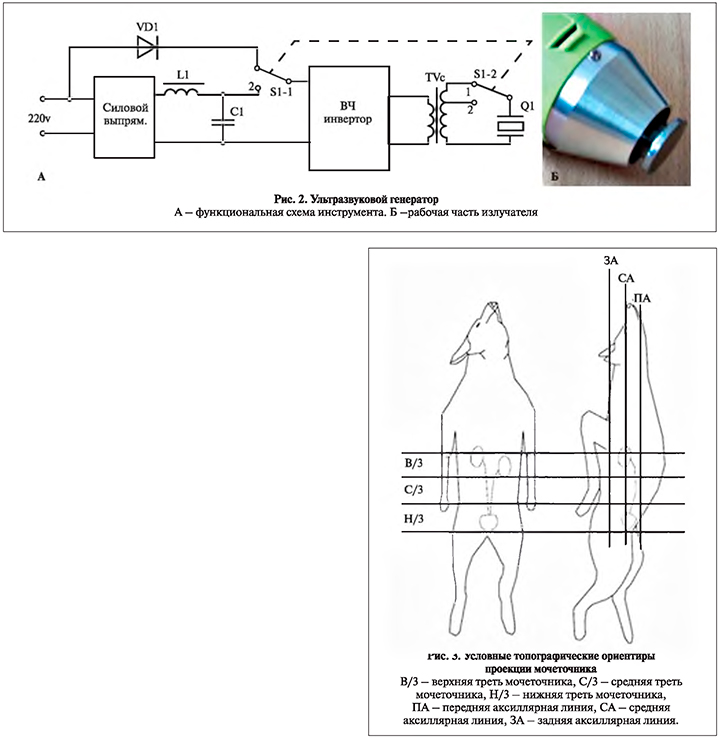
Начиная с 7-х суток послеоперационного периода животным с помощью аппарата после предварительного нанесения акустического геля производили экстракорпоральное акустическое воздействие над анатомической проекцией расположения левого мочеточникового стента по ранее определенным оптимальным точкам в импульсном режиме в течение 15 мин 3 раза в неделю: в верхней трети мочеточника по задней подмышечной линии, в средней трети мочеточника по задней подмышечной линии, в нижней трети по средней подмышечной линии (рис. 3) [11]. Правый мочеточниковый стент оставался интактным.
По истечении 28 сут. эксперимента животные подвергались повторному оперативному вмешательству. Производили нижнесрединную лапаротомию, мочевой пузырь вскрывали для удаления обоих мочеточниковых стентов. Ушивали мочевой пузырь непрерывным двурядным швом. Далее выполняли резекцию участков правого и левого мочеточников длиной 1 см с последующим наложением анастомоза по типу «конец в конец». В последующем выполняли резекцию участка нисходящего отдела толстой кишки, находящегося в проекции акустического воздействия, длиной 5 см с дальнейшим формированием анастомоза по типу «бок в бок». Выполняли контроль гемостаза. Рану ушивали послойно. Обрабатывали кожные швы раствором бриллиантовой зелени. Накладывали асептическую повязку, бандаж.
Для оценки безопасности воздействия амплитудно-модулированным ультразвуковым сигналом на стенки мочеточника и толстой кишки проводили их морфологическое исследование.
Резецированные участки правого и левого мочеточников, толстой кишки извлекали и фиксировали в 10%-ном р-ре формалина в 0,1 М-ном фосфатном буфере при рН 7,2–7,4. Материал хранили в холодильнике, через сутки раствор полностью заменяли. Фиксатор изготавливали в лаборатории кафедры патологической анатомии ОмГМУ. Полученный материал заключали в парафин. Затем изготовляли серийные поперечные срезы толщиной 1–4–7 мкм для морфологического исследования с помощью светового микроскопа Leica DM4000B, фотокамеры Leica DFC295 (Leica, Германия).
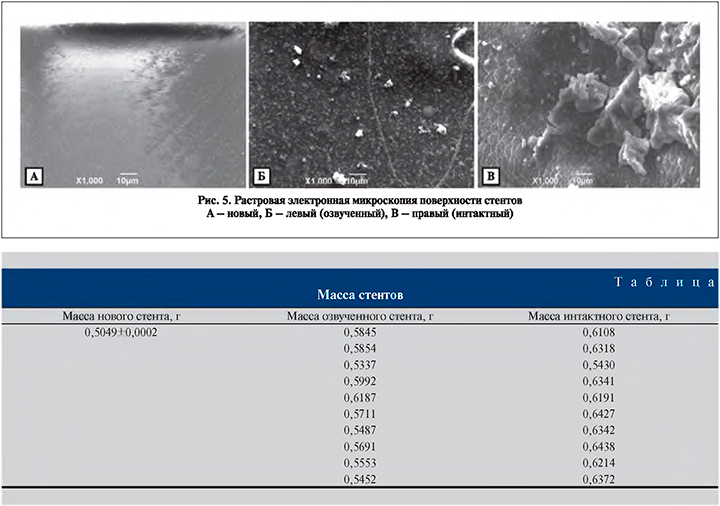
После извлечения правого и левого мочеточниковых стентов измеряли их массу, затем помещали в стерильные контейнеры, для последующего изучения состояния их внутренней поверхности методами сканирующей зондовой микроскопии (СЗМ) на зондовой нанолаборатории NTEGRA Prima (NT-MDT, Нидерланды) и растровой электронной микроскопии (РЭМ) на электронном микроскопе JEOLJCM-5700 (JEOL Ltd., Япония).
При РЭМ изображение формируется при сканировании пучка, подобно растру электронно-лучевой трубки с последующей передачей сигнала от детектора электронов на экран. Топография образца исследуется с использованием вторичных электронов (SEI).
В основе метода СЗМ лежит взаимодействие исследуемого образца с зондом – кантилевером. Применяли прерывисто-контактный метод. Его суть заключается в регистрации сил межатомного взаимодействия между исследуемой поверхностью мочеточникового стента и колеблющимся на резонансной частоте зондом, представляющим собой механическую иглу, закрепленную на конце кантилевера. В полуконтактном режиме зонд входит в физический контакт с поверхностью в нижней части своей траектории, постукивая поверхность. В процессе сканирования образца электронная подсистема СЗМ регистрирует вертикальные перемещения кантилевера и реконструирует рельеф поверхности. При обработке данных использовали методы непараметрической статистики. Данные представлены в виде M±m, где M – среднее значение, m – стандартная ошибка среднего.
Результаты. Осложнений в послеоперационном периоде не наблюдали. Последний был сопоставимым с течением послеоперационного периода у человека. Субфебрильная лихорадка уходила к третьим суткам. Макрогематурия купировалась в течение 5 дней (реакция на цистотомию). Лейкоцитоз наблюдали в течение недели. Лейкоцитурия и микрогематурия присутствовали перманентно, но на фоне акустического воздействия не усугублялись. Это можно расценивать как реакцию на постоянное нахождением инородного тела в просвете мочевого пузыря. Атак пиелонефрита не наблюдали. Культуры бактерий в посевах мочи высеяно не было. Лишь в двух случаях при бак-посеве материала с поверхности интактного стента высеяны культуры Е. coli•102 и E. faecalis •102.
Внешний вид стентов после из извлечения существенно отличался. Правый стент (интактный) оказался более темным, нежели левый (рис. 4).

После извлечения средний вес озвученного стента составлял 0,5711±0,0264 г, интактного – 0,6218±0,0296 (р – 0,0022497) (см. таблицу).
На поверхности озвученного стента отмечены солевые отложения, но этот массив относительно «нежный», рыхлый, фрагментарно повторяет технологиченскую исчерченность нового стента, что свидетельствует о небольшой толщине инкрустации. На поверхности интактного стента исчерченность потеряна, отчетливо видны образования грубой монолитной структуры с выраженными дефектами рельефа (рис. 5).
При СЗМ на поверхности нового стента высота технологических неровностей составила 0,15±0,02 мкм (рис. 6, А). На озвученном стенте средняя высота наложений составила 0,2382±0,0988 мкм, при том что средняя высота максимальных пиков составила 0,8564±0,5013 мкм (рис. 6, Б). На интактном же средняя высота была значительно больше, превысив почти в 5 раз, и достигала 1,2470±0,6559 мкм, в то время как средняя высота максимальных пиков составила 3,1021±1,3844 мкм (рис. 6, В).

При проведении морфологического исследования стенки мочеточников в поперечных срезах изучаемого материала на стороне воздействия отмечено следующее: гистоархитектоника сохранена, слои стенки мочеточника хорошо дифференцируются, отмечаются пролиферация и слабые дистрофические изменения слизистой оболочки, единичные участки десквамации эпителия, дефекты слизистой оболочки с очагами кровоизлияний, но без признаков воспаления в данных зонах (соответственно, данные дефекты сформировались, вероятнее всего, интраоперационно). В подслизистом слое вдоль собственной пластики слизистой оболочки определяется скудная лимфоцитарная инфильтрация в виде единичных малых лимфоцитов. В сосудах капиллярного типа определяются единичные лейкоциты (рис. 7, Б).
В стенке интактного мочеточника обнаружены более выраженные дистрофические изменения, пролиферация с участками десквамации уротелия с эрозивными дефектами. Отмечается воспалительный инфильтрат с признаками хронического воспаления, единичными макрофагами, зрелыми и пролиферирующими фибробластами (рис. 7, В).
Степень повреждении уротелия с обеих сторон была сопоставимой, и на стороне воздействия ультразвуковым сигналом выявленные изменения не усугублялись.
Особого внимания заслуживает неравномерное утолщение стенки мочеточника на стороне воздействия амплитудно-модулированным ультразвуковым сигналом за счет гипертрофии продольных и циркулярных гладкомышечных волокон.
При выполнении морфологической оценки биоптатов толстой кишки, находившейся в проекции неинвазивного акустического ультразвукового воздействия, гистологических признаков альтерации не выявлено.
Обсуждение. Проблема инкрустирования мочевых дренажей и формирования биопленок на их поверхности не утратила своей актуальности. Перманентно ведется множество исследований по поиску эффективного способа профилактики развития данных осложнений. Ведущими векторами служат разработка новых биоинертных полимеров, нанесение различных покрытий на поверхность дренажа, создание биоразлагаемых изделий [12–15]. Потенциально перспективным является использование физической энергии для воздействия на мочевой дренаж. Основная масса предложенных вариантов такого типа воздействия реализуется контактно, что и сдерживает их применение в отношении мочеточниковых стентов [16, 17]. Потенциал применения ультразвуковой энергии для санации мочевых дренажей убедительно продемонстрирован в единичных экспериментальных работах. Точка, находящаяся в звукопроводящей среде под действием ультразвуковой волны, подвергается попеременно сначала сжатию, а следом разрежению. Давление в среде в момент сжатия является положительным, а в момент разрежения становится отрицательным. При переходе из зоны положительного в зону отрицательного давления возникает явление кавитации – «взрыв» вакуумных кавитационных пузырьков микронного размера в большом количестве, вызывающий ударную волну. Механизм ультразвуковой очистки поверхности дренажа обусловлен воздействием ударной волны, возникающей в результате кавитации пузырьков жидкости, которые проникают в щели и поры между загрязнениями и поверхностью катетера [18]. Большая часть исследований касалась контактного воздействия на уретральный дренаж. Контактное воздействие на мочеточниковый стент более трудоемко, что является важным сдерживающим фактором. Исходя из этой предпосылки разработан способ неинвазивного акустического воздействия ультразвуковым амплитудно-модулированным сигналом на поверхность мочеточникового стента [8]. Результаты его применения иллюстрирует проведенное экспериментальное исследование. Эффективность подтверждается большей массой интактных стентов по сравнению с теми образцами, которые подвергались акустическому воздействию. Выраженные различия в массе стентов объясняются тем, что на поверхности интактных образцов наблюдается формирование более грубых инкрустаций, отчетливо продемонстрированных результатами растровой электронной микроскопии. Стенты, подвергнутые акустическому воздействию ультразвуковым амплитудно-модулированным сигналом на своей поверхности, содержали меньшее количество солевых отложений. Кроме того, по результатам сканирующей зондовой микроскопии их высота была ниже, чем таковая солевых отложений на поверхности интактных стентов.
Безусловно помимо эффективности важным этапом экспериментального исследования является оценка безопасности применения экстракорпорального акустического воздействия ультразвуковым амплитудно-модулированным сигналом для мочеточника. В результате морфологического исследования обнаружено, что за исключением слабовыраженной десквамации и дистрофии эпителия (связываем с фактом наличия мочеточникового стента в просвете мочевыводящих путей) тяжелых повреждений мочеточника не выявлено. В определенной мере для исследователей было неожиданным выявление гипертрофии мышечных волокон мочеточников на стороне акустического воздействия. Эту метаморфозу связываем с рефлекторным усилением перистальтики при вибрации инородного тела в просвете мочеточника под действием ультразвукового амплитудно-модулированного сигнала. Из чего считаем возможным предположить, что обнаруженная гипертрофия мышечных волокон служит дополнительным фактором улучшения пассажа мочи по мочевыводящим путям, что также может способствовать санации мочеточникового стента.
Выводы. В результате ранее проведенной работы мы убедились в том, что на поверхности новых стентов исходно имеются дефекты рельефа небольшого размера, расположенные стройными рядами, что, по-видимому, связано с технологией производства [19]. Неинвазивное акустическое воздействие ультразвуковым амплитудно-модулированным сигналом на поверхность мочеточникового стента является эффективным и безопасным способом профилактики инкрустации мочеточниковых стентов, а также требует дальнейшего изучения и адаптапции к клинической практике.



