Экстрофия мочевого пузыря (ЭМП) представляет собой сочетание ряда пороков, включающих дефект мочевого пузыря, уретры, наружных половых органов, опорно-двигательного аппарата [1–4].
По статистике ЭМП выявляется у 1 на 40 тыс.–50 тыс. новорожденных и приблизительно в 2–3 раза чаще встречается у мальчиков [5, 6]. Диагноз ЭМП ставится сразу после рождения либо на этапе внутриутробного развития. Хирургическое лечение многоэтапное и проводится в раннем детском возрасте. Основной целью коррекции данного заболевания является обеспечение резервуарного накопления и удержания мочи, а также реконструкция полового члена. Однако даже после удачного решения поставленных задач к моменту полового созревания достигнуть нормальных размеров полового члена не всегда возможно и, как правило, к 15–18 годам длина полового члена составляет не более 7 см, что не позволяет определить анатомические параметры полового члена как нормальные и удовлетворяющие принятым сексуальным стандартам. Следовательно, проведение реконструкции по поводу ЭМП в детском возрасте не гарантирует удовлетворительных размеров и конфигурации половых органов в период половозрелости [7–9].
Представляем наш опыт комплексной анатомо-физиологической пенильной реабилитации пациента с врожденной аномалией развития мочеполовой системы.
Пациент 18 лет в 2016 г. госпитализирован в клинику ФГБУ ГНЦ ФМБЦ им. А. И. Бурназяна ФМБА России с диагнозом «врожденная аномалия развития мочеполовой системы: микрофаллия, мошоночная гипоспадия».
 В анамнезе: 20.02.1999: уретропластика, сфинктеропластика по Державину; 13.06.2002: реуретропластика; 05.07.2004: корригирующая остеотомия таза, пластика шейки мочевого пузыря, двусторонняя орхипексия; 19.07.2007: ортопластика полового члена; 01.11.2010: пластика шейки мочевого пузыря, цистостомия; 01.06.2011: реорхипексия с двух сторон; 07.05.2013: фаллопластика, цистостомия; 19.03.2014: иссечение дивертикула уретры.
В анамнезе: 20.02.1999: уретропластика, сфинктеропластика по Державину; 13.06.2002: реуретропластика; 05.07.2004: корригирующая остеотомия таза, пластика шейки мочевого пузыря, двусторонняя орхипексия; 19.07.2007: ортопластика полового члена; 01.11.2010: пластика шейки мочевого пузыря, цистостомия; 01.06.2011: реорхипексия с двух сторон; 07.05.2013: фаллопластика, цистостомия; 19.03.2014: иссечение дивертикула уретры.
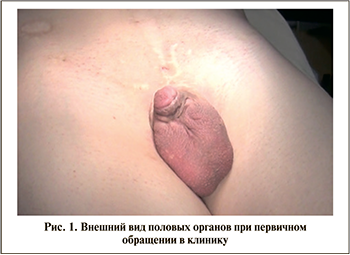
При поступлении: половые органы сформированы по мужскому типу, деформированы с дефицитом тканей. Размер полового члена – 3 см (микрофаллия), размеры в состоянии возбуждения не меняются. Наружное отверстие уретры располагается в области пеноскротального угла. Органы мошонки: яички в полости мошонки, справа и слева яички тугой консистенции, придатки и канатики не изменены (рис. 1).
По результатам осмотра были поставлены следующие задачи:
1. Формирование адекватных размеров полового члена.
2. Реконструкция мочеиспускательного канала после фаллопластики с восстановлением уретрального мочеиспускания.
3. Восстановление копулятивных возможностей.
Первым этапом 20.07.2016 был сформирован неофаллос торакодорсальным лоскутом на микрохирургических анастомозах.
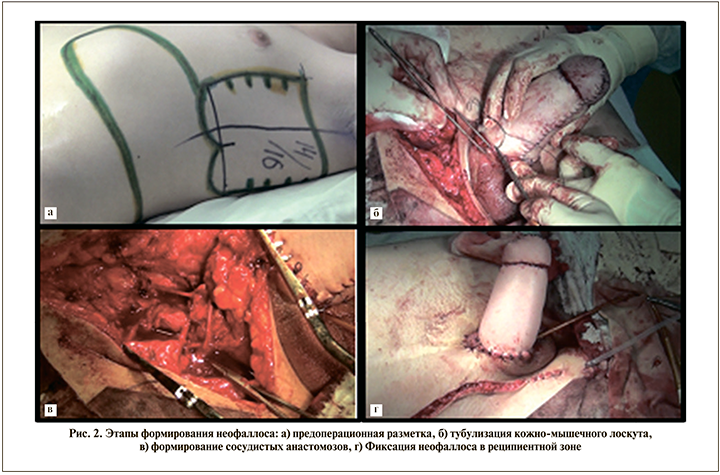
Оперативное вмешательство проводили по стандартной методике. После разметки и мобилизации кожно-мышечного лоскута в донорской зоне выполняли его тубулизацию. Раневой дефект укрыт по методу ротационной кожной пластики перемещением нижнебокового кожного лоскута.
После подготовки реципиентной зоны фиксировали неофаллос в пенопубикальной области, головку собственного полового члена фиксировали у основания неофаллоса по дорсальной поверхности. Далее формировали микроанастомозы между эпигастральными сосудами и сосудами неофаллоса, а также между торакодорсальным нервом с моторной ветвью запирательного нерва (рис. 2).
Следующим этапом реабилитации стало формирование неоуретры лучевым кожно-фасциальным лоскутом на микрохирургических анастомозах через 6 мес. после фаллопластики.
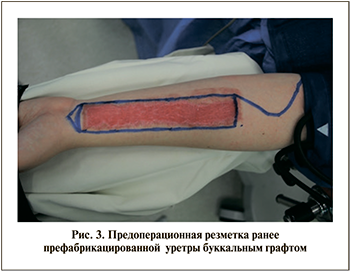 С целью предотвращения осложнений, связанных с дегенерацией кожи в просвете неоуретры, 05.04.2017 выполнена префабрикация уретры буккальным графтом (рис. 3).
С целью предотвращения осложнений, связанных с дегенерацией кожи в просвете неоуретры, 05.04.2017 выполнена префабрикация уретры буккальным графтом (рис. 3).
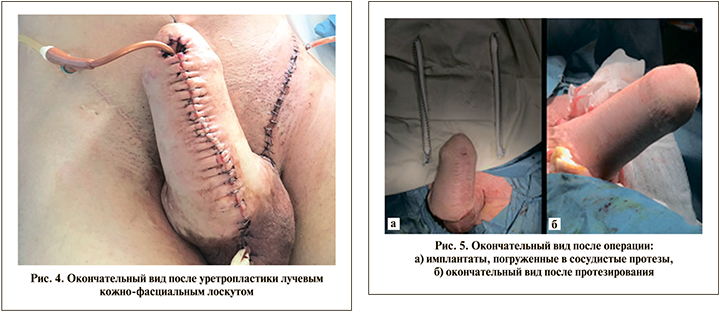
После префабрикации уретры буккальным графтом 22.11.2017 выполнена уретропластика лучевым кожно-фасциальным лоскутом на микрохирургических анастамозах по стандартной методике (рис. 4).
Третьим, заключительным, этапом пенильной реабилитации 16.11.2019 проведено шинирование неофаллоса, т.е. эндопротезирование полужесткими пенильными протезами.
В теле неофаллоса по латеральным сторонам с помощью бужей формировали каналы, в которые затем имплантировали цилиндры протеза Promedom T-120, предварительно погруженные в сосудистые протезы, дистальную часть которых ушивали наглухо. Имплантация протезов в собственные ножки полового члена была невозможна ввиду малого сечения кавернозных пространств собственного полового члена. По этой причине проксимальную часть сосудистых протезов с имплантатами фиксировали к надкостнице лонных костей (рис. 5).
Послеоперационный период на всех этапах протекал без осложнений. Был получен хороший эстетический и предвещающий сексуальную удачу результат.
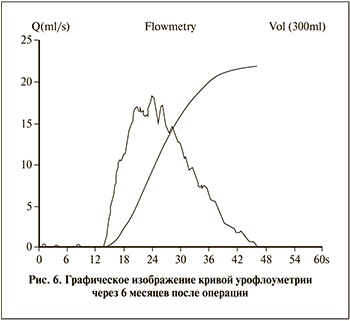 При контрольной урофлоуметрии максимальная скорость мочеиспускания (Qmax) –18 мл/с, средняя скорость мочеиспускания (Qave) – 9 мл/с, скорость мочеиспускания – 29,5 s (рис. 6). Пациент удовлетворен качеством мочеиспускания. При контрольной уретроцистоскопии через 6 мес. данных за стриктуру уретры не получено, уретра свободно проходима до мочевого пузыря для цистоскопа 19 Ch. Оценка по опроснику IPSS составила 2 балла.
При контрольной урофлоуметрии максимальная скорость мочеиспускания (Qmax) –18 мл/с, средняя скорость мочеиспускания (Qave) – 9 мл/с, скорость мочеиспускания – 29,5 s (рис. 6). Пациент удовлетворен качеством мочеиспускания. При контрольной уретроцистоскопии через 6 мес. данных за стриктуру уретры не получено, уретра свободно проходима до мочевого пузыря для цистоскопа 19 Ch. Оценка по опроснику IPSS составила 2 балла.
Данные гистологического исследования ткани неоуретры: фрагменты слизистой оболочки, частично покрытые многослойным плоским неороговевающим эпителием без дисплазии и с единичными внутриэпителиальными лимфоцитами. В подлежащей строме – фиброз, единичные лимфоциты. Воспалительная инфильтрация и предполагаемая уротелиальная трансформация не обнаружены.
Обсуждение. Экстрофия мочевого пузыря является одним из самых сложных заболеваний мочеполовой системы, которое требует многоэтапного хирургического лечения и длительной реабилитации пациента. В детском возрасте основной задачей является восстановление анатомических структур, формирование механизма удержания мочи. Наряду с коррекцией функции удержания мочи, закрытием дефектов брюшной стенки, восстановлением опорно-двигательного аппарата проводят реконструкцию полового члена и уретры. Нередко к моменту полового созревания пациент переносит многократные хирургические вмешательства по поводу эписпадии и коррекции полового члена, которые, однако, не обеспечивают удовлетворительного анатомо-физиологического результата к периоду сексуальной востребованности. Как правило, данным пациентам требуется дальнейшая пенильная хирургическая реабилитация.
Заключение. Пенильная реабилитация пациентов после коррекции экстрофии мочевого пузыря считается актуальной проблемой для урологов. Как правило, данная реабилитация является сложной задачей как для хирурга, так и для пациента. В приведенном клиническом наблюдении использован вариант формирования неофаллоса из торокодорсального лоскута с последующей уретропластикой. Имеются варианты одномоментной фаллоуретропластики из лучевого трансплантата. Выполнение одномоментной фаллоуретропластики позволяет сокращать этапы реабилитации пациента, но тканевая протекция для последующей установки фаллопротезов значительно лучше у кожно-мышечного трансплантата, чем у кожно-фасциального, каким и является лучевой лоскут. Выбор метода формирования неофаллоса индивидуален для каждого пациента.
С учетом вышеизложенного целесообразно проводить сексуальную и пенильную реабилитацию в специализированных центрах, в которых имеется опыт таких вмешательств и возможность использования микрохирургической техники.



