Введение. Диагностика, лечение и дальнейшее ведение мужчин с дефицитом тестостерона (Тс) стали весьма важной составляющей многих медицинских направлений, в том числе урологии, андрологии, эндокринологии и др. [1, 2].
Одной из научно обоснованных причин снижения уровня Тс в сыворотке крови является эндотелиальная дисфункция (ЭнД), обусловленная метаболическим синдромом (МС) вследствие висцерального ожирения, а также сердечно-сосудистыми заболеваниями, сахарным диабетом 2 типа, хроническим обструктивным заболеванием легких (ХОБЛ) и др. Однако общепризнанно, что МС занимает первое место среди всех факторов, способствующих развитию ЭнД, и тем самым вызывает снижение уровня Тс в сыворотке крови. К основным патогенетическим факторам, реализующим эту связь, относятся дисфункции метаболических процессов, протекающих в висцеральной жировой ткани, а также многофакторность их воздействия на эндотелий как эндокринный орган. Кроме того, в последние годы другим весьма значимым патогенетическим механизмом МС, существенно влияющим на развитие ЭнД, является дисфункция иммунной системы организма человека. В основе этой опосредованной МС этиологической составляющей дефицита уровня Tc в сыворотке крови лежит запуск ряда патохимических и патофизических процессов, среди которых триггерное место занимает активация цитокинового звена иммунной системы и развитие дальнейшего его дисбаланса, особенно уровня провоспалительных цитокинов (IL-6, TNFα, СRP). Именно поэтому в патогенезе метаболических нарушений, гипогонадизма, а иногда и бесплодия у мужчин зачастую все данные механизмы образуют порочный круг, разорвать который очень сложно [3].
Кроме того, известно, что ХОБЛ является также одним из факторов риска развития ЭнД и дефицита Tc в сыворотке крови, а первичным пусковым механизмом в этом случае является легочная ишемия, которая в последующем уже способствует развитию системной ЭнД (2).
Таким образом, в основе патогенетического влияния всех данных нарушений лежит развитие дисфункции эндотелия и иммунной системы: именно они и провоцируют каскадные воспалительные реакции в стенках сосудистого русла, при этом вызывая как локальную ишемию участка организма, в том числе органов репродуктивной системы, так и тотальную [4]. Кроме того, доказано, что ЭнД любого генеза и дефицит Тс в сыворотке крови оказывают взаимоусугубляющее влияние.
В настоящее время общеизвестно, что одним из мощных триггерных факторов, вызывающих дисфункцию иммунной и эндотелиальной систем органов дыхания, также является SARS-CoV-2 [5].
Основными клетками-мишенями для коронавируса являются именно альвеолярные эпителиоциты, в цитоплазме которых осуществляется репликация вирусных частиц SARS-CoV-2. После сборки вирионы переходят в цитоплазматические вакуоли, в составе которых уже мигрируют к мембране клетки и путем экзоцитоза выходят во внеклеточное пространство. Экспрессии антигенов вируса на поверхность клетки до выхода вирионов из клетки не происходит, поэтому антителообразования и синтеза интерферонов в этот момент также не наблюдается (происходит относительно поздно). Образование синцития под воздействием коронавируса создает платформу для быстрого проникновения вируса в интактные участки легочной ткани. Вирус вызывает повышение проницаемости клеточных мембран и усиленный транспорт жидкости, богатой альбумином, в интерстициальную ткань легкого и просвет альвеол. При этом разрушается сурфактант, что ведет к коллапсу альвеол; в результате резкого нарушения газообмена развивается острый респираторный дистресс-синдром (ОРДС). Иммуносупрессивное состояние больного способствует развитию оппортунистических бактериальных и микотических инфекций респираторного тракта. Данные о длительности и напряженности иммунитета в отношении SARS-CoV-2 в настоящее время отсутствуют. Влияние SARS-CoV-2 на эндотелиальные и эпителиальные клетки других органов и систем не изучено, как отсутствует и более детальный анализ патогенеза самой новой коронавирусной инфекции. Безусловно, вызывая дисфункцию эндотелия респираторной и иммунной систем в целом, SARS-CoV-2 может также вызывать нарушение функций эндотелия и других органов, в частности сердечно-сосудистой и репродуктивной систем организма человека. В связи с этим весьма важно в настоящее время более детальное изучение влияния вируса и его последствий на другие органы и системы, в том числе на мужскую репродуктивную систему [5].
Цель исследования: изучить показатели тестостерона в сыворотке крови и гемодинамики тестикул до и после инфицирования SARS-CoV-2.
Материалы и методы. Обследованы 20 пациентов до и после перенесенной SARS-CoV-2-инфекции (заболевших в начале 2020 г.). Средний возраст больных – 37,8 года (min=27, max=50). Исследовались уровень общего тестостерона (Тs) в сыворотке крови и гемодинамические показатели тестикул (максимальная [Vmax] и минимальная [Vmin] скорость кровотока и индекс резистентности – [RI]). Гемодинамические показатели определялись в паренхиматозных артериях тестикул допплерографическим исследованием органов мошонки ультразвуковым сканером «PhilipsEnVisor» CHD линейным датчиком в импульсном режиме. Исследование Тs проводилось на анализаторе Rochecobas 6000 (Швейцария) электроиммунохемилюминесцентным методом, тест-система (Rochediagnostics – Германия). До заболевания пациенты проходили плановое обследование у уролога по поводу бесплодия, при этом, в план обследования пациентов входило исследование гормонального статуса и допплерографическое исследование органов мошонки.
После SARS-CoV-2 обследование проводилось через 3 и 6 мес. Проведенная терапия SARS-CoV-2 всем пациентам (с легкой и средней тяжестью течения заболевания) носила идентичный характер: исключала применение гормональных и иммунносупрессивных препаратов и включала рекомбинантный интерферон альфа по 3 капли в каждый носовой ход (3000 МЕ) 5 раз в день в течение 5 дней, Умифеновир по 200 мг 4 р/сут. в течение 5–7 дней, Витамин С 500 мг 1 раз в день, в/в, Цефтриаксон 2000 мг 2 раза в день в течение 14 дней, Тромбо АСС 50 мг 2 раза в день в течение 30 дней, парацетамол 200 мг при гипертермии.
Статистический анализ проводился с использованием статистического пакета STATISTICA 6.1 (StatSoft Inc., США). Проверка нормальности распределения численных признаков осуществлялась согласно W-критерию Шапиро–Уилка. В силу отклонения от нормального распределения большинства признаков для представления показателей использовали медиану (Me), вариабельность признаков оценивалась значениями квартилей Q1 и Q3 в формате Me (Q1; Q3) и размахом показателей. Значимость различий показателей на разных этапах исследования оценивалась с помощью критерия Вилкоксона для связанных групп. При попарном сравнении показателей пациентов на трех этапах исследования применялась поправка Бонферрони для нивелирования эффекта множественных сравнений, при оценке результатов использовался скорректированный уровень значимости: p<0,05/3=0,017. Взаимосвязь показателей больных на различных этапах исследования оценивалась значением рангового коэффициента корреляции Спирмена. Условные обозначения: * – значимые (p<0,017) различия показателей по сравнению с исходным уровнем, $ – значимые (p<0,017) различия показателей по сравнению со значением через 3 мес. после SARS-COV-2. Исследование не имело спонсорской поддержки. Авторы заявляют об отсутствии конфликта интересов. Исследование одобрено в рамках кандидатской диссертации «Оценка влияния SARS-COV-2 на репродуктивный потенциал мужчин с идиопатическим бесплодием» (одобрена НЛЭК ФГБОУ ВО РостГМУ МЗ РФ 22 октября 2021).
Результаты и обсуждение. Анализ уровня общего тестостерона (Тs) в сыворотке крови и гемодинамических показателей паренхиматозных артерий тестикул выявил достоверное снижение Ts и ухудшение кровотока тестикул. от исходных значений (табл. 1 и 2).

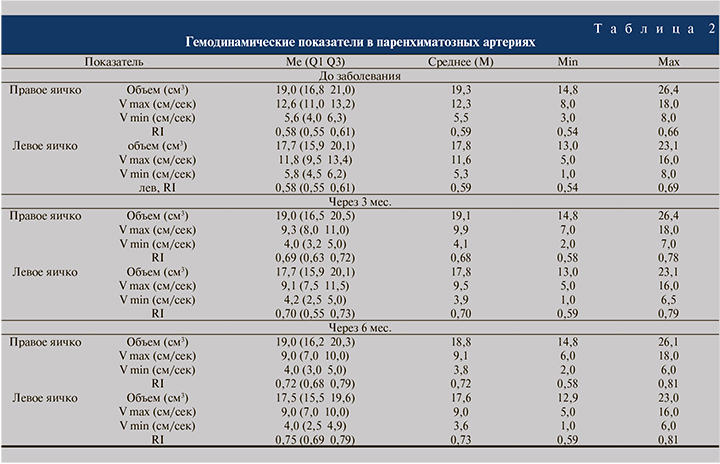
При исследовании уровня Тs через 3 мес. после перенесенного SARS-CoV-2 отмечено его снижение от исходного значения (r=0.47; p=0.35), а через 6 мес. (r=0,98; p<0,007) не отмечено восстановления целевого уровня Тs, зафиксированного до инфицирования SARS-CoV-2. Относительно гемодинамики тестикул также отмечено снижение Vmax и Vmin, а также роста RI, что свидетельствует об ухудшении кровотока тестикул (p<0,001). Полученные данные свидетельствуют о длительном стойком влиянии коронавирусной инфекции на репродуктивную систему даже спустя 6 мес. после реконвалесценции; более того, у части пациентов наблюдается прогрессирующее снижение исследуемых показателей. Так, мы наблюдаем продолжающееся снижение уровня Tс сыворотки крови к 6 мес. после перенесенной коронавирусной инфекции (рис. 1).
Доказано, что у пациентов с коронавирусной инфекцией происходит снижение числа или гибель клеток Лейдига и Сертоли [6], ответственных в том числе и за синтез Tс. Следовательно, полученные нами данные о снижении общего Tc в сыворотке крови у испытуемых через 3 и 6 мес. обусловлены именно гибелью эндокринных клеток яичек. Таким образом, наша работа дополняет исследования по этой проблеме.
Необходимо отметить, что персистирования самого вируса в ткани яичка не наблюдается, что объясняется отсутствием в мембране клеток яичка (включая сперматозоиды) рецептора ACE2 и сериновой протеазы TMPRSS2, с помощью которых коронавирус проникает в клетку [6, 7]. Основными клетками-мишенями для коронавирусов являются клетки альвеолярного эпителия. При разрушении сурфактанта происходит коллапс альвеол, и в результате резкого нарушения газообмена развивается острый респираторный дистресс-синдром, который в свою очередь приводит к оксидативному стрессу, росту уровня активных форм кислорода. Таким образом, действие вируса SARS-CoV-2 на яички может быть не прямым, а опосредованным. Также известно, что при легком течении коронавирусной инфекции показатели спермограммы остаются нормальными, тогда как при среднетяжелом течении отмечены выраженные изменения: средняя концентрация сперматозоидов составляет 16,2 против 95,9 млн/мл в группе легкого течения заболевания [8]. Однако пока неясно, насколько стойки эти нарушения.
Известно, что эндотелий сосудов является мишенью для Тс, который оказывает антиатерогенный и вазопротективный эффекты. Низкий и низконормальный уровень Тс оказывает негативное влияние на многочисленные факторы кардиоваскулярных рисков – инсулинорезистентность, сахарный диабет, ожирение и т.д., которые в свою очередь служат одной из причин снижения Тс; при этом образуется порочный круг [2].
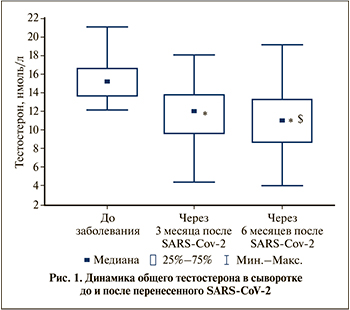
Тс усиливает продукцию и высвобождение эндотелием сосудов NO, который является мощнейшим вазодилататором [2]. Низкий уровень Тс может быть причиной уменьшения вазодилатирующего эффекта, ввиду чего повышается сосудистое сопротивление – увеличивается индекс резистентности, что мы и наблюдаем в нашем исследовании; при этом на 6-м месяце после выздоровления отмечается еще большее прогрессирование увеличения данного показателя (рис. 2). Также известно, что физиологическими антагонистами NO являются факторы эндотелиального происхождения: эндотелин-1 и ангиотензин II (АТII) – мощные вазоконстрикторы. В эндотелии сосудов экспрессируется ангиотензин-превращающий фермент (АПФ). При повреждении эндотелия экспрессия АПФ повышается, что в свою очередь приводит к увеличению синтеза АТII. Также повышаются тонус сосудов, пролиферация элементов сосудистой стенки, тромбообразование и усиливается оксидативный стресс [4]. Эндотелин-1 в свою очередь запускает каскад реакций, способных приводить к развитию таких грозных осложнений, как инфаркт миокарда, сердечная недостаточность и т.д.
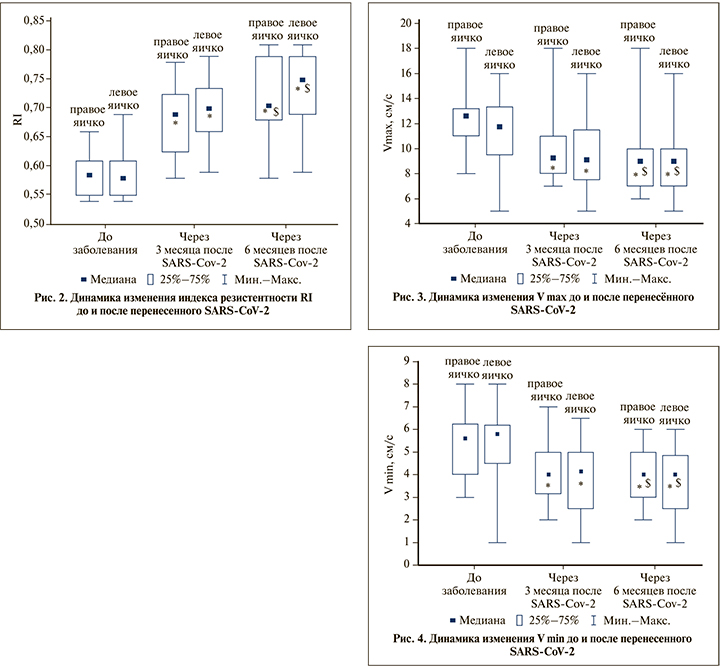
Как говорилось ранее, SARS-CoV-2 имеет высокое сродство с рецепторами ангиотензин-превращающего фермента-2 (ACE2). Это вызывает дисбаланс в ренин-ангиотензиновой системе, как следствие – вазоконстрикцию и развитие провоспалительного эффекта. Эндотелий – одна из мишеней, которая поражается вирусом SARS-CoV-2 первой. Некоторые авторы даже употребляют термин «эндотелиит» [9]. Экспрессия ACE2 на эндотелии и гладкомышечных клетках сосудов при инфицировании вирусом SARS-CoV-2 способствует вовлечению сердечно-сосудистой системы в системное повреждение, а также сопровождается повреждением эндотелия, эндотелиальной дисфункцией, периваскулярным воспалением, которое еще больше усиливает повреждение эндотелия и приводит к системному нарушению микроциркуляции в различных органах [10]. Эти данные находят подтверждение и в нашем исследовании. Так, отмечено снижение Vmax, Vmin и рост RI, что свидетельствует об ухудшении кровотока тестикул.
Чем выше сосудистое сопротивление, тем негативнее его влияние на эндотелий, что в свою очередь оказывает действие на его функцию (рис. 2).
Повышенное сопротивление приводит также к замедлению тока крови, что в свою очередь является предрасполагающим фактором к развитию таких осложнений, как гипотрофия яичек, варикоцеле и бесплодие (рис. 3, 4).
Полученные результаты и данные литературного обзора доказывают причастность вирусной инфекции к генезу многих заболеваний мочевых путей и репродуктивных органов, что обусловливает необходимость создания стандартов диагностики и лечения заболеваний мочеполовой системы вирусной этиологии [11, 12].
Пандемия SARS-CoV-2 стала серьезным вызовом для мировой системы здравоохранения и сегодня более чем через год после регистрации первых случаев заболевания остается одной из самых серьезных проблем во всем мире, так как патогенные воздействия вируса вызывают широкий круг негативных последствий во многих органах и системах организма [12, 13].
Выводы. Таким образом, перенесенная коронавирусная инфекция, оказывая длительное стойкое, а в ряде случаев и прогрессирующее негативное влияние на уровень Тс в сыворотке крови и показатели гемодинамики тестикул служат фактором риска развития серьезных, в том числе жизнеугрожающих, заболеваний, что диктует необходимость долгосрочного мониторинга пациентов после выздоровления.
SARS-CoV-2 несомненно оказывает влияние на различные аспекты репродуктивной системы, что требует дальнейших исследований и поиска возможных способов профилактики и лечения осложнений.



