Введение. Малоинвазивное лечение мочекаменной болезни (МКБ) является быстроразвивающимся направлением урологии. Практически каждый год появляются новые рабочие инструменты и технологии, призванные улучшить результаты существующих методов лечения. Большинство последних инноваций в этой области связано с совершенствованием и миниатюризацией ригидных и гибких эндоскопических инструментов, а также методов контактной литотрипсии [1–4]. Все это направлено на возможность полного очищения мочевыводящих путей от конкрементов в течение 1–2 стационарных дней, по возможности с минимальным риском развития осложнений и дополнительных или повторных операций по поводу МКБ.
В настоящее время в клинической урологической практике для контактного разрушения камней применяются различные литотрипторы с ригидными и гибкими зондами: электрогидравлический, ультразвуковой, пневматический, электрокинетический, наноимпульсный, лазерный и др. [1]. Все эти методы контактной литотрипсии эффективны для разрушения камня под визуальным контролем, однако имеют свои преимущества и недостатки. Особое внимание в последнее время уделяется ригидной и гибкой лазерной литотрипсии, сочетающей высокую эффективность и малотравматичность.
В 1968 г. Mulvaney и Beck спустя почти 70 лет после открытия A. Einstein разработали первый рубиновый лазер для контактной литотрипсии. Однако выполнение литотрипсии сопровождалось значительной потерей тепла и нежелательным термическим воздействием на окружающие ткани и инструмент, в связи с чем широкого распространения данный метод не получил. В последующем были разработаны лазер на двуокиси углерода и неодимовый лазер, однако невозможность передачи энергии до камня по нетоксичным для организма волокнам для лазера на двуокиси углерода и выраженный термический эффект у неодимового лазера стали причиной отказа от широкого их использования для литотрипсии. Полученный опыт позволил определить необходимые условия для успешной лазерной литотрипсии: 1) способность передачи лазерной энергии по кварцевому оптическому волокну; 2) ограниченное термическое воздействие лазерной энергии на окружающие ткани; 3) достаточную энергию и мощность лазерного воздействия, способного разрушить самые плотные камни [3]. Первым лазером, примененным в клинике для литотрипсии, был таковой на растворе кумаринового красителя, однако его мощности не хватало для фрагментации большинства оксалатных и цистиновых камней [1].
В конце 1990-х гг. в клиническую практику вошел гольмиевый лазер, получивший широкое распространение в различных медицинских областях в виде многофункциональных лазерных систем, с помощью которых можно было провести коагуляцию, аблацию и литотрипсию [4, 5]. Это стало возможным благодаря сочетанию преимуществ неодимого лазера с возможностью передачи энергии лазерной волны по оптическому волокну, что сделало гольмиевый лазер многофункциональной лазерной системой, удовлетворяющей всем потребностям уролога во время выполнения эндоскопической операции. Начиная с 2000-х гг. гольмиевая лазерная литотрипсия прочно заняла место метода выбора при выполнении контактной литотрипсии. В 2008 г. нами была опубликована статья, посвященная клиническому использованию гольмиевого лазера для лечения МКБ [4]. В настоящее время гольмиевые лазеры считаются «золотым» стандартом в литотрипсии [2].
В последние годы в клинической практике стал использоваться тулиевый волоконный лазер с длиной волны 1940 нм. Согласно предварительным результатам экспериментов и данным литературы, применение тулиевого волоконного лазера способствует более быстрому разрушению камня без образования крупных фрагментов и ретропульсии, а также не приводит к повреждению стенки мочевыводящих путей [6–8].
Настоящая работа посвящена анализу первых результатов клинического применения нового отечественного тулиевого лазера «Уролаз» (НТО «ИРЭ-Полюс», Россия) для контактной трансуретральной литотрипсии, а также экспериментальным исследованиям по изучению смещения камня при тулиевой и гольмиевой литотрипсии и изменений температурной среды во время лазерной литотрипсии.
Материалы и методы. С апреля по сентябрь 2017 г. в ГКБ им. Д. Д. Плетнева трансуретральная контактная литотрипсия с помощью волоконного тулиевого лазера была выполнена 56 пациентам (35 мужчин, 21 женщина, возраст – 19–82 года) по поводу 68 камней верхних и нижних мочевыводящих путей (табл. 1). В 44 наблюдениях имели место камни почек и/или мочеточников, в 12 – камни мочевого пузыря. У 12 больных были множественные камни мочевой си-стемы, 4 пациента имели сопутствующую стриктуру мочеточника (1) или лоханочно-мочеточникового сегмента (3).

Всем пациентам перед операцией проведено комплексное клинико-лабораторное обследование, позволившее выявить камни мочевыводящих путей и изучить морфо-функциональное состояние мочевыводящих путей. Двадцать четыре камня почек было удалено путем ретроградной интраренальной хирургии с использованием мочеточникового кожуха, фиброуретеропиелоскопа и тулиевого лазера, 32 камня различных отделов мочеточника – путем контактной тулиевой уретеролитотрипсии с использованием ригидного уретеропиелоскопа и 12 камней мочевого пузыря – путем тулиевой цистолитотрипсии через лазерный резектоскоп перед энуклеацией гиперплазии предстательной железы.
 Размеры камней верхних мочевыводящих путей варьировались от 0,6 до 1,8 см, размеры камней мочевого пузыря – от 1,1 до 3,5 см. Во всех наблюдениях операции были выполнены в плановом порядке. Двадцати восьми больным с камнями верхних мочевыводящих путей до операции было выполнено 1–2 сеанса дистанционной литотрипсии, у 6 пациентов почка до операции была дренирована нефростомическим дренажем, у 10 – внутренним стентом.
Размеры камней верхних мочевыводящих путей варьировались от 0,6 до 1,8 см, размеры камней мочевого пузыря – от 1,1 до 3,5 см. Во всех наблюдениях операции были выполнены в плановом порядке. Двадцати восьми больным с камнями верхних мочевыводящих путей до операции было выполнено 1–2 сеанса дистанционной литотрипсии, у 6 пациентов почка до операции была дренирована нефростомическим дренажем, у 10 – внутренним стентом.
Для контактного разрушения камня применяли отечественный универсальный тулиевый волоконый лазер «Уролаз» с длиной волны 1940 нм (рис. 1). Лазерный аппарат компактен и мобилен, его размер – 545х460х286 мм, масса – 38 кг. Использовали мощность лазера 10–15 Вт с энергией импульса 0,5–1,0–1,5 Дж и частотой 10–15–20 Гц. Тулиевая литотрипсия при работе через фиброуретеропиелоскопы (наружный диаметр – 7,5–9 Fr, диаметр рабочего канала – 3,0–3,5 Fr) выполнялась волокном 200 мкм, при работе с ригидными уретеропиелоскопами (7,5–8 Fr, 3,2–3,8 Fr) и резектоскопом (26 Fr, 5,0 Fr) – 400 и 600 мкм соответственно.
После операции всем больным дренировали мочевой пузырь уретральным катетером диаметром 18–20 Fr, после уретеропиелоскопии почку дренировали мочеточниковым катетером (31 [70,5%] пациент) или внутренним стентом (13 [29,5%] пациентов); показания: длительно стоящий на месте камень, сопутствующая эндоуретеропиелотомия диаметром 5–6 Fr. Бездренажной уретеропиелоскопии не производили. Все оперативные вмешательства выполняли под спинальной анестезией.
В послеоперационном периоде пациентам назначали антибактериальную, противовоспалительную и анальгетическую терапию под контролем анализов крови. В 1–2-е сутки после операции выполняли обзорную урографию и ультразвуковое сканирование почек, через 4–6 нед. – неконтрастную компьютерную томографию. Обращали внимание на наличие резидуальных фрагментов камня после лазерного дробления, также регистрировали количество послеоперационных койко-дней, учитывали необходимость выполнения дистанционной литотрипсии, чрескожной пункционной нефростомии или установки внутреннего стента в послеоперационном периоде, частоту атак пиелонефрита, обращали внимание на длительность макрогематурии после операции.
Долгое время считалось, что тулиевый лазер нельзя использовать для литотрипсии. Это мнение было основано на опыте использования тулиевых лазеров на кристаллах алюмоиттриевого граната (Tm:YAG) с длиной волны 2,03 мкм. В отличие от классических твердотельных гольмиевого (Ho:YAG) и тулиевого (Tm:YAG) лазеров тулиевый лазер «Уролаз» является волоконным лазером (Tm:Fiber), который имеет иной принцип работы. Электрический импульс накачки поступает на лазерные диоды, где преобразуется в лазерный луч с длиной волны 970 нм, далее этот луч поступает в систему активных волокон (не путать с пассивным кварцевым волокном, широко используемым в медицине для доставки лазерного излучения), в составе которых содержится вещество тулий (Tm) и на выходе получается лазерный луч с длиной волны 1940 нм (рис. 2).
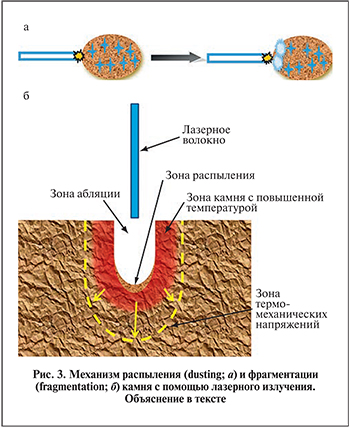 Механизм гольмиевой и тулиевой литотрипсии – фототермомеханический. После выработки лазерного импульса, передающегося на дистальный конец лазерного волновода, на переднем фронте лазерного импульса происходит испарение жидкости, окружающей конец волновода, и образуется газовый пузырь, который растет до 1–3 мм, распространяясь на границу раздела сред (камень–жидкость). Следующая порция лазерного импульса достигает поверхности камня и вызывает его разрушение [9, 10]. Кроме того, при этом происходит испарение жидкости внутри камня с образованием зоны высокого давления, что вызывает его разрушение изнутри с образованием множества мелких фрагментов (dusting, распыление; рис. 3, а). Продукты распыления легко выводятся из почки или мочеточника без дополнительных инструментов, но ухудшают эндоскопическую видимость (так называемый эффект снежной бури). Эффект распыления камня характерен для низкой энергии лазерных импульсов и, согласно нашему опыту, улучшается при применении техники постоянного сканирования по поверхности камня. При использовании больших энергий лазерных импульсов и доставки энергии в одну точку камня происходит испарение воды в камне и его локальный перегрев с образованием сильных механических напряжений, приводящих к растрескиванию камня на относительно крупные фрагменты – режим фрагментации (fragmentation; рис. 3, б). При выполнении лазерной литотрипсии отмечается определенный эффект ретроградной миграции камня (retropulsion), связанный с импульсом отдачи при аблации камня и давлением воды на камень из-за образования пузырей у конца волокна, однако данная миграция не сравнима с той, характерной для пневматической контактной литотрипсии.
Механизм гольмиевой и тулиевой литотрипсии – фототермомеханический. После выработки лазерного импульса, передающегося на дистальный конец лазерного волновода, на переднем фронте лазерного импульса происходит испарение жидкости, окружающей конец волновода, и образуется газовый пузырь, который растет до 1–3 мм, распространяясь на границу раздела сред (камень–жидкость). Следующая порция лазерного импульса достигает поверхности камня и вызывает его разрушение [9, 10]. Кроме того, при этом происходит испарение жидкости внутри камня с образованием зоны высокого давления, что вызывает его разрушение изнутри с образованием множества мелких фрагментов (dusting, распыление; рис. 3, а). Продукты распыления легко выводятся из почки или мочеточника без дополнительных инструментов, но ухудшают эндоскопическую видимость (так называемый эффект снежной бури). Эффект распыления камня характерен для низкой энергии лазерных импульсов и, согласно нашему опыту, улучшается при применении техники постоянного сканирования по поверхности камня. При использовании больших энергий лазерных импульсов и доставки энергии в одну точку камня происходит испарение воды в камне и его локальный перегрев с образованием сильных механических напряжений, приводящих к растрескиванию камня на относительно крупные фрагменты – режим фрагментации (fragmentation; рис. 3, б). При выполнении лазерной литотрипсии отмечается определенный эффект ретроградной миграции камня (retropulsion), связанный с импульсом отдачи при аблации камня и давлением воды на камень из-за образования пузырей у конца волокна, однако данная миграция не сравнима с той, характерной для пневматической контактной литотрипсии.
 Излучение тулиевого волоконного лазера имеет длину волны 1940 нм и поглощается водой в 5,7 раза сильнее, чем излучение гольмиевого лазера с длиной волны 2100 нм (рис. 4), что приводит к более эффективному распылению камня и более эффективной фрагментации. Благодаря тому, что разрушение камня волоконным тулиевым лазером происходит в большей степени изнутри и требует меньшей энергии импульсов, смещение камня (пропульсия) и термальное воздействие на окружающие ткани минимальное, что было подтверждено рядом экспериментальных работ [5–7].
Излучение тулиевого волоконного лазера имеет длину волны 1940 нм и поглощается водой в 5,7 раза сильнее, чем излучение гольмиевого лазера с длиной волны 2100 нм (рис. 4), что приводит к более эффективному распылению камня и более эффективной фрагментации. Благодаря тому, что разрушение камня волоконным тулиевым лазером происходит в большей степени изнутри и требует меньшей энергии импульсов, смещение камня (пропульсия) и термальное воздействие на окружающие ткани минимальное, что было подтверждено рядом экспериментальных работ [5–7].
Мы также выполнили доклинические экспериментальные исследования с целью сравнения влияния гольмиевого (Ho:YAG, Pulse 120H, Lumenis) и отечественного тулиевого (Tm:fiber, «Уролаз», НТО «ИРЕ-Полюс) лазеров на процесс литотрипсии. В первой серии экспериментов сравнили смещение камня (пропульсию) при литотрипсии. Для этого создали экспериментальную установку с миллиметровой шкалой, юстированную по горизонтали и вертикали (рис. 5), которую полностью помещали в физиологический раствор и выполняли одиночное лазерное импульсное воздействие на помещенный в нее экспериментальный камень (BegoStone-фантом, размеры – 5×5 мм, масса – 226 мг). Смещение камня в миллиметрах фиксировали визуально и анализировали по видеозаписи. Для каждой пульсовой энергии лазерного воздействия проводили не менее трех экспериментов.
 Во второй серии экспериментов изучали температурную среду во время лазерной литотрипсии. Для этого в экспериментальной установке, позволяющей измерять температуру промывной жидкости, выполняли три гольмиевые и три тулиевые литотрипсии 6 мочевых камней (2 ведделита, 2 вевеллита и 2 урата) диаметром 0,9–1,1 см, извлеченных путем перкутанной нефролитоэкстракции из 3 пациентов. Экспериментальная установка состояла из двух проточных кварцевых кювет, одна из которых, имеющая в основании отверстия диаметром 1 мм (внутренняя кювета), была помещена в другую, из которой промывная жидкость вытекала наружу (рис. 6 а, б). Камень помещали на перфорированное дно внутренней кюветы и осуществляли непрерывное лазерное дробление до момента, когда в кювете не оставалось ни одного фрагмента размером больше 1 мм.
Во второй серии экспериментов изучали температурную среду во время лазерной литотрипсии. Для этого в экспериментальной установке, позволяющей измерять температуру промывной жидкости, выполняли три гольмиевые и три тулиевые литотрипсии 6 мочевых камней (2 ведделита, 2 вевеллита и 2 урата) диаметром 0,9–1,1 см, извлеченных путем перкутанной нефролитоэкстракции из 3 пациентов. Экспериментальная установка состояла из двух проточных кварцевых кювет, одна из которых, имеющая в основании отверстия диаметром 1 мм (внутренняя кювета), была помещена в другую, из которой промывная жидкость вытекала наружу (рис. 6 а, б). Камень помещали на перфорированное дно внутренней кюветы и осуществляли непрерывное лазерное дробление до момента, когда в кювете не оставалось ни одного фрагмента размером больше 1 мм.
Для литотрипсии применяли одинаковые волокна диаметром 200 мкм и 3 одинаковых режима для обоих лазеров: 1-й режим – 0,2 Дж, 40 Гц, 8 Вт; 2-й режим – 0,2 Дж, 80 Гц, 16 Вт; 3-й режим – 0,5 Дж, 80 Гц, 40 Вт.
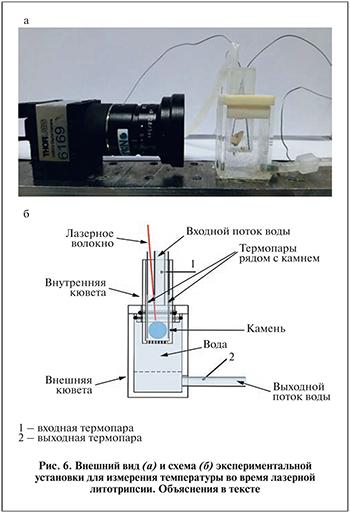 В качестве промывной жидкости использовали физиологический раствор, имевший температуру 22°С, который подавался насосом («New Era Pump Systems INC», США) во внутреннюю кювету под постоянным давлением, выходной поток контролировался таким же прибором, расположенным на выходе внешней кюветы. Для измерения температуры промывной жидкости при дроблении камня использовали 4 термопары IT–23 типа T диаметром 0,7 мм («Physitemp Instruments INC», США), которые были подключены к 4-канальному измерителю температуры DI-245 («Dataq Instruments»,США). Причем две термопары были установлены для измерения температуры внутри кюветы рядом с камнем, а две другие измеряли температуру входного и выходного потоков (рис. 6 а, б). Для защиты термопар от лазерного излучения внутри кюветы их помещали в керамические полые трубки. Показания с измерителя температуры записывали с шагом в 1 мс.
В качестве промывной жидкости использовали физиологический раствор, имевший температуру 22°С, который подавался насосом («New Era Pump Systems INC», США) во внутреннюю кювету под постоянным давлением, выходной поток контролировался таким же прибором, расположенным на выходе внешней кюветы. Для измерения температуры промывной жидкости при дроблении камня использовали 4 термопары IT–23 типа T диаметром 0,7 мм («Physitemp Instruments INC», США), которые были подключены к 4-канальному измерителю температуры DI-245 («Dataq Instruments»,США). Причем две термопары были установлены для измерения температуры внутри кюветы рядом с камнем, а две другие измеряли температуру входного и выходного потоков (рис. 6 а, б). Для защиты термопар от лазерного излучения внутри кюветы их помещали в керамические полые трубки. Показания с измерителя температуры записывали с шагом в 1 мс.
Скорость потока промывной жидкости была выбрана на основании экспериментального исследования F. Pascui и соавт. [11] в соответствии со средней скоростью потока через современные стандартные гибкие фиброуретеропиелоскопы при «свободном» и «занятом» (волокно 200 мкм) рабочем каналах и высоте ирригационной системы 60 и 100 см над уровнем инструмента. При терапевтической мощности лазеров во время литотрипсии 8 и 16 Вт скорость потока промывной жидкости через кювету в нашем эксперименте составляла 24 мл/мин – модель стандартной клинической ситуации для фиброуретеропиелоскопа с введенным в рабочий канал лазерным волокном 200 мкм при высоте промывной системы 60 см водн.ст. При повышенной мощности лазеров в 40 Вт скорость потока жидкости через кювету составляла 40 мл/мин – модель фиброуретеропиелоскопа с лазерным волокном 200 мкм при высоте промывной системы 100 см водн.ст.
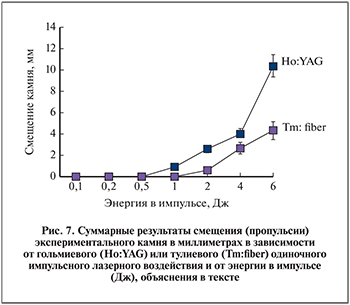 Результаты и обсуждение. Результаты экспериментального исследования смещения искусственного камня в ответ на одиночное импульсное воздействие Ho:YAG и Tm:fiber лазеров при различной энергии воздействия представлены на рис. 7. Как видно из графика, пропульсия искусственного камня при волоконной тулиевой литотрипсии значительно меньше, чем при гольмиевой литотрипсии, даже при высокомощностном воздействии, а при лечебных параметрах Tm:fiber литотрипсии (1,0–1,5 Дж) камень практически не смещается.
Результаты и обсуждение. Результаты экспериментального исследования смещения искусственного камня в ответ на одиночное импульсное воздействие Ho:YAG и Tm:fiber лазеров при различной энергии воздействия представлены на рис. 7. Как видно из графика, пропульсия искусственного камня при волоконной тулиевой литотрипсии значительно меньше, чем при гольмиевой литотрипсии, даже при высокомощностном воздействии, а при лечебных параметрах Tm:fiber литотрипсии (1,0–1,5 Дж) камень практически не смещается.
Продолжительность литотрипсии во втором эксперименте составляла от 7 до 12 мин (в среднем 10 мин).
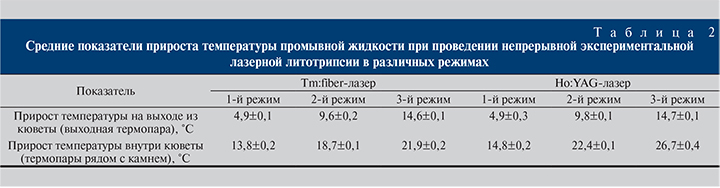
Как видно из табл. 2, тулиевая литотрипсия сопровождалась менее выраженным изменением температуры промывной жидкости, чем гольмиевая. Терапевтическая мощность обоих лазеров не приводит к «опасным» подъемам температуры промывной жидкости во время дробления, что совпадает с ранее проведенными экспериментами [12]. В то время как непрерывное высокомощное лазерное воздействие, особенно в течение длительного времени (как, например, при работе с крупными камнями), требует, с нашей точки зрения, повышенного внимания, дополнительного контроля, перерывов дробления, большей высоты резервуара промывной системы для увеличения потока жидкости (или большего давления насоса ирригационной системы) во избежание температурного повреждения слизистой мочевыводящих путей.
В клинике 56 больным выполнены трансуретральные операции, направленные на разрушение и удаление 68 камней мочевыводящих путей с помощью волоконного тулиевого лазера «Уролаз» (НТО «ИРЭ-Полюс», Россия). Наблюдений, когда камень был не достижим для эндоскопа, не было, т.е. доступность камней составила 100%. В клинической части работы ни одного наблюдения, когда камень оказывался не достижим для эндоскопа, не было. Литоэкстракция фрагментов (нитиноловые корзинки и торцевые щипцы) размером до 5 мм выполнена 21 (47,7%) пациенту с камнями верхних мочевыводящих путей. Причем необходимости в литоэкстракции не было – она выполнялась для уменьшения времени операции после тулиевой литотрипсии в режиме фрагментации (1,5 Дж, 10 Гц). При работе в мочеточнике ригидными уретеропиелоскопами не зафиксировано наблюдений ретроградной миграции камня вследствие работы лазера, тогда как при гольмиевой уретеролитотрипсии мы констатировали подобный нежелательный эффект в 11,5% наблюдений [4]. У 13 (29,5%) пациентов имела место незначительная ретроградная миграция фрагментов из-за работы ирригационной системы (мы используем ручную гидравлическую помпу) и выраженной дилатации верхних мочевыводящих путей. Случаев перфорации мочеточника или чашечно-лоханочной системы отмечено не было, у 8 (14,3%) пациентов были выявлены незначительные дефекты слизистой мочевыводящих путей, не потребовавшие стентирования мочеточника или коагуляции слизистой мочевого пузыря. Выраженной гематурии, препятствующей выполнению операции, не возникало.
Четырем больным со стриктурами лоханочно-мочеточникового сегмента и мочеточника была выполнена трансуретральная тулиевая эндопиелоуретеротомия с последующей лазерной уретеропиелолитотрипсией. К особенностям тулиевой инцизии стенки мочеточника относятся высокоточное, дозированное и быстрое рассечения ткани с минимальным эффектом карбонизации.
Полная фрагментация камня была достигнута во всех наблюдениях. Время литотрипсии варьировалось от 8 до 29 мин, в среднем составив 19 мин. В раннем послеоперационном периоде после трансуретральной уретеропиелоскопии у 7 (15,9%) из 44 пациентов отмечена атака пиелонефрита, купированная консервативными мероприятиями. Мочеточниковые катетеры удаляли на 1–2-е сутки после операции, внутренние стенты – спустя 1–3 нед. после шинирования зон, где длительно находились камни, и спустя 4–6 нед. после сопутствующей эндоуретеропиелотомии.
Средний послеоперационный койко-день составил 2,4±1,1 дня, включая пациентов после эндоуретеропиелотомии и энуклеации доброкачественной гиперплазии простаты. Все пациенты были выписаны в удовлетворительном состоянии. Резидуальных фрагментов после цистолитотрипсии не было.
У 3 (6,8%) из 44 пациентов после трансуретральной уретеронефролитотрипсии при контрольном обследовании через 4–6 нед. были выявлены бессимптомные резидуальные фрагменты чашечек почки, размер которых не превышал 3 мм, и 1 (2,3%) больному выполнена экстренная дистанционная уретеролитотрипсия по поводу симптоматичного резидуального фрагмента камня мочеточника размером 4 мм.
Заключение. Наш первоначальный опыт применения тулиевого лазера «Уролаз» (НТО «ИРЭ-Полюс») для литотрипсии позволяет выделить ряд особенностей операции:
- волоконная тулиевая литотрипсия может проводиться в режиме как распыления, так и фрагментации;
- при проведении тулиевой литотрипсии в режиме распыления преобладает явление разрушения камня до состояния мельчайших фрагментов, если не касаться волокном поверхности камня и сканировать волокном его поверхность;
- рутинной необходимости в литоэкстракции после тулиевой литотрипсии нет;
- тулиевая литотрипсия сопровождается повышенным газообразованием, что может потребовать остановки дробления и эвакуации воздушных пузырьков;
- эффект «снежной бури» при тулиевой литотрипсии выражен менее, чем при гольмиевой, в связи с чем не возникает необходимости в прерывании дробления из-за ухудшения визуализации;
- тулиевый лазер относительно безопасен для стенки мочевыводящих путей, поэтому волокно можно проводить вглубь камня без повышенной опасности травматизации стенки;
- необходимо избегать контакта лазерного волновода со струной-проводником или корзинкой, так как это может привести к поломке последних;
- следует выдвигать верхушку волновода от дистального конца уретероскопа на 2–3 мм во избежание повреждения оптики инструмента.
Полученные в ходе нашего исследования результаты использования волоконного тулиевого лазера для лечения камней мочевыводящих путей весьма впечатляющие и многообещающие. Считаем необходимым отметить, что тулиевый лазер как нельзя лучше удовлетворяет запросам урологов в связи с возможностью многофункционального использования – его можно применять для литотрипсии, рассечения, вапоризации и коагуляции тканей. Лазер позволяет проводить операции на уретре, предстательной железе, мочевом пузыре и верхних мочевыводящих путях, т.е. отвечает всем потребностям, возникающим у уролога при выполнении всего спектра урологических операций на нижних и верхних мочевыводящих путях. Таким образом, применение данной лазерной системы позволяет расширить показания к использованию малоинвазивных методов, снизить продолжительность послеоперационного койко-дня, сроков госпитализации и повысить качество оказываемой медицинской помощи, что представляет важную социально-экономическую задачу.
Применение отечественного тулиевого лазера «Уролаз» (НТО «ИРЭ-Полюс», Россия) имеет значительные перспективы применения в урологической практике. Помимо трансуретральной эндоуретеропиелотомии к настоящему времени мы уже применили лазер при выполнении мини- и ультрамини-перкутанной литотрипсии 28 пациентам с полным освобождением их от камней, а также для аблации папиллярной опухоли верхних мочевыводящих путей у 11 больных по элективным показаниям.
Использование универсальной лазерной тулиевой системы «Уролаз» (НТО «ИРЭ-Полюс», Россия) позволяет значительно повысить эффективность эндоурологических вмешательств на верхних мочевыводящих путях и существенно снизить вероятность интраоперационной травмы и послеоперационных осложнений, что способствует повышению качества оказываемой специализированной урологической помощи.



