Введение. Протяженные стриктуры мочеточников остаются сложной проблемой урологии. Последние два десятилетия отмечается неуклонный рост пациентов с данным заболеванием, что связано с увеличением хирургической активности, расширением показаний к оперативному лечению онкогинекологических и онкохирургических пациентов, широким внедрением в клиническую практику эндоскопических и эндовидеохирургических методов лечения, что повлекло за собой увеличение количества осложнений, связанных с образованием ятрогенных стриктур мочеточника. Значительный дефект мочеточника может образоваться как осложнение лучевой терапии, а также вследствие ретроперитонеального фиброза. Методом выбора при лечении протяженных стриктур мочеточников является пластика с использованием изолированного подвздошнокишечного трансплантата.
Материалы и методы. Нами проведено ретроспективное исследование отдаленных результатов лечения пациентов с протяженной стриктурой мочеточника, перенесших заместительную кишечную пластику. В исследование включены 25 пациентов – 10 (40%) мужчин и 15 (60%) женщин, которым в клинике урологии РНИМУ им. Н. И. Пирогова в период с 2012 по сентябрь 2021 г. была выполнена заместительная илеопластика мочеточников с последующей оценкой функциональных результатов при сроке наблюдения не менее 6 мес.
Средний возраст пациентов составил 59 (38–80) лет.
У четырех пациентов протяженная стриктура возникла вследствие лучевой терапии (n=4, 16%), у одной – вследствие ретроперитонеального фиброза (n=1, 4%), у остальных (n=20, 80%) пациентов стриктура мочеточника носила ятрогенный характер. Одиннадцати пациентам пластика была выполнена на правом мочеточнике (44%), 13 пациентам – на левом (52%), одной пациентке пластика выполнена с двух сторон одним кишечным трансплантатом (4%). Средняя протяженность дефекта составила 10,7 (5–20) см. Одиннадцати пациентам оперативное вмешательство выполнено открытым доступом (44%), 14 – лапарокопическим (56%). Первичная пластика мочеточника выполнена 16 (64%) пациентам, повторная пластика вследствие рецидива стриктуры – 7 (28%) пациентам. Двум (8%) пациентам выполнена кишечная пластика мочеточника, имплантированного в илеокондуит после радикальной цистэктомии. Все трансплантаты уложены изоперистальтически, а анастомозы выполнены без антирефлюксной защиты. Проксимальный уретероилеоанастомоз выполнен 15 (60%) пациентам, 10 (40%) анастомоз выполнен между лоханкой и проксимальной частью трансплантата подвздошной кишки. Исследуемыми параметрами в нашей работе оказались пол, возраст, этиология возникновения стриктур и ее протяженность, сторона поражения, способы дренирования до оперативного лечения, варианты проксимального анастомоза, а также число операций, выполненных для устранения стриктуры до кишечной реконструкции. В группах пациентов, оперированных открытым и лапароскопическим доступами, проведен сравнительный анализ по таким критериям, как длительность операции, частота интра- и послеоперационных осложнений, время пребывания в стационаре в послеоперационном периоде, в том числе в отделении реанимации, число используемых наркотических анальгетиков в период восстановления, числа дренажей и сроков их удаления. Тринадцати пациентам проведено полное контрольное обследование, остальным – телефонное анкетирование. Период наблюдения за данными пациентами в среднем составил 51,26 (6–109) мес. Основными критериями оценки функциональных результатов стали ухудшение почечной функции, повторные операции и метаболические нарушения. Ухудшение функции почек определялось как градуированное нарастание стадии хронической болезни почек (ХБП). Стадии ХБП были определены на основе скорости клубочковой фильтрации (СКФ): стадия 1 ≥90, стадия 2 – 60–89, стадия 3 – 30–59, стадия 4 – 15–29 и стадия 5 <15. СКФ рассчитывали с использованием уравнения MDRD (modification of diet in renal disease). Также с целью оценки почечной функции всем пациентам выполнена динамическая нефросцинтиграфия (ДНСГ).
Дренирование почек перед реконструктивным этапом выполнялось путем нефростомии 24 (96%) пациентам, и 1 (4%) пациенту выполнялось двойное дренирование (нефростома+мочеточниковый стент). Если пациент при обращении в наш стационар дренирован внутренним мочеточниковым стентом, последний удалялся с последующей установкой нефростомы в среднем в течение 1 мес. до илео-пластики.
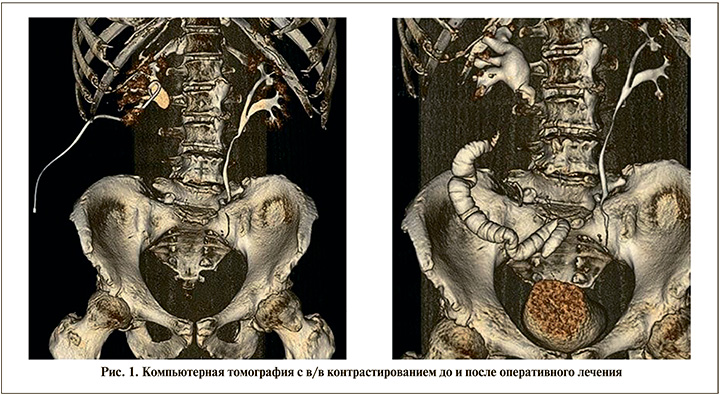
Для оценки анатомо-функционального состояния верхних мочевыводящих путей выполнялась компьютерная томография (КТ) органов брюшной полости и забрюшинного пространства с внутривенным болюсным контрастированием до и после оперативного лечения (рис. 1).
Для выявления метаболических нарушений всем пациентам выполнены анализ крови на определение кислотно-щелочного состояния (КЩС) и показатели биохимии. Пациентам с рецидивирующим пиелонефритом в послеоперационном периоде выполнялась микционная цистография с целью исключения рефлюкса по кишечному трансплантату как возможной причины пиелонефрита. Контрастный препарат ретроградно вводился в мочевой пузырь, в дальнейшем испытуемым предлагалось в течение 1 ч находиться в горизонтальном положении, далее выполнялось исследование.
Статистическую обработку результатов исследования выполняли с использованием программ MS Excel и GraphPad Prism 8. Для проверки нормальности распределения полученных непрерывных переменных применяли критерий Шапиро–Уилка. При нормальном распределении показателей данные представляли в виде среднего арифметического (M) и стандартного отклонения (s) в формате M±s, в остальных случаях – в виде медианы с указанием интерквартильного размаха (Мe [Q1; Q3]). Различия считали статистически значимыми при р <0,05 при использовании t-критерия Стьюдента или U-критерия Манна–Уитни соответственно.
Результаты. Среднее число процедур, которые перенесли пациенты для устранения стриктуры до выполнения кишечной реконструкции мочеточника, составило 2,4 (от 1 до 7). Медиана длительности операции составила 240 мин (Q1 – 186 мин, Q3 – 307 мин), при этом в группе оперированных лапароскопическим доступом – 230 мин (Q1 – 186 мин, Q3 – 292 мин), время, затраченное на пластику при открытом доступе – 240 мин (Q1 – 202 мин, Q3 – 312 мин) (р >0,05).
У одного пациента, оперированного лапароскопически, отмечалось одно интраоперационное осложнение. После мобилизации кишечного трансплантата выявлена его нежизнеспособность, в связи с чем кишечный трансплантат был удален и произведен забор нового сегмента кишки.
Послеоперационные осложнения типа Clavien I, такие как рецидивирующий пиелонефрит, наблюдались у 2 (18,2%) пациентов после илеопластики, выполненной открытым доступом. В группе больных, оперированных лапароскопически, осложнения типа Clavien I выявлены у 3 (21,4%) пациентов. Пациентам данной группы после проведения полного курса антибактериальной терапии проведено рентгенологическое исследование для исключения рефлюкса по кишечному трансплантату (рис. 2). Данное исследование показало наличие пассивного и активного рефлюксов только до уровня средней трети неоуретера.

При лапароскопическом доступе время пребывания в стационаре после оперативного лечения составило в среднем 6 (от 5 до 8) дней, в том числе в отделении реанимации 0,7 (от 0 до 1) дня. Использование наркотических анальгетиков в послеоперационном периоде потребовалось 4 (28,5%) пациентам. Среднее число дренажей после лапароскопической операции – 1,3 (от 0 до 2 страховых дренажей), средний срок удаления дренажей – 4,4 (от 3 до 5) суток. Определялось минимальное отделяемое по страховым дренажам.
При открытом доступе медиана послеоперационных койко-дней составила 8 (от 5 до 11) дней, в отделении реанимации – 2 (от 1 до 5) дня. Практически во всех наблюдениях, за исключением одного пациента, с целью купирования болевого симптома потребовалось использование наркотических анальгетиков (91%). Число установленных дренажей составило в среднем 1,6 (от 1 до 2 страховых дренажей), средний срок удаления дренажа – 4 (от 3 до 5) суток. Отделяемое по дренажам наблюдалось от 20 до 180 мл за сутки.Все пациенты успешно прошли кишечную реконструкцию мочеточников. Тринадцати пациентам удалось провести стационарное контрольное обследование. Остальные были опрошены по телефону. Одна пациентка скончалась через 4 года после операции от тромбоэмболии легочной артерии. Еще одна пациентка умерла через 2 года вследствие прогрессирования онкологического заболевания.
В отдаленном послеоперационном периоде у обследованных пациентов отмечались стабилизация (n=8; 61,5%), улучшение (n=4; 30,8%) и у одного пациента ухудшение (n=1; 7,7%) почечной функции, характеризующейся стадией ХБП (С1–С4) и ДНСГ.
При оценке электролитных нарушений у 3 (23%) пациентов отмечен компенсированный гипокалиемический метаболический ацидоз. У 2 (15,4%) пациентов выявлен гиперхлоремический компенсированный метаболический ацидоз. Одна (7,7%) пациентка после двусторонней илеопластики была вынуждена принимать щелочные растворы в связи с развившимся в послеоперационном периоде декомпенсированным геперхлоремическим ацидозом. Еще у 1 (7,7%) пациентки, оперированной 6 мес. назад, выявлен компенсированный гипокалиемический гиперхлоремический ацидоз. Период наблюдения (ПН) за пациентами с электролитными отклонениями после заместительной тонкокишечной пластики был не более 24 мес., за исключением одного пациента, оперированного в 2018 г. (ПН – 38 мес.). Данный пациент имел низкую почечную функцию до оперативного лечения (СКФ – 20 мл/мин/1,73 м2, стадия – С4 ХБП) в связи с диабетической нефропатией, и несмотря на улучшение функционального состояния (СКФ – 25 мл/мин/1,73 м2, стадия – С4 ХБП), нивелировать данное отклонение не удалось.
У 1 (7,7%) пациента после илеопластики левого мочеточника, имплантированного в илеокондуит (после операции Брикера), определился декомпенсированный метаболический алкалоз. Кроме того, у данного пациента отмечена щелочная реакция мочи.
Один пациент, страдавший сахарным диабетом 2 типа и исходной стадией ХБП-4 (5,3%), в последующем был вынужден перейти на гемодиализную терапию. Причину прогрессирования ХБП до терминального состояния определить не представляется возможным ввиду отягощенного соматического состояния пациента (ОНМК на третьем году гемодиализа). Известно, что переход на заместительную почечную терапию был осуществлен к концу первого года с момента оперативного вмешательства.
При повторной госпитализации с целью обследования пациенты, которым выполнен пиелоилеоанатомоз, жаловались на периодически возникающий дискомфорт в поясничной области с оперированной стороны.
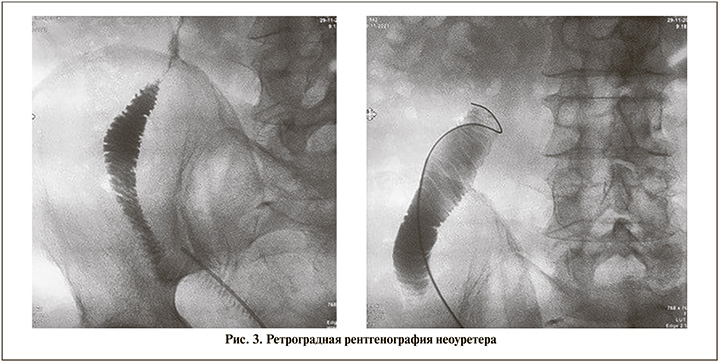
По данным ультразвукового контроля, экскреторной урографии, компьютерной томографии с внутривенным контрастированием нарушений уродинамики выявлено не было, за исключением одного наблюдения. Пациенту выполнена ретроградная рентгенография неоуретера (рис. 3) и антеградная фибропиелоскопия, с помощью которых диагностирована облитерация уретероилеоанастомоза.
У остальных пациентов отмечено сохранение умеренной дилатации почечной лоханки в отдаленном послеоперационном периоде, а ее размер напрямую коррелировал с предоперационными показателями.
При контрольном КТ-исследовании у одного пациента, оперированного 9 мес. назад, впервые выявлены желчные камни, которые на КТ перед оперативным лечением не визуализировались. По результатам КЩС не выявлено метаболических нарушений, однако образование камней в короткий срок после оперативного лечения связано с нарушением метаболизма, что требует дальнейшего обследования.
Обсуждение. Дефект мочеточника любой локализации может приводить к гидронефрозу с последующей потерей почечной функции. В настоящее время ятрогенные повреждения мочеточника и его радиационно-индуцированные стриктуры становятся доминирующими [1–4]. В нашем исследовании причинами стриктур, требующих кишечной реконструкции мочеточника в 96% наблюдений, являлись постлучевые и ятрогенные этиологические факторы. Этиологические факторы протяженных стриктур мочеточника, по данным литературы, представлены в табл. 1.

Oliver Engel и соавт. сравнивали выполнение кишечной пластики открытым доступом, лапароскопическим и роботическим с использованием хирургической системы Da Vinci. Авторы указывают на сопоставимые результаты при достаточном опыте хирурга [14]. А. Д. Кочкин и соавт. продемонстрировали эффективность и безопасность лапароскопических операций на когорте из 40 пациентов [15]. Robert J. Stein и соавт., сопоставив периоперационные результаты между открытой и лапароскопической подвздошнокишечной пластикой мочеточника, было продемонстрировано статистически значимое преимущество, связанное со снижением в использовании наркотических анальгетиков с целью купирования болевого синдрома, с тенденцией к сокращению сроков стационарного лечения [16]. В нашем исследовании также выявлено статистически значимое преимущество в послеоперационном восстановлении в группе больных, прооперированных лапароскопически. Отмечается сокращение послеоперационных койко-дней с 8 до 6. Меньшую травматичность данного метода демонстрируют и число установленных дренажей (среднее 1,3 в группе лапароскопии, 1,6 в группе больных, оперированных открытым доступом), минимальное отделяемое по ним и сроки их удаления.
Сложность реконструкции изолированным кишечным трансплантатом помимо технических аспектов самой операции связана с рубцово-склеротическими изменениями в зоне оперативного пособия из-за неоднократно перенесенных ранее оперативных вмешательств или лучевой терапии [12]. В нашей работе среднее число операций, выполненных до илеопластики, составило 2,1 (1–8). В их число вошли дренирующие операции на верхних мочевыводящих путях, эндоскопические операции при камнях мочеточника и почек и предыдущие неудачные пластики мочеточника. Число операций, выполненных до кишечной реконструкции, коррелирует со степенью ишемических, поствоспалительных и рубцовых изменений тканей забрюшинного пространства, что может негативно влиять на отдаленные результаты.
В одном из наиболее крупных исследований, оценивавших функциональные результаты, Arkadius Kocot и соавт. приводят отдаленные результаты 157 тонкокишечных пластик мочеточников [5]. Улучшение почечной функции наблюдалось в 84,6% наблюдений, стабилизация – в 10,3%, ухудшение – в 5,1%. В нашем исследовании у повторно обследованных пациентов отмечалась стабилизация стадии ХБП у 75% из них, улучшение – у 25%. Визуализирующие методы исследования также подтверждают сохранную функцию почечной паренхимы с оперированной стороны. Результаты других исследований представлены в табл. 2.

Результаты кишечной заместительной пластики напрямую зависят от опыта хирурга, опыта всей клиники и тщательного отбора пациента на предоперационном этапе.
Необходимо учитывать факторы, способные влиять на эффективность оперативного лечения. Следует осторожно оперировать пациентов с ХБП 4-й стадии и выше с учетом низкой компенсаторной возможности почек и уже имеющейся азотемии. Относительным противопоказанием к кишечной реконструкции служили сопутствовавшие расстройства мочеиспускания, способствовавшие повышению внутрипузырного давления, а следовательно, возникновению рефлюкса, что может приводить к усугублению метаболических нарушений и инфекционных осложнений.
Вероятность метаболических изменений после илеопластики тесно связана с исходной функцией почек [5].
У правильно подобранных пациентов риск развития длительного гиперхлоремического метаболического ацидоза невелик и составляет, по данным D. Joshua и соавт., 1,8% в когорте из 108 пациентов [4]. Распространенность гиперхлоремического метаболического ацидоза достоверно выше у пациентов с СКФ 4-й стадии. В ряде исследований подчеркивалось, что предоперационная оценка почечной функции является решающим прогностическим фактором при кишечной пластике [11]. Chung продемонстрировал, что у 50% пациентов с сывороточным креатинином менее 2,0 мг/дл наблюдается прогрессирование азотемии после кишечной реконструкции [21]. Wolff и соавт. доказали 90%-ную эффективность илеопластики при фокусировке на пациентах с предоперационным уровнем креатинина выше 1,7 мг/дл [12].
В нашем исследовании двое пациентов до оперативного лечения имели уровень креатина 0,22–0,28 мг/дл, что соответствует 4-й стадии ХБП. Один пациент был вынужден перейти на гемодиализную терапию, у второго отмечалось незначительное улучшение функции почек без смены стадии ХБП, также у него отмечался компенсированный гиперхлоремический метаболичесский ацидоз. У остальных пациентов с исходным уровнем креатинина выше 1,48 мг/дл отмечена тенденция к коррекции электролитных нарушений, возникающих в послеоперационном периоде с течением времени.
Площадь поверхности используемого сегмента кишки, концентрация растворенных веществ в моче, функции почек, рН мочи, а также продолжительность контакта слизистой с мочой являются причинами, определяющими различные метаболические нарушения, возникающие после использования подвздошнокишечного трансплантата. Чтобы минимизировать длину подвздошного трансплантата, Wenlong Zhong и соавт. предоставили клинические примеры илеопластики в комбинации с пластикой по Боари и методикой Psoas-Hitch при реконструкции тотальной стриктуры мочеточника [22]. Y. Pamecha и соавт. предложили уменьшение площади абсорбируемой поверхности путем сужения просвета кишки до 12 Ch [13]. Также имеется масса публикаций, демонстрирующих удовлетворительные результаты пластик протяженных стриктур путем реконфигурации кишечного трансплантата по технике Yang–Monti [23–25].
На основании представленных литературных данных и нашего собственного исследования, возможно, необходимо пациентам с ХБП-С4 предлагать альтернативные варианты пластик с целью уменьшения длины кишечного трансплантата, а следовательно, и площади слизистой кишки, способной абсорбировать мочу и потенциально повышать риск метаболических нарушений.
Заключение. Использование для пластики мочеточника подвздошнокишечного сегмента показало удовлетворительные результаты при длительном наблюдении, при тщательном отборе пациентов. По нашему мнению, использование лапароскопического доступа при кишечной реконструкции мочеточника дает преимущество в послеоперационном восстановлении без ущерба для функциональных результатов и может считаться «золотым» стандартом реконструктивной хирургии протяженных стриктур мочеточников.



