Актуальность. COVID-19 – острое респираторное вирусное заболевание, вызываемое коронавирусом 2-го типа SARS-CoV-2 и регистрируемое в настоящее время во всех странах мира; впервые было диагностировано в декабре 2019 г. в Ухани (Китай). 11.03.2020 ВОЗ внесла COVID-19 в Перечень социально опасных заболеваний и объявила о начале пандемии.
На конец июля 2020 г. общее число заболевших в мире превысило 15,5 млн, выздоровевших – 9,4 млн, умерших – 633 тыс. В РФ выявлено 795 038 случаев в 85 регионах, из них 3% протекало без клинических проявлений; с начала эпидемии в РФ 580 330 человек выздоровели, 12 892 – скончались [1].
Как показывает международная медицинская практика, данное заболевание сопровождается повреждением многих жизненно важных органов и систем. Наиболее уязвимыми перед вирусом SARS-CoV-2 оазались легкие, что связано с наличием в них ангиотензинпревращающего фермента 2-го типа (АПФ2), к которому присоединяется рецепторсвязывающий S-протеин SARS-CoV-2, располагающийся на поверхности вируса, а также с основным путем проникновения вируса в организм человека через верхние дыхательные пути [2]. Одним из тяжелых проявлений заболевания является вирусная пневмония, сопровождающаяся дыхательной недостаточностью из-за повреждения всех структур аэрогематического барьера – от альвеолярного эпителия (диффузное альвеолярное повреждение) до сосудистого русла легких (за рубежом предложен термин «эндотелиит»), развитием острого респираторного дистресс-синдрома.
В литературе представлено небольшое число аутопсийных исследований, что связано с принятыми во всем мире ограничительными и защитными мерами по вскрытию тел умерших от COVID-19, направленными на предотвращение распространения инфекции. В то же время подробно описаны особенности клинического течения новой вирусной инфекции. Так, основными причинами поступления в отделения реанимации и интенсивной терапии являются дыхательная недостаточность, сопровождающаяся гипоксией, и артериальная гипотония, требующая медикаментозной коррекции. Из особенностей течения COVID-19, которые могут приводить к летальному исходу, следует отметить развитие гиперкоагуляционного синдрома с тромбозами и тромбоэмболиями, инфарктами разных органов. Особо выражены такие изменения в легких, где объем пораженной альвеолярной ткани в виде диффузного альвеолярного повреждения (ДАП) и микроангиопатии может оказаться критичным и привести к гибели пациента. Эти изменения в легких связывают с прямым воздействием вируса и особенностями иммунного ответа организма на вирус, проявляющимися цитокиновым штормом, синдромом гиперактивности макрофагов (вторичного гемофагоцитарного лимфогистиоцитоза) и, возможно, аутоиммунными реакциями. Имеются результаты аутопсийных исследований, свидетельствующие о непосредственном влиянии вируса на почечную ткань, что может стать причиной острой почечной недостаточности (ОПН), особенно для пациентов с гипертонической болезнью, сахарным диабетом и ишемической болезнью сердца [3, 4].
Микроскопически у пациентов с ОПН определяется тяжелый острый тубулярный некроз. Кроме того, антиген к нуклеокапсидному протеину SARS-CoV-2 обнаружен в клетках почечных канальцев, что свидетельствует о прямом цитотоксическом воздействии вируса на эпителий почечных канальцев, вызывая их острое повреждение [5]. Кроме легких, почек, где АПФ2 экспрессируется эпителием проксимальных канальцев и подоцитами, поражаются эндотелии сосудов, сердце, селезенка, печень, кишечник, головной мозг. Таким образом, новая вирусная инфекция в той или иной степени затрагивает все органы и системы человека, в которых экспрессируется АПФ2, либо воздействует опосредованно – через развитие цитокинового шторма, синдрома гиперактивности макрофагов, активации путей прокоагуляции, гиперкоагуляции, нарушения регуляции системы комплемента (образование комплементмембранатакующего комплекса), развитием микроангиопатии и, возможно, аутоиммунных реакций.
Учитывая очевидную актуальность проблемы и ограниченную выборку аутопсийных исследований, подкрепленных клиническими данными, позволяющими изучать влияние вируса SARS-CoV-2 на ткани и органы человека, нашим междисциплинарным коллективом в рамках научно-исследовательской работы проведено исследование аутопсийного материала 37 пациентов, умерших от COVID-19, с акцентом на изменения в почках.
Материалы и методы. Исследование проведено на базе ГКБ им. С. И. Спасокукоцкого Департамента здравоохранения города Москвы и кафедр урологии и патологической анатомии МГМСУ им. А. И. Евдокимова.
В исследование включены данные аутопсий 37 пациентов с подтвержденным методом ПЦР и результатами вскрытий диагнозом COVID-19 в возрасте от 28 до 94 лет.
Патологоанатомические вскрытия проводили в перепрофилированном патологоанатомическом отделении ГКБ им. С. И. Спасокукоцкого Департамента здравоохранения города Москвы врачами-патологоанатомами и санитарами, прошедшими специальное обучение в строгом соответствии с правилами безопасности. Детально изучали и фиксировали макроскопические изменения органов, проводили гистологическое исследование образцов разных органов, используя стандартные методы с окраской гематоксилином и эозином.
Результаты. Средний возраст пациентов составил 68,6 года. Мужчин было 20 (средний возраст – 59,2 года), женщин – 17 (средний возраст – 79,7 года).
Все пациенты имели хотя бы одно коморбидное заболевание, наиболее часто встречающимися из которых были ишемическая болезнь сердца, гипертоническая болезнь, хроническая обструктивная болезнь легких, сахарный диабет и ожирение. Ожирение разной степени выраженности отмечено у 13 пациентов, у пятерых в анамнезе были злокачественные новообразования.
Манифестировало заболевание у всех пациентов по-разному. Большинство пациентов предъявляли жалобы на боль в горле, насморк, отсутствие обоняния, покраснение и зуд глаз. У 7 пациентов нами были выявлены патогномоничные для COVID-19 кожные симптомы в виде крапивницы – преимущественно на локтевых и коленных сгибах. В 100% случаев отмечены фебрильная температура и малопродуктивный кашель.
В стационар пациенты поступали в различные сроки от начала заболевания. Среднее время амбулаторного наблюдения и лечения составило 3,5 дня. На догоспитальном этапе все пациенты принимали антибактериальные препараты, наиболее часто – макролиды и фторхинолоны. Также проводилась симптоматическая жаропонижающая терапия. Поводом для госпитализации во всех случаях была неэффективность проводимой терапии и нарастание дыхательной недостаточности.
При поступлении в стационар все пациенты проходили стандартное обследование, включившее забор материала из ротоглотки для выполнения ПЦР на SARS-CoV-2; проводились также экспресс-анализы на качественное определение IgM и IgG SARS-CoV-2, вируса гриппа. В 100% случаев КТ легких выявила рентгенологическую картину вирусной пневмонии в виде изменений в легких по типу «матового стекла» с различной площадью поражения.
В отделениях пациентам проводилась терапия согласно временным рекомендациям Минздрава России, актуальным на момент поступления пациента. В числе наиболее часто назначаемых препаратов были азитромицин, плаквенил и калетра. Большинство пациентов получали короткие курсы гормональной терапии (преднизолон, дексаметазон). В качестве жаропонижающего средства использовали парентеральное введение парацетамола. Всем пациентам была назначена антикоагулянтная терапия (клексан, фраксипарин, гепарин) в дозировках, рассчитанных на массу тела, в соответствии с клиническими рекомендациями. Кроме того, проводили коррекцию коморбидных заболеваний (сахарный диабет, сердечная недостаточность, артериальная гипертония и т.д.). Следует отметить, что на момент написания статьи закончены клинические испытания препарата фавипиравир, доказавшего свою эффективность, и новая схема лечения пациентов прописана в очередной актуальной версии временных клинических рекомендаций Минздрава России.
У пациентов с цитокиновым штормом и при неэффективности проводимой терапии были применены препараты, ингибирующие интерлейкин-6 (тоцилизумаб) и янус-киназы 1–3 (тофацитиниб) в дозировках, рассчитанных на массу тела в соответствии с клиническими рекомендациями.
Несмотря на проводимую терапию, 26 пациентов были интубированы и находились на искусственной вентиляции легких (ИВЛ) в течение 1–20 сут. Одиннадцати пациентам интубация не проводилась, однако все они находились на неинвазивной ИВЛ под контролем индекса оксигенации. У всех пациентов отмечено повышение уровня Д-димера до 347–9123 нг/мл (в среднем – 2303 нг/мл) эа последние сутки перед летальным исходом. У 35 пациентов фиксировали повышенный уровень креатинина – от 100 до 817 нг/мл, в среднем – 275 мкмоль/мл. Также у всех пациентов отмечено увеличение содержания С-реактивного белка (СРБ) до 20–698 мг/мл, в среднем до 250 мг/мл (табл. 1).
Макроскопическое исследование. В слизистых оболочки трахеи отмечались очаговые кровоизлияния. Легкие увеличены в объеме и массе, диффузно отечны и уплотнены, полнокровны, резко пониженной воздушности. Такая макроскопическая картина характерна для «шокового легкого». Тромбоэмболы в крупных ветвях легочных артерий не визуализировались. У большинства пациентов в просвете бронхов определялась розовая пена, у части пациентов – серозно-геморрагический выпот в плевральной полости и перикарде. На разрезе ткань легких темно-красного цвета с участками кровоизлияний, в части случаев выявлялись тромбы ветвей легочных вен и артерий, геморрагические инфаркты.
Почки у большинства пациентов были нормального размера, в некоторых случаях отмечались полнокровие кортикомедуллярного шунта и мелкие кровоизлияния в корковом слое.
Микроскопическое исследование. Гистологическое исследование ткани легких выявило ДАП у всех пациентов. При COVID-19 гистологические изменения соответствовали классическим фазам ДАП [6, 7].
Диффузное альвеолярное повреждение в ранней (экссудативной) фазе наблюдалось у четырех пациентов и характеризовалось десквамацией пневмоцитов альвеол, выраженным интраальвеолярным отеком, формированием гиалиновых мембран, вирусным цитопатическим эффектом в альвеоцитах 2-го типа, выраженным полнокровием артерий, вен и капилляров межальвеолярных перегородок, фибриновыми тромбами в разной стадии и сладжами эритроцитов в сосудах, обширными кровоизлияниями в альвеолах, бронхах, бронхиолах; периваскулярно определялся невыраженный мононуклеарный инфильтрат. У остальных пациентов выявлялись признаки перехода ДАП в позднюю (пролиферативную) фазу: появление фибрина в просветах альвеол, обширные поля организующейся пневмонии и облитерирующего бронхиолита. У 6 пациентов помимо ДАП определялись признаки бактериальной пневмонии.

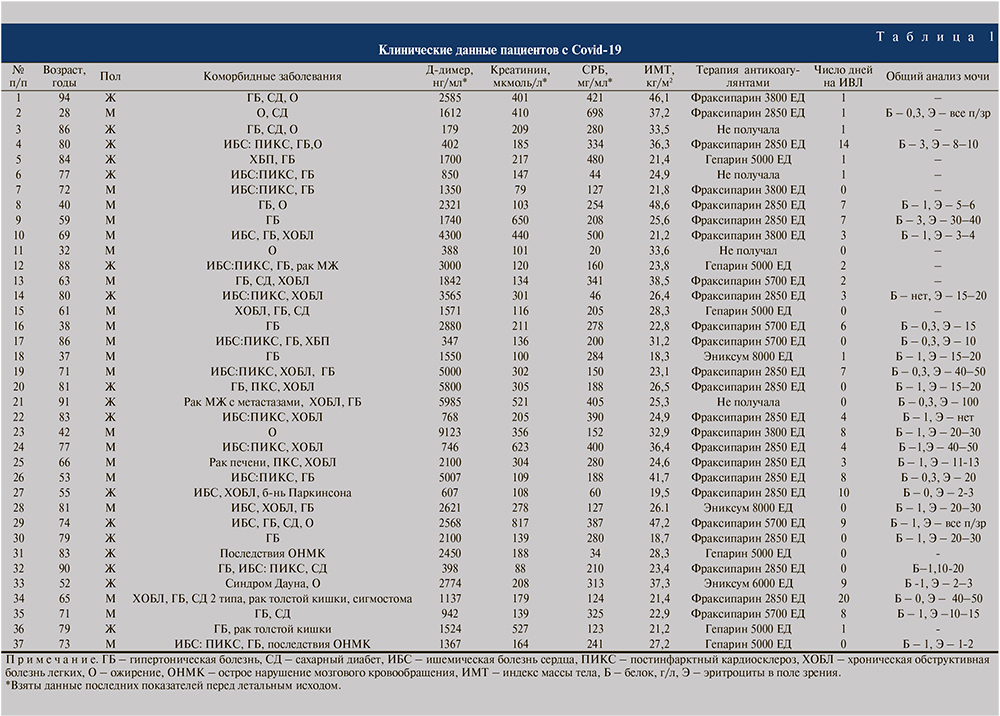
В почках у всех пациентов имелись признаки острого повреждения канальцев, проявляленные повреждением щеточной каемки в проксимальных почечных канальцах, вакуольной дистрофией клеток и дилатацией проксимальных почечных канальцев, клеточным детритом и скоплением эритроцитов в просвете (рис. 1), у 4 пациентов определялись некротические изменения проксимальных канальцев (рис. 2). В большинстве случаев выявлялось выраженное полнокровие сосудов микроциркуляторного русла со сладжами и лизисом эритроцитов, периваскулярными кровоизлияниями. У трех пациентов с микрогематурией в эпителии канальцев определялись гранулы гемосидерина, что также является косвенным признаком острого повреждения канальцев почек (рис. 3). По степени выраженности острого поражения канальцев мы разделили пациентов на три группы: с выраженным поражением (n=8), умеренно выраженным поражением (n=18) и невыраженным поражением (n=11).
В дистальных канальцах и собирательных трубочках отмечались только незначительные изменения – невыраженный отек, белковые цилиндры. Очаговые лимфоцитарные инфильтраты визуализировались в участках неспецифического фиброза, в том числе под капсулой почки.
В клубочках почек определялись коллапс части клубочков со скоплением эозинофильных белковых масс в полости капсулы Боумена–Шумлянского, склероз и гиалиноз разной степени выраженности, связанные с нефропатией при сахарном диабете и гипертонической болезни (артериосклеротический нефросклероз).
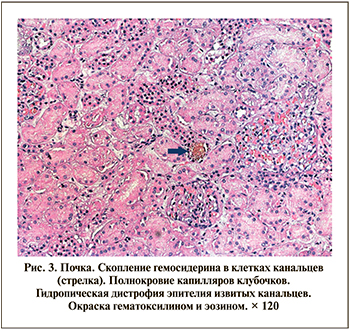
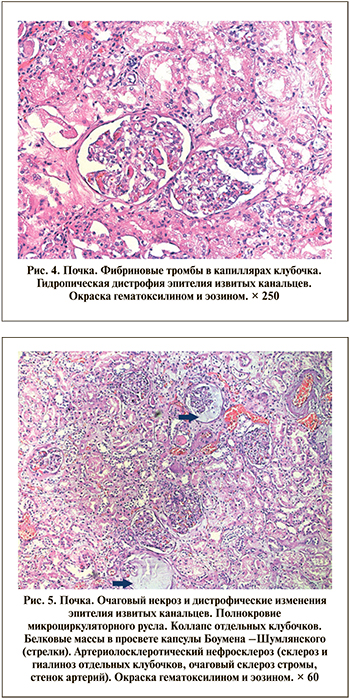
В нескольких случаях в гломерулярных капиллярах определялись сегментарные фибриновые тромбы (рис. 4), что, вероятно, вызвано гиперкоагуляционным синдромом и, возможно, повреждением эндотелия. Ишемические изменения в виде уменьшения размеров клубочка и скоплением плазмы в капсуле Боумэна–Шумлянского определялись в четырех случаях (рис. 5).
 Обсуждение. Мы описали изменения в почках пациентов, умерших от дыхательной недостаточности, вызванной COVID-19. У всех пациентов доминирующим процессом было поражение легких в виде ДАП, сопровождавшееся микроангиопатией с тромбозом сосудов и кровоизлияниями, которое считается одной из причин летального исхода [8, 9], что подтверждает наше исследование. Однако изучение ткани почек выявило также ангиопатию сосудов почек [5]. У всех пациентов отмечались признаки острого поражения канальцев почки разной степени выраженности, начиная от нарушения щеточной каемки, заканчивая фокусами некроза проксимальных канальцев. Фибриновые тромбы в капиллярах в отсутствие других признаков ДВС-синдрома подтверждают возможность повреждения эндотелия. Учитывая патоморфологическую картину, можно предположить, что острое повреждение канальцев почки при COVID-19 имеет многофакторную природу. С одной стороны, нарушение функции почки может быть результатом гипоксии и недостаточности правого желудочка вследствие пневмонии. С другой стороны, дисфункция левого желудочка может сопровождаться снижением сердечного выброса и гипоперфузией почек. Причиной острого поражения канальцев почки может быть непосредственное воздействие SARS-CoV-2 на эндотелиальные клетки [4, 10]. Также SARS-CoV-2 может напрямую воздействовать на эпителий канальцев и подоциты, имеющие рецепторы АПФ-2, и вызывать митохондриальную дисфункцию, острый тубулонекроз, формирование вакуолей из-за резорбции протеина, коллапсную гломерулопатию [4, 10] и выход плазмы в капсулу Боумена–Шумлянского. Другой потенциальный механизм острого повреждения канальцев почки связан с SARS-CoV-2-ассоциированным иммунным ответом – цитокиновым штормом. Кроме того, причиной повреждения почек могут выступать рабдомиолиз, синдром активации макрофагов, микротромбоз и микроэмболия вследствие гиперкоагуляции и эндотелиита.
Обсуждение. Мы описали изменения в почках пациентов, умерших от дыхательной недостаточности, вызванной COVID-19. У всех пациентов доминирующим процессом было поражение легких в виде ДАП, сопровождавшееся микроангиопатией с тромбозом сосудов и кровоизлияниями, которое считается одной из причин летального исхода [8, 9], что подтверждает наше исследование. Однако изучение ткани почек выявило также ангиопатию сосудов почек [5]. У всех пациентов отмечались признаки острого поражения канальцев почки разной степени выраженности, начиная от нарушения щеточной каемки, заканчивая фокусами некроза проксимальных канальцев. Фибриновые тромбы в капиллярах в отсутствие других признаков ДВС-синдрома подтверждают возможность повреждения эндотелия. Учитывая патоморфологическую картину, можно предположить, что острое повреждение канальцев почки при COVID-19 имеет многофакторную природу. С одной стороны, нарушение функции почки может быть результатом гипоксии и недостаточности правого желудочка вследствие пневмонии. С другой стороны, дисфункция левого желудочка может сопровождаться снижением сердечного выброса и гипоперфузией почек. Причиной острого поражения канальцев почки может быть непосредственное воздействие SARS-CoV-2 на эндотелиальные клетки [4, 10]. Также SARS-CoV-2 может напрямую воздействовать на эпителий канальцев и подоциты, имеющие рецепторы АПФ-2, и вызывать митохондриальную дисфункцию, острый тубулонекроз, формирование вакуолей из-за резорбции протеина, коллапсную гломерулопатию [4, 10] и выход плазмы в капсулу Боумена–Шумлянского. Другой потенциальный механизм острого повреждения канальцев почки связан с SARS-CoV-2-ассоциированным иммунным ответом – цитокиновым штормом. Кроме того, причиной повреждения почек могут выступать рабдомиолиз, синдром активации макрофагов, микротромбоз и микроэмболия вследствие гиперкоагуляции и эндотелиита.
Специфического лечения острого поражения почек при COVID-19 нет, поэтому важно поддерживать функцию почек любыми доступными способами. Тяжелым пациентам необходимо контролировать уровень креатина плазмы, объем выделяемой мочи, протеинурию и микрогематурию. Важен контроль водного баланса с целью не допустить гиперволемию и минимизировать риск развития отека легких, перегрузки правого желудочка и как следствие – острого поражения канальцев почки. С другой стороны, на догоспитальном этапе высокая температура тела часто приводит к обезвоживанию, поэтому так важна коррекция гиповолемии для профилактики острого поражения канальцев почки.
Заключение. Для COVID-19 характерно мультиорганное поражение. Почки являются одним из тех органов, который может быть существенно затронут при данной инфекции. Анализ изменений почек у пациентов, умерших от COVID-19, говорит о необходимости контролировать показатели функции почек при тяжелом течении заболевания.



