Введение. Актуальность рака почки (РП) определяется его сравнительно высокой распространенностью, которая составляет 2–3% в структуре общей онкологической заболеваемости [1]. В России в 2015 г. выявлено более 11 тыс. новых случаев этого заболевания, 10-летний прирост составил 40–48% [2]. Основной метод лечения РП – хирургический. Органосохраняющие операции являются методом выбора лечения локализованных форм РП во всех случаях, когда это технически осуществимо [3, 4]. Этот вид хирургического лечения демонстрирует сопоставимые онкологические результаты [5–7] при существенно меньшем влиянии на почечную функцию по сравнению с радикальной нефрэктомией, что приводит к увеличению общей выживаемости [8, 9]. С активным внедрением роботизированной хирургии опыт и качество выполнения органосохраняющих операций прогнозируемо росли, что сделало возможным выполнение резекций почек при крупных и сложных опухолях [10]. Однако в современной отечественной литературе представлено небольшое число научных работ, посвященных органосохраняющим операциям при этих вариантах опухолей почек.
Стадирование онкологического процесса в почке, а соответственно, и выбор тактики лечения преимущественно осуществляют на основании размера опухоли. Однако этого параметра недостаточно для оценки сложности оперативного вмешательства и прогнозирования интра- и послеоперационных осложнений. С этой целью в хирургическую практику были введены различные стандартизированные нефрометрические системы: RENAL, PADUA, C-Index, DAP и др. [11–14]. Наиболее часто используют шкалу RENAL, которая учитывает размер опухоли, характер ее роста, близость к чашечно-лоханочной системе, а также отношение новообразования к полярным линиям почки. Исходя из вышеуказанных критериев, опухоли присваивается определенное число баллов. При индексе 4–6 баллов опухоли считаются низкой степени сложности, 7–9 – средней, 10–12 баллов – высокой степени сложности.
Цель исследования: проанализировать результаты лечения больных РП, которым выполнялась органосохраняющая операция при крупных и сложных опухолях почки (индекс RENAL ≥10)
Материалы и методы. Проведен ретроспективный анализ результатов лечения пациентов, прооперированных в СПбГБУЗ «Городская больница № 40» с 2013 по 2018 г.
За указанный период времени нами выполнена 361 операция по поводу новообразования почки, из них 207 (57,34%) – органосохраняющие. Всем пациентам в рамках предоперационного обследования была проведена компьютерная томография с контрастным усилением и созданием трехмерной модели с целью определения размера, локализации опухоли, оценки архитектоники сосудов почки и непосредственно новообразования. Для оценки возможности выполнения органосохраняющей методики и прогнозирования осложнений оперативного вмешательства мы использовали нефрометрическую шкалу RENAL.
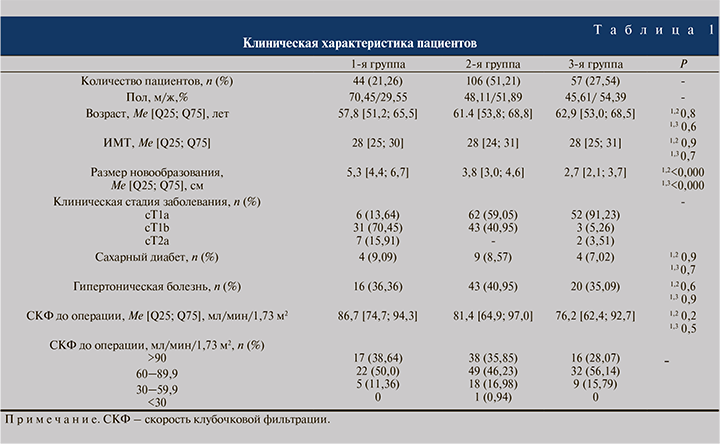
Клинические данные наблюдаемых нами пациентов представлены в табл. 1. При оценке по шкале RENAL новообразование высокой степени сложности (индекс – 10–12, 1-я группа) зафиксировано у 44 (21,26%) пациентов, средней степени (индекс – 7–9, 2-я группа) – у 106 (51,21%) и низкой (индекс – 4–6, 3-я группа) – у 57 (27,54%). В первой группе преобладали пациенты мужского пола (70,5%), медиана возраста пациентов составила 58 лет, индекса массы тела – 28 кг/м2 и размера опухоли – 5,3 см. Вторая и 3-я группы достоверно различались только меньшим размером опухоли.
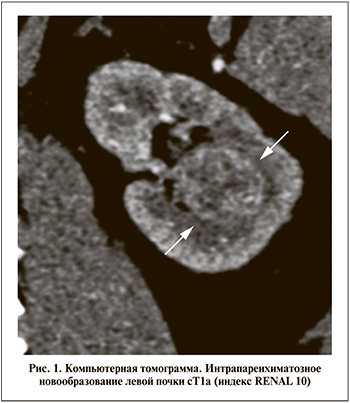 В 1-й группе пациентов только у каждого десятого (13,64%) диагностирована стадия cТ1а, преобладали опухоли стадии cТ1b (70,45%) и практически у каждого шестого (15,91%) выявлены более крупные образования (стадия cТ2а). Особенностью небольших опухолей (до 4 см) этой группы стал их интрапаренхиматозный рост (рис. 1). Во 2-й и 3-й группах значительно преобладали пациенты с малыми опухолями (cТ1а) – в 59,05 и 91,23% случаев соответственно, опухоли большего размера встречались в 40,95 и 8,77% наблюдений соответственно.
В 1-й группе пациентов только у каждого десятого (13,64%) диагностирована стадия cТ1а, преобладали опухоли стадии cТ1b (70,45%) и практически у каждого шестого (15,91%) выявлены более крупные образования (стадия cТ2а). Особенностью небольших опухолей (до 4 см) этой группы стал их интрапаренхиматозный рост (рис. 1). Во 2-й и 3-й группах значительно преобладали пациенты с малыми опухолями (cТ1а) – в 59,05 и 91,23% случаев соответственно, опухоли большего размера встречались в 40,95 и 8,77% наблюдений соответственно.
Сахарный диабет и гипертоническая болезнь как заболевания, влияющие на функцию почки, регистрировали у 7,02–9,90% и 35,09–40,95% пациентов с отсутствием достоверных различий между исследуемыми группами. Медиана скорости клубочковой фильтрации (СКФ) до операции также была сопоставимой во всех группах. Однако в каждой из них у 11,36–16,98% обследованных зафиксировано снижение этого показателя – менее 60 мл/мин/1,73 м2.
Особенности выполнения оперативных вмешательств при опухолях высокой степени сложности
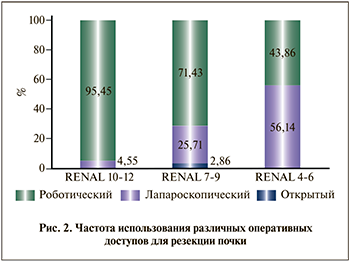 Виды оперативных доступов, использованных при резекции опухоли почки, представлены на рис. 2. При индексах RENAL-10–12, -7–9 и -4–6 робот-ассистированные операции выполнены у 95,45, 71,43 и 43,86% пациентов соответственно. К остальным применялись лапароскопические методики. Только 3 (1,45%) больных были прооперированы открытым доступом.
Виды оперативных доступов, использованных при резекции опухоли почки, представлены на рис. 2. При индексах RENAL-10–12, -7–9 и -4–6 робот-ассистированные операции выполнены у 95,45, 71,43 и 43,86% пациентов соответственно. К остальным применялись лапароскопические методики. Только 3 (1,45%) больных были прооперированы открытым доступом.
Робот-ассистированную и лапароскопическую резекции почки выполняли по сходной методике. Операции осуществляли трансабдоминальным или ретроперитонеальным доступом по стандартным методикам. В первом случае основные этапы вмешательства включали мобилизацию толстой и/или двенадцатиперстной кишки, препарирование почечной ножки, выделение почки и новообразования. Второй доступ применяли при локализации новообразования в области нижнего полюса почки и/или по задней ее поверхности. В таких случаях в поясничной области с помощью баллонного диссектора создавали рабочее пространство с последующим выделением почечной ножки и новообразования. Для уточнения границ новообразования, нанесения демаркационной линии на поверхность почки, локализации крупных сосудов, питающих непосредственно новообразование, использовали интраоперационную ультразвуковую навигацию. При робот-ассистированных операциях использовали функцию Tile Pro, которая позволяет отображать картину в режиме реального времени на экране консоли роботической системы.
В зависимости от особенностей архитектоники почечных сосудов и сосудов, питающих непосредственно опухоль, мы использовали различные типы ишемии почки: без пережатия почечных сосудов, сегментарную и тотальную ишемию. При нескольких почечных артериях или раннем делении основной почечной артерии на ветви и возможности выделения сегментарных артерий и их временного клипирования применяли методику сегментарной ишемии. С целью снижения тяжести ишемического поражения почечных канальцев на фоне полного пережатия сосудов почки, уменьшения кортикального вазоспазма, восстановления оптимальной почечной перфузии и нормализации оксигенации тканей почки мы проводим нефропротективную терапию (внутривенное введение манитола перед созданием тотальной ишемии почки и фуросемида после снятия сосудистого зажима с почечной ножки).
Одним из залогов успешности выполнения вмешательства служит «сухое» операционное поле, обеспечивающее условия для качественной визуализации и возможности для максимального сохранения функционирующей паренхимы органа, целостности чашечно-лоханочной системы (ЧЛС), правильной обработки интрапаренхиматозных сосудов, сокращения частоты положительного хирургического края (ПХК). При повреждении ЧЛС проводили ушивание дефекта. Второй ряд швов (реконструкция паренхимы почки) накладывали после удаления зажимов с почечных сосудов, что позволило дополнительно сократить продолжительность периода ишемии.
При интрапаренхиматозном росте опухоли после визуализации новообразования при помощи интраоперационной УЗ-навигации выполняли рассечение почечной паренхимы над новообразованием и энуклеацию опухоли с последующим прошиванием интрапаренхиматозных сосудов и восстановлением целостности паренхимы почки.
При резекции крупных образований, выполняющих один из полюсов почки, проводили операцию по типу геминефрэктомии с восстановлением герметичности ЧЛС, лигированием крупных сосудов и сопоставлением паренхимы.
Удаленное новообразование и паранефральную клетчатку подвергали патоморфологическому исследованию с целью морфологической верификации диагноза и определения распространенности онкологического процесса.
Классификацию послеоперационных осложнений осуществляли по системе Clavien–Dindo [15]. Любое атипичное течение послеоперационного периода трактовалось как осложнение.
Статистическая обработка результатов выполнена с применением стандартных программх для персональных компьютеров (MS Offiсe Excel и Statistica 8.0 (StatSoft Inc., США)). Сравнение независимых групп проводили непараметрическими методами: U-критерий Манна–Уитни и критерий Краскела–Уоллиса – для сравнения количественных и критерий χ2 Пирсона – для качественных признаков. Сопоставление зависимых групп результатов проводили с помощью критерия Вилкоксона. Статистически значимым для всех показателей считался критерий достоверности р≤0,05.

Результаты исследования. Медиана наблюдения за пациентами составила 38,6 [22,4; 61,8] мес. Как следует из представленных в табл. 2 данных, только продолжительность оперативного вмешательства достоверно зависела от сложности новообразования, тогда как остальные параметры (объем кровопотери, частота гемотрансфузии, длительность пребывания в стационаре) статистически значимо не различались.
Распределение интра- и послеоперационных осложнений в зависимости от индекса шкалы RENAL представлено в табл. 3. Интраоперационые осложнения зафиксированы у 10 (4,83%) пациентов. Они включали кровотечение объемом более 500 мл у 6 пациентов, а также повреждение внутренних органов (селезенки и диафрагмы) – у 2. Оба – в группе сложных опухолей. Частота интраоперационных осложнений во всех группах была сопоставимой (p>0,5).
В послеоперационном периоде мы зафиксировали 42 осложнения у 40 (19,32%) прооперированных. В 1-й группе в 2 (4,55%) наблюдениях развились осложнения, потребовавшие медикаментозной терапии (Grade I–II) и в 7 (15,91%) – серьезные послеоперационные осложнения (кровотечения и мочевые свищи, Grade III), потребовавшие хирургической коррекции. Во 2-й и 3-й группах несерьезные осложнения диагностированы в 1,7–8,49%, серьезные – в 8,77–9,43% случаев соответственно. Жизнеугрожающее осложнение (инфаркт миокарда) развилось только у 1 пациента из 3-й группы и разрешилось после коронарного стентирования. Ни одного случая смерти ни во время, ни после операции зафиксировано не было.

Также мы оценивали параметры и виды ишемии почки, их влияние на почечную функцию (табл. 4). В табл. 4 приведены данные о вариантах использованной ишемии почки в зависимости от степени сложности опухоли. В группе пациентов с индексом RENAL-10–12 преобладающим (70,45%) вариантом оказалась тотальная тепловая ишемия. Возможности применения сегментарной ишемии были реализованы несколько реже – у трети (27,27%) пациентов. В группах пациентов с индексом RENAL-7–9 и -4–6 практически с равной частотой применялась тотальная или сегментарная ишемия. Операции без ограничения кровотока в почке преимущественно проводились при новообразованиях небольших размеров, локализованных в корковом слое паренхимы почки. Медиана продолжительности тотальной тепловой ишемии составила 20, 17 и 13 мин в 1, 2 и 3-й группах соответственно. Только в каждом 6-м (15,91%) случае при сложных новообразованиях она превышала 25 мин.
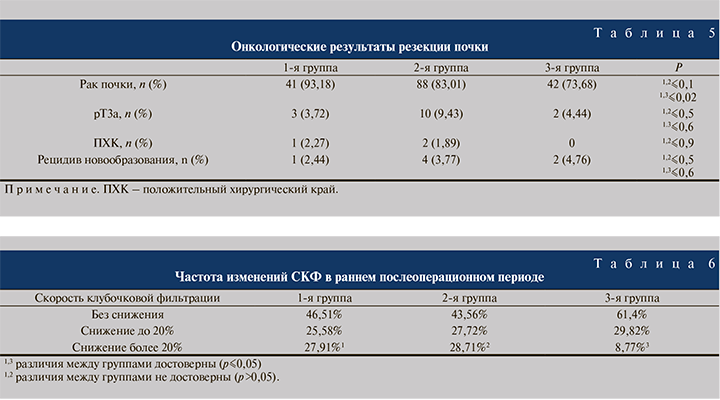
Злокачественный характер образований достоверно чаще определялся в 1-й группе (93,18%) пациентов по сравнению со 2-й (83,01%) и 3-й (73,68%) группами (табл. 5). Распространение опухоли за пределы капсулы почки и/или инвазия в почечный синус зафиксированы у 3,72–10,87% пациентов в отсутствие достоверных различий между группами. Положительный хирургический край зафиксирован в единичных случаях в группах высокой и средней сложности (1,89–2,27%). Парадоксально, но в 1-й группе рецидив новообразования встречался в 2 раза (2,44%) реже, чем во 2-й (4,55%) и 3-й (4,76%) группах соответственно. Однако различие это было недостоверным (p>0,05).
Анализ СКФ проведен пациентам в дооперационном и раннем послеоперационном периодах на 1–3-и сутки после операции (табл. 6). В 1-й группе более, чем у половины (53,49%) пациентов снизилась СКФ, при этом более, чем у каждого четвертого (27,91%), больше, чем на 20%. Сходные результаты нами получены и во 2-й группе. В 3-й группе (опухоли почки минимальной сложности) эти показатели достоверно различались: у 2/3 наблюдаемых показатель СКФ не ухудшился и только у 8,77% пациентов снизился более чем на 20% (р<0,05).
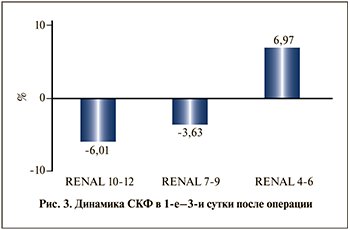 На рис. 3 отображена динамика изменения СКФ после хирургического вмешательства. В 1-й группе пациентов отмечено наиболее значимое среднее снижение уровня СКФ – на 6,01%. Во 2-й группе СКФ снизилась на 3,63%, в 3-й группе зафиксирован рост этого показателя на 6,97%.
На рис. 3 отображена динамика изменения СКФ после хирургического вмешательства. В 1-й группе пациентов отмечено наиболее значимое среднее снижение уровня СКФ – на 6,01%. Во 2-й группе СКФ снизилась на 3,63%, в 3-й группе зафиксирован рост этого показателя на 6,97%.
Обсуждение. В последние годы развитие хирургической техники, совершенствование методик оперативных вмешательств, накопление опыта хирургов позволили расширить показания к органосохраняющим операциям при РП, включив более крупные и сложные образования [16–19]. Ведущие руководства рекомендуют выполнять резекцию почки во всех случаях, когда это позволяют опыт хирурга, технические возможности и это не вредит онкологическим результатам [20; 21]. В своей клинической практике мы придерживаемся подобной тактики с 2013 г. [10].
Органосохраняющие операции при крупных и сложных опухолях – весьма трудоемкие вмешательства, требующие большого хирургического опыта и серьезного предоперационного планирования. Так, по данным литературы, частота выполнения резекций почек при стадии cТ1b составляет 11–50%, при cТ2a – только 1–10% [7, 22, 23]. Однако частота малоинвазивных органосохраняющих операций при крупных опухолях (cТ1b) составляет 13–15% [24, 25] и совсем незначительна при стадии cТ2 – 2–3% [26, 27].
В нашей выборке этот показатель составил 4,35% от общего числа выполненных резекций почек.
При выполнении органосохраняющих операций при крупных и сложных опухолях чаще всего прибегают к открытому доступу (56–59%), робот-ассистированная методика используется в 27–44% случаев, традиционный лапароскопический доступ – в 12% [28, 29]. D. B. Hennessey et al. сообщают, что частота органосохраняющих операций при опухолях с индексом RENAL≥10 составляет всего 12,4% [30]. В подобных клинических ситуациях нами практически во всех случаях использован хирургический робот да Винчи и только в 5% случаев выбран доступ с применением лапароскопической техники. Открытый доступ в данной выборке пациентов не использовался.
Органосохраняющие операции сопровождаются большим количеством осложнений, чем при нефрэктомиях. Отмечается, что чем больше размер и сложнее расположение опухоли, тем выше вероятность интра- и постоперационных осложнений [16]. Частота послеоперационных осложнений после робот-ассистированной резекции почки при крупных опухолях (Т1b–Т2 стадии) составляет 4–23% [31, 32]. В исследовании [17] послеоперационные осложнения после робот-ассистированной резекции почек при сложных опухолях (PADUA ≥10) возникли в 29% случаев.
В нашей выборке анализ показал, что частота развития послеоперационных осложнений составила 23,0%, а количество серьезных осложнений (Clavien–Dindo ≥3) – 16%.
Выполнение органосохраняющей операции при крупных и сложных опухолях требует увеличения времени ишемии. Так, при робот-ассистированной резекции опухолей стадии Т1b в 18–53% случаев продолжительность ишемии превышает 25 мин [33, 34]. Результаты многоцентрового исследования показали, что медиана тепловой ишемии почек при робот-ассистированной резекции сложных опухолей составляет 23 мин [30]. В нашей работе этот показатель составил 20 мин, а время тепловой ишемии более 25 мин зафиксировано лишь в 16% случаев.
Частота ПХК составляет 3% и 4–8% при стадии cТ1b и cТ2 соответственно [35, 36]. A. Volpe et al. [18], выполнив 44 робот-ассистированные резекции почки пациентам со сложными опухолями, ПХК констатировали в 5% случаев, что несколько чаще, чем в нашей работе (2%). А. Raheem et al. [19] сравнили онкологические результаты пациентов с опухолями легкой, средней и высокой степеней сложности и по частоте ПХК получили сопоставимые результаты.
Анализ наших данных выявил наибольшее среднее снижение СКФ в раннем послеоперационном периоде в 1-й группе (на 6,01%) пациентов, сопоставимое с показателем 2-й группы (р>0,05). Применение нефропротективной терапии обеспечивает усиление почечного кровотока и диуреза, что в свою очередь приводит к увеличению СКФ. На фоне интраоперационного проведения нефропротективной терапии и незначительного повреждения почечной ткани при проведении резекции в группе опухолей низкой степени сложности (3-я группа) отмечено увеличение СКФ на 6,97% в раннем послеоперационном периоде.
Заключение. Органосохраняющие операции при сложных опухолях (индекс RENAL ≥10) – эффективная и безопасная альтернатива радикальной нефрэктомии. Применение малоинвазивных подходов возможно практически при любых размерах и сложности опухоли почки. Однако робот-ассистированные операции оправданно можно рассматривать как наилучший метод с большим техническим потенциалом при резекции сложных опухолей почки, обеспечивающий наименьший уровень интра- и послеоперационных осложнений, максимальное сохранение почечной функции и приемлемые онкологические результаты. Данная методика технически сложна и требует большого хирургического опыта. Робот-ассистированная хирургия позволяет расширять показания к органосохраняющим операциям, дает возможность использования малоинвазивного подхода даже в самых сложных клинических ситуациях хирургического лечения РП.



