Введение. Инфекции нижних мочевыводящих путей (ИНМП) у женщин – одна из наиболее распространенных проблем, с которыми приходится сталкиваться врачам-урологам [1–4]. В 50% случаев они приобретают рецидивирующий характер [1, 2, 5, 6]. Хронический рецидивирующий бактериальный цистит (ХРБЦ) служит причиной обращения к врачу более 7 млн женщин в мире ежегодно [1, 5]. Данное заболевание приводит к резкому снижению физической и психической активности, ограничению свободы передвижений и откладывает свой отпечаток на психоэмоциональном статусе больных [6]. Риск возникновения ИНМП увеличивается с наступлением пери- и постменопауз [1].
Урогенитальная атрофия в пери- и постменопаузах возникает в стероидзависимых тканях и структурах нижней трети мочеполового тракта: влагалище, мочевом пузыре, связочном аппарате малого таза мышцах тазового дна, и сопровождается комплексом вагинальных и мочевых симптомов [7, 8]. Атрофические изменения в урогенитальном тракте относят к таким же характерным признакам наступления климактерия, как приливы жара [9].
В зарубежных источниках с 1990-х гг. был принят термин «вульвовагинальная атрофия» [10]. Однако, принимая во внимание единый источник происхождения (урогенитальный синус) и общий патогенез развития вагинальной и уретральной атрофии у женщин на фоне дефицита эстрогенов в постменопаузе, эксперты ведущих международных сообществ по менопаузе (Международное общество по изучению женского сексуального здоровья [International Society for the Study of Women’s Sexual Health] и Североамериканское сообщество по менопаузе [North American Menopause Society]) в 2013 г. предложили использовать в клинической практике новый термин «genitourinary syndrome of menopause» («генитоуринарный синдром в менопаузе») вместо общепринятого термина «вульвовагинальная атрофия» [11].
Генитоуринарный менопаузальный синдром (ГУМС) встречается у 30% женщин в возрасте до 55 лет, у 40–57% – в постменопаузе, достигая 75% у женщин в возрасте 70 лет [12–16].
Неоднородны и проявления синдрома: сухость влагалища беспокоит до 55% женщин, на жжение и зуд предъявляют жалобы 18% женщин, диспареунию отмечают 41% пациенток, у 6–8% женщин выявляют повышенную восприимчивость к инфекционным заболеваниям органов малого таза [17, 18].
В возрасте 50–79 лет у 41% пациенток наблюдают минимум одно из вышеуказанных проявлений, а через 4 года после наступления постменопаузы – более чем у 60% [19, 20].
Вагинальный эпителий, так же как и уротелий, подвергается изменениям, связанным с возрастом и дефицитом половых гормонов [17]. Слизистая оболочка влагалища истончается, пролиферативные процессы во влагалищном эпителии прекращаются, влагалищный рН повышается, происходят гибель лактобактерий и колонизация влагалища условно-патогенными бактериями [18]. При этом необходимо помнить, что при старении уровень прогестерона снижается существенно быстрее, чем таковой эстрогенов. В условиях дефицита прогестерона дифференциация эпителия и его секреторная функция неполноценны. Незрелые эпителиальные клетки не обеспечивают синтеза гликогена, достаточного для жизни лактобактерий [21]. Все это способствует развитию и персистенции инфекционного процесса, объясняет большую распространенность рецидивирующих инфекций мочевых путей у женщин с урогенитальной атрофией в пери- и постменопаузах [7, 8].
Помимо нарушения пролиферации эпителия влагалища и мочеиспускательного канала важными звеньями патогенеза урогенитальных расстройств служат нарушение кровоснабжения стенки мочевого пузыря, мочеиспускательного канала, стенки влагалища и развитие ишемии детрузора, а также изменение синтеза и обмена коллагена в связочном аппарате малого таза, потеря эластичности и как следствие – опущение стенок влагалища, нарушение подвижности и анатомического положения мочеиспускательного канала [22–26].
Сочетание указанных изменений приводит к развитию симптомов вагинальной и цистоуретральной атрофии и может служить одним из важных факторов в патогенезе ИНМП у женщин в пери- и постменопаузальном периодах [10].
С учетом всего вышесказанного целесообразно применение комплексного подхода к терапии женщин с проявлениями ГУМС и рецидивирующей на этом фоне ИНМП.
На сегодняшний день использование локальной (интравагинальной) гормональной терапии является основным методом лечения ГУМС [7–10]. Тем не менее в настоящее время применяются различные варианты комплексной терапии, в том числе включающие сочетание эстрогенов с лактобактериями, а также с прогестероном [8].
Целью исследования было сравнить эффективность различных видов комплексной терапии женщин с рецидивирующей ИНМП на фоне постменопаузального атрофического вульвовагинита.
Материалы и методы. Нами проведено обследование и лечение 60 женщин в возрасте от 45 до 65 лет в пери- и постменопаузальном периодах с диагнозом «постменопаузальный атрофический вагинит (ГУМС). ХРБЦ в стадии обострения», установленным на основании анамнеза (отсутствие менструаций в течение 12 мес. после последней менструации, 3 эпизода ИНМП за 12 мес. или 2 эпизода за последние 6 мес.), данных гинекологического осмотра, бактериоскопического и бактериологического исследований мочи и влагалищного содержимого, а также определения pH влагалищной среды.
Критериями исключения служили противопоказания к применению эстрогенов (наличие эстрогензависимых новообразований любой локализации и тромбоэмболических нарушений), наличие выраженной сопутствующей соматической патологии, в том числе тяжелых сердечно-сосудистых и онкологических заболеваний, сахарного диабета, отягощенного аллергологического анамнеза, инфекций, передаваемых половым путем, гематурии, а также неврологических состояний, связанных с повреждением спинного мозга либо диабетической нейропатией, релаксацией и с выраженным опущением тазовых органов.
Методом случайной выборки пациентки были разделены на 2 группы по 30 человек.
В 1-ю группу вошли пациентки, получавшие комплексное лечение препаратом фурамаг 50 мг 3 раза в день в течение 7 дней в сочетании с местной терапией монопрепаратами эстрогенов (эстриол) в дозе 0,5 мг в сутки интравагинально на протяжении 1 мес., затем по 1 свече 2 раза в неделю, согласно инструкции по применению препарата. Курс терапии составил 3 мес.
Во 2-й группе пациентки получали аналогичную антибактериальную терапию, но в сочетании с комплексным препаратом Триожиналь®, содержащим микронизированный эстриол, 0,2 мг/капс., микронизированный прогестерон – 2,0 мг/капс., лиофилизированную культуру лактобактерий L. casei rhamnosus Doderleini не менее 2×107 КОЕ/капс. интравагинально по 2 капсулы 1 раз в сутки в течение 20 дней, затем проводилась поддерживающая терапия по 1 капсуле в сутки; дозу препарата корригировали в зависимости от достигнутого эффекта. Курс терапии также составил 3 мес.
Контроль эффективности проводили на 1-е и 7-е сутки терапии, а также через3 мес. после начала лечения.
Обследование женщин включило сбор анамнеза заболевания и жизни, физикальное обследование, бимануальное влагалищное исследование и кольпоскопию. Кроме того, женщины ежедневно заполняли дневники мочеиспускания, на основании которых оценивали выраженность дизурии. Анализ психоэмоционального состояния проводили по результатам заполнения шкал Гамильтона. Также проводилась регистрация хронограмм пациенток и оценка их хронобиологического статуса ежедневно в течение 7 дней и на последующем визите через 3 мес. после начала терапии.
Лабораторный мониторинг включал анализ крови с определением уровня С-реактивного белка (СРБ); общий анализ мочи, определение рН влагалищного содержимого, бактериологическое исследование проб мочи и мазка из влагалища с посевом урокультуры на твердые питательные среды, установлением вида возбудителей, чувствительности к антибиотикам и степени бактериурии.
Статистическую обработку результатов проводили с помощью программы MS Exel 11.0 из стандартного пакета MS Office 2013, а также программного обеспечения IBM SPSS Statistics 21.0. При проверке статистических гипотез применяли методы параметрической (t-test Cтьюдента) статистики. Для оценки статистической значимости выявленных различий между средними значениями выборок рассчитывали параметр р, вероятность справедливости нулевой гипотезы была принята равной 5% (р<0,05).
Результаты. На момент поступления все женщины предъявляли жалобы на сухость и жжение во влагалище, диспареунию. Кроме того, у пациенток обеих групп имелись признаки обострения хронического цистита, такие как частое болезненное мочеиспускание с императивными позывами, ноктурия, а также повышение уровня СРБ в крови, лейкоцитурия и бактериурия.
При анализе хронограмм в 1-е сутки у всех пациенток был выявлен десинхроноз. Оценка по шкалам Гамильтона в обеих группах в 100% случаев свидетельствовала о нарушении психоэмоционального состояния.
В ходе бимануального влагалищного исследования и кольпоскопии исходно у всех женщин обнаружена атрофия слизистой влагалища. pН влагалищного содержимого в среднем составил 5,9±0,7 и 5,8±0,6 в 1-й и 2-й группах соответственно. Согласно результатам бактериологического исследования влагалищного отделяемого, у всех пациенток имело место нарушение нормального биоценоза влагалища.
В 1-е сутки в бактериальном посеве мочи у пациенток 1-й группы E. coli выявлялена в 17 (56,7%) случаях, St. saprophiticus – в 6 (20%), Еnterococcus spp. – в 5 (15%) и Enterococcus faecalis – в 3 (10%) случаях. В данной группе микроорганизмы были чувствительными к нитрофуранам. Во 2-й группе E. coli была высеяна у 18 (60%) пациенток, St. saprophiticus – у 7 (23,4%), Еnterococcus spp. – у 4 (13,3%), Enterococcus faecalis – у 2 (6,7%). В этой группе микроорганизмы также были чувствительными к нитрофуранам.
К 7-м суткам терапии в 1-й группе у 14 (46,7%) пациенток была отмечена нормализация хроноритмов, во 2-й – в 15 (50%). По данным шкал Гамильтона, нарушения психоэмоционального состояния в 1-й и 2-й группах выявлены у 13 (43,3%) и 11 (36,7%) женщин соответственно (р>0,05).
Результаты клинико-лабораторных исследований представлены в таблице. Согласно полученным данным, к 7-м суткам терапии в обеих группах отмечена нормализация изучаемых клинико-лабораторных показателей. Достоверных различий между группами выявлено не было.
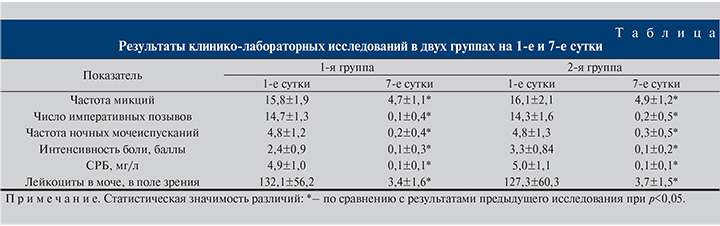
Жалобы на сухость и жжение во влагалище, диспареунию в 1-й группе сохранялись у 5 (16,7%) пациенток, тогда как во 2-й группе данные симптомы имели место лишь у 1 (3,3%) женщины (р<0,05). pН влагалищного отделяемого во 2-й группе составил в среднем 3,8±0,6, что было достоверно (р<0,05) ниже, чем в 1-й группе, – 4,9±0,7. Восстановление нормальной микрофлоры влагалища отмечено у 24 (80%) и у 29 (96,7%) пациенток 1-й и 2-й групп соответственно (р<0,05).
К 7-м суткам эрадикации возбудителя в моче удалось добиться в 100% наблюдений в обеих группах.
При анализе хроноритмограмм через 3 мес. от начала терапии десинхроноз был выявлен у 7 (23,3%) пациенток 1-й группы и у 2 (6,7%) – 2-й (р<0,05). Нарушения психоэмоционального состояния имели место у 2 (6,7%) и у 1 (3,3%) женщины 1-й и 2-й групп соответственно.
Жалобы на сухость и жжение во влагалище, диспареунию, а также атрофия слизистой влагалища при гинекологическом осмотре через 3 мес. от начала терапии сохранялись у 2 (6,7%) пациенток 1-й группы. Во 2-й группе пациентки жалобы не предъявляли, различия между группами были статистически значимыми (р<0,05). pН влагалищного отделяемого составил в среднем 4,2±0,3 в 1-й группе и 3,9±0,6 – во 2-й (p>0,05). У всех пациенток констатировали восстановление нормальной микрофлоры влагалища.
По прошествии 3 мес. в 1-й группе у 6 (20%) пациенток выявлена бактериурия, у 7 (23,3%) – лейкоцитурия. Во 2-й группе бактериурия отсутствовала, лейкоцитурия отмечена у 1 (3,3%) женщины. Различия между группами, по данным показателям, были статистически значимыми (р<0,05).
Среднее количество рецидивов цистита за 3 мес. в 1-й группе составило 0,5±0,4, тогда как во 2-й – 0,1±0,3 (р<0,05).
Обсуждение. На фоне снижения уровня половых стероидов в пери- и постменопаузальном периодах в организме женщины происходят существенные изменения. Урогенитальная атрофия, или ГУМС, – второй по частоте «маркер» наступления климактерия и показание к назначению гормонотерапии [10].
Большинство структур мочеполового тракта гормонозависимо, поэтому снижение содержания половых стероидов в слизистой оболочке влагалища, мочевыводящих путей, соединительной ткани и мышцах малого таза приводит к ишемии и атрофическим изменениям [8, 12].
При этом эстрогены влияют на кровоснабжение эпителия влагалища, способствуют росту и созреванию вагинального эпителия, а также синтезу и накоплению в нем гликогена, но процесс дифференцировки эпителия влагалища и высвобождения из него гликогена требует обязательного участия прогестерона, способствующего формированию промежуточных слоев вагинального эпителия и его естественной десквамации. Нарушения, вызванные дефицитом половых гормонов, обусловливают снижение выработки гликогена, повышению рН и нарушение нормального биоценоза влагалища, что создает благоприятные условия для восходящего инфицирования нижних мочевыводящих путей [8, 13].
Таким образом, выбор лечебной тактики у женщин в пери- и постменопаузах с рецидивирующей ИНМП на фоне ГУМС должен быть основан не только на необходимости воздействия на инфекционный агент, но и на важности коррекции гормональных нарушений.
Эффективность местной терапии эстрогенами доказана, однако с учетом механизмов развития заболевания у данной категории больных применение эстрогенпрогестероновой гормональной терапии в сочетании с лактобактериями патогенетически обосновано.
Заключение. Комплексная терапия женщин с постменопаузальным атрофическим вульвовагинитом (ГУМС) и протекающим на этом фоне ХРБЦ в стадии обострения, включающая антибактериальную терапию в сочетании с препаратом Триожиналь®, позволяет не только устранить симптомы атрофии влагалища, но и более эффективно купировать дизурические нарушения и десинхроноз, нормализовать лабораторные показатели, а также уменьшить количество рецидивов ХРБЦ у женщин в пери- и постменопаузах.



