Введение. Доброкачественная гиперплазия предстательной железы (ДГПЖ) является одним из наиболее частых заболеваний у мужчин старшего возраста и характеризуется разрастанием железистой ткани предстательной железы, приводящим к обструкции нижних мочевыводящих путей [1]. Основные клинические проявления ДГПЖ объединяются под общим названием «симптомы нижних мочевыводящих путей» (СНМП). Медико-социальная значимость проблемы ДГПЖ обусловлена высокой распространенностью этого заболевания, негативным влиянием на качество жизни пациентов, а также риском развития ряда серьезных осложнений – острой задержки мочи, острой почечной недостаточности, гематурии и тампонады мочевого пузыря [1].
Распространенность ДГПЖ увеличивается с возрастом. В нескольких популяционных исследованиях показано, что более старший возраст является фактором риска развития и прогрессирования ДГПЖ [2]. Вместе с тем есть понимание того, что в старшей возрастной группе растет количество сопутствующих заболеваний у одного пациента, патогенетически и генетически связанных между собой [3].
Так, например, эксперты Международного общества по изучению вопросов старения мужчин (The International Society for the Study of the Aging Male – ISSAM) еще в 2004 г. подчеркивали, что приоритетными для мужчин старше 50 лет являются кардиоваскулярные заболевания, ДГПЖ, эректильная дисфункция (ЭД) и депрессия [4].
В связи с этим коморбидные пациенты с СНМП/ДГПЖ требуют более взвешенного, продуманного, часто мультидисциплинарного подхода, интегральной оценки риска и прогноза заболеваний, а также тщательного выбора тактики лечения.
Основные задачи лечения пациентов с СНМП/ДГПЖ: уменьшение выраженности симптомов, улучшение качества жизни пациентов, предотвращение прогрессирования заболевания и развития осложнений [5].
В настоящее время в качестве препарата первой линии лечения пациентов с умеренными или тяжелыми проявлениями СНМП используются α1-адреноблокаторы [6]. Назначение этих препаратов позволяет эффективно уменьшать выраженность клинических проявлений и улучшать качество жизни пациентов [7, 8]. Несмотря на значительные достижения в области фармакотерапии СНМП/ДГПЖ, до настоящего времени весьма значительной остается доля пациентов с этим заболеванием, которым требуется проведение оперативного лечения. По данным различных исследований, оперативное лечение проводится при ДГПЖ в 42,8% случаев [9, 10].
Цель данного исследования: анализ эффективности применения α1-адреноблокатора силодозин в дозе 8 мг в сутки у коморбидных пациентов с СНМП/ДГПЖ.
Материалы и методы. На кафедре урологии СамГМУ на базе Центра инновационной урологии и хирургии МК «Моя Наука» частного учреждения образовательной организации высшего образования «Медицинский университет “Реавиз”» в сотрудничестве с кафедрой внутренних болезней СамГМУ на базе Дорожной клинической больницы в первом полугодии 2022 г. наблюдались 197 коморбидных пациентов с СНМП/ДГПЖ.
Всем пациентам было проведено общее клиническое обследование. Урологическое обследование включило исследование простатспецифического антигена (ПСА), оценку тяжести СНМП по шкале IPSS, ректально-пальцевое исследование простаты, трансректальное ультразвуковое сканирование, ультразвуковое исследование (УЗИ) мочевого пузыря с определением остаточной мочи, урофлоуметрию.
Все пациенты, вошедшие в исследование, подписали информированное согласие.
Критерием включения в исследование было наличие верифицированных сопутствовавших заболеваний у пациентов, имевших противопоказания к хирургическому лечению доброкачественной гиперплазии предстательной железы (табл. 1). Для оценки соматического состояния больных использовался индекс коморбидности Charlson. Медиана значений индекса кормобидности Charlson составила 6,8±1,2.
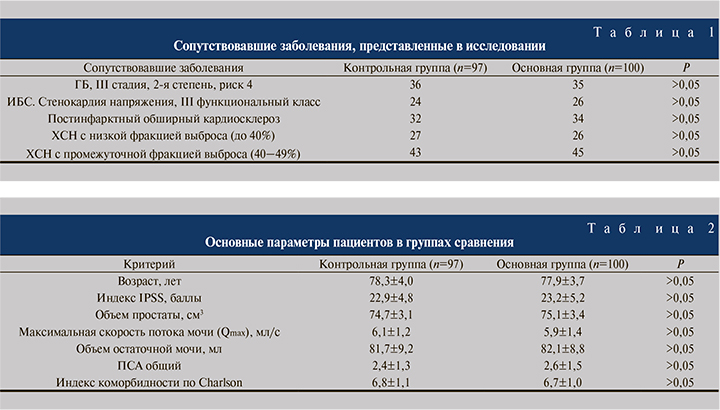
Все участники были распределены в 2 группы: 100 пациентам был назначен силодозин в дозе 8 мг по 1 капсуле х1 раз в день (основная группа), 97 пациентов, отказавшихся от медикаментозной терапии, были включены в группу сравнения (контрольная группа). Статистически значимые различия по исходным параметрам между группами не определялись (табл. 2).
Для оценки эффективности проводимой терапии пациенты повторно обследовались через 1 мес., через 3 и через 6 мес. от начала приема силодозина 8 мг. Оценивали степень тяжести СНМП по шкале IPSS, качество жизни, скорость мочеиспускания, объем простаты, уровень ПСА, объем остаточной мочи, возникновение осложнений (острая задержка мочи [ОЗМ], камни мочевого пузыря, хирургическое лечение в объеме цистостомии).
Кроме того, была проанализирована субъективная оценка пациентами эффективности лечения на основании визуально-аналоговой шкалы оценки лечения (TS-VAS), которая представляет собой 100-балльную шкалу удовлетворенности лечением, в которой 0 баллов соответствовует оценке «совсем нет», 100 баллов – оценке «да, полностью» [11]. Исход лечения коморбидного пациента с СНМП/ ДГПЖ оценивался в соответствии со степенью проявления: 1 – улучшение, 2 – без изменений, 3 – ухудшение, но без развития осложнений и необходимости проведения дренирующих операций, 4 – развитие нежелательных явлений (ОЗМ, камни мочевого пузыря), 5 – развитие осложнений, потребовавших выполнения цистостомии.
Результаты исследования представлены в виде средних значений ±стандартное отклонение. Оценка влияния силодозина 8 мг на исход заболевания определена с использованием метода дисперсионного анализа.
Результаты. Среднее значение степени тяжести СНМП по шкале IPSS до лечения составляло 22,9±4,8 балла в контрольной группе и 23,2±5,2 балла в основной соответственно. Динамика изменения индекса IPSS представлена в табл. 3.

До лечения у пациентов обеих групп наблюдались СНМП тяжелой степени. В результате лечения силодозином 8 мг коморбидных пациентов основной группы наблюдалось значительное улучшение симптоматики по шкале IPSS. Изменения наблюдались уже через 1 мес. после начала терапии. В табл. 3 представлены статистически значимые различия между исследуемыми группами. Отмечено, что у пациентов, которые принимали силодозин 8 мг, наблюдалось выраженное снижение баллов по шкале IPSS по сравнению с контрольной группой, где оценка по шкале IPSS увеличилась на 0,9 балла, а разница через 6 мес. в группах составила 10,9 балла (р<0,05).
Также отмечено более выраженное уменьшение объема остаточной мочи в группе силодозина 8 мг при статистически значимом различии между группами сравнения, причем изменения наблюдались уже через месяц приема препарата. Выявленная динамика сохранялась через 3 и 6 мес. терапии (табл. 4).
Объем остаточной мочи у пациентов основной группы через 1 мес. после начала терапии силодозином уменьшился на 21,6±3,3 мл и составил 61,5±7,6 мл. Как можно видеть в табл. 4, изменение объема остаточной мочи в группе силодозина было статистически достоверным на протяжении всех визитов исследования и через 6 мес. разница между группами составила 35,8 мл (р<0,05).
Аналогичная динамика прослеживается и при определении максимальной скорости потока мочи (Qmax) по данным урофлоуметрии (табл. 5).
По данным, представленным в табл. 5, видно, что пациенты, которые принимали силодозин 8 мг, имели более значимое по сравнению с контрольной группой улучшение максимальной скорости потока мочи, по данным урофлоуметрии, через 1, 3 и 6 мес. с достоверными различиями между группами 1,8–2,5–4 балла (р<0,05).
Достоверных изменений объема предстательной железы и уровня ПСА в основной и контрольной группах за время наблюдения выявлено не было. Динамики индекса коморбидности Charlson в исследуемых группах также не отмечено.
В табл. 6 приведены данные по возникшим нежелательным явлениям в контрольной и основной группах.
Как видно из табл. 6, достоверных различий между группами по количеству нежелательных явлений со стороны сердечно-сосудистой системы не выявлено.
Кроме того, была проанализирована субъективная оценка пациентами эффективности лечения на основании визуально-аналоговой шкалы оценки лечения TS-VAS (табл. 7). Удовлетворенность лечением была очень хорошей или хорошей у большинства пациентов основной группы. Отказов от лечения вследствие нежелательных явлений при применении силодозина 8 мг зафиксировано не было.

Выводы
1. Силодозин в дозе 8 мг высокоэффективен в лечении коморбидных пациентов с выраженными СНМП /ДГПЖ; терапия силодозином достоверно уменьшает симптоматику по шкале IPSS, количество остаточной мочи и повышает скорость мочеиспускания по данным урофлоуметрии.
2. Не отмечено отрицательного влияния силодозина в дозе 8 мг в сутки на развитие нежелательных явлений со стороны сердечно-сосудистой системы у коморбидных пациентов с СНМП/ДГПЖ.



