Введение. С момента первого клинического применения и по сегодняшний день уретральный катетер является самым востребованным медицинским изделием в стационаре. Будь то кратковременная катетеризация или длительное дренирование мочевого пузыря, уретральный катетер является неотъемлемой составляющей лечебного процесса практически при всех нозологиях. Вместе с тем его применение может вызывать бактериальную колонизацию органов мочевыделительной системы, приводить к образованию камней и вторичной бактериемии [1]. Внедрение уретральных катетеров, импрегнированных антибактериальными препаратами или серебром, в значительной степени способствовало снижению частоты катетер-ассоциированной инфекции; однако ее частота по-прежнему остается высокой. По мнению X. Bonfill et al. [2] встречаемость бактериурии, связанной с постоянными катетерами, может достигать 8% в день.
Более 30% случаев нозокомиальной инфекции обусловлено наличием постоянного уретрального катетера [3, 4]. Было показано [5], что более 70% нозокомиальных инфекций связано с уретральным катетером. В середине 1980-х гг. рядом авторов было высказано предположение, согласно которому длительное дренирование мочевого пузыря, а также хроническое воспаление уретры на фоне интермиттирующей катетеризации могут увеличивать риск развития рака мочевого пузыря и первичного рака уретры у мужчин [6, 7].
Постоянный уретральный катетер с открытой дренажной системой уже в течение первых 3–4 дней практически в 100% случаев обусловливает развитие бактериурии. Использование закрытой дренажной системы позволяет замедлять, но не предотвращать развитие бактериурии. Считается, что из общего числа катетер-ассоциированных инфекций мочевыводящих путей (КАИМП) около 2/3 случаев бактериурии возникает в результате миграции бактерий в мочевой пузырь через пространство между катетером и стенкой уретры (экстралюминально), что приводит к развитию бактериурии практически у всех пациентов в течение первых 4 нед. В остальных случаях развитие бактериурии происходит интралюминально путем миграции бактерий вдоль внутреннего просвета катетера [8]. Массовое внедрение в клиническую практику уретральных катетеров, покрытых антисептическими или антимикробными препаратами, побудило ряд клиницистов провести исследования по оценке сравнительной эффективности клинически доступных катетеров. Полученные в ходе работы результаты оказались противоречивыми. Самыми масштабными из существующих на сегодняшний день следует считать опубликованные в 2012 г. R. Pickard et al. [9, 10] результаты многоцентрового рандомизированного контролируемого исследования (the CATHETER trial), в котором описывается частота развития КАИМП у пациентов при использовании разных типов уретрального катетера с антимикробным покрытием. В ходе проведенного анализа авторами сделан вывод, согласно которому использование катетеров с серебряным покрытием не приводит к уменьшению числа случаев симптоматической КАИМП.
Цель исследования: провести сравнительную оценку эффективности различных видов уретральных катетеров, в том числе разработанной новой модели уретрального катетера, в профилактике и снижении риска развития КАИМП у пациентов с длительным дренированием мочевого пузыря.
Материалы и методы. Проспективное исследование было проведено на базе ГКБ им. С. И. Спасокукоцкого ДЗМ г. Москвы. В исследование вошли 69 пациентов (средний возраст – 67,5±2 года, проходивших лечение в урологических, общетерапевтических (включая отделение неврологии) отделениях, а также в отделении интенсивной терапии (включая отделение для больных с нарушением мозгового кровообращения). Критерии исключения: наличие цистостомы; аутокатетеризация либо использование для деривации мочи кондомных систем; прием уросептиков (в том числе растительного происхождения); наличие в течение календарного месяца, предшествовавшего данному исследованию, урогенитальной инфекции или инвазивного вмешательства на органах мочевыделительной системы.
В 32 случаях дренирование мочевого пузыря было обусловлено перенесенным оперативным вмешательством, в 20 – хронической задержкой мочи в связи с гиперплазией предстательной железы, в 17 – с целью контроля за диурезом. У всех пациентов мочевой пузырь был дренирован силиконовым двухходовым катетером Фолея № 16–18 Сh с закрытой дренажной системой. В зависимости от вида использованного уретрального катетера все пациенты были разделены на четыре группы (табл. 1).

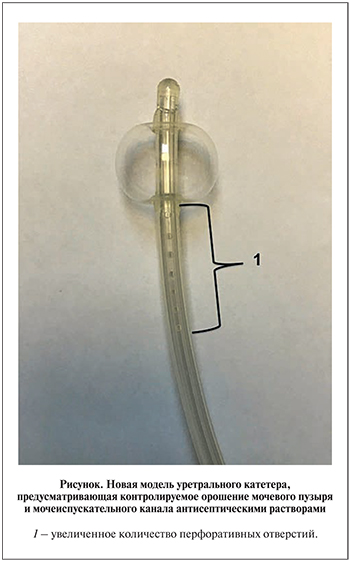 В 1-й группе (n=18) мочевой пузырь был дренирован стандартным уретральным катетером без покрытия, во 2-й (n=16) – уретральным катетером, импрегнированным серебром, в 3-й (n=15) – уретральным катетером, покрытым нитрофураном, в 4-й (n=20) – уретральным катетером с возможностью контролируемого орошения слизистой мочеиспускательного канала антисептическими растворами и отведения экссудата (новая модель уретрального катетера, разработанная совместными усилиями кафедры урологии МГМСУ им. А. И. Евдокимова и НЦАГиП им. акад. В. И. Кулакова; см. рисунок). В качестве антисептического раствора для орошения нами был использован 0,1%-ный водный раствор хлоргексидина биглюконата. Орошение проводили не реже 2 раз в день (в среднем 3 раза) путем одномоментного введения 10–20 мл раствора по специальному «рабочему» каналу уретрального катетера [11]. Бактериологический анализ мочи выполняли всем пациентам до установки уретрального катетера и после его снятия. Исключение составили пациенты, поступившие с острой задержкой мочи, а также пациенты (n=6), у которых после удаления уретрального катетера самостоятельное мочеиспускание не восстановилось. Помимо этого всем пациентам 4-й группы был дополнительно проведен бактериологический анализ полученного в ходе дренирования мочевого пузыря экссудата с последующим выращиванием культур микроорганизмов на питательных средах.
В 1-й группе (n=18) мочевой пузырь был дренирован стандартным уретральным катетером без покрытия, во 2-й (n=16) – уретральным катетером, импрегнированным серебром, в 3-й (n=15) – уретральным катетером, покрытым нитрофураном, в 4-й (n=20) – уретральным катетером с возможностью контролируемого орошения слизистой мочеиспускательного канала антисептическими растворами и отведения экссудата (новая модель уретрального катетера, разработанная совместными усилиями кафедры урологии МГМСУ им. А. И. Евдокимова и НЦАГиП им. акад. В. И. Кулакова; см. рисунок). В качестве антисептического раствора для орошения нами был использован 0,1%-ный водный раствор хлоргексидина биглюконата. Орошение проводили не реже 2 раз в день (в среднем 3 раза) путем одномоментного введения 10–20 мл раствора по специальному «рабочему» каналу уретрального катетера [11]. Бактериологический анализ мочи выполняли всем пациентам до установки уретрального катетера и после его снятия. Исключение составили пациенты, поступившие с острой задержкой мочи, а также пациенты (n=6), у которых после удаления уретрального катетера самостоятельное мочеиспускание не восстановилось. Помимо этого всем пациентам 4-й группы был дополнительно проведен бактериологический анализ полученного в ходе дренирования мочевого пузыря экссудата с последующим выращиванием культур микроорганизмов на питательных средах.
Образцы мочи, полученные до и после дренирования мочевого пузыря уретральным катетером, а также экссудат в течение 2 ч доставляли в лабораторию. Для выделения бактерий из мочи, полученной до установки уретрального катетера, для всех групп пациентов были применены универсальные питательные среды (среда CLED), после удаления катетера, а также для выделения бактерий из экссудата – селективная питательная среда МакКонки. И в том, и в другом случае выбор сред был ориентирован на поддержание роста как грамположительных, так и грамотрицательных бактерий. Учитывая гипотетическую колонизацию мочи в ходе дренирования мочевого пузыря уретральным катетером, выбор питательной среды МакКонки был обусловлен возможностью проводить первичную дифференциацию выросших культур по способности ферментировать лактозу. Титр бактерий в моче определяли полуколичественным штриховым методом с помощью тест-системы типа «ДипСтрик». Полученные инокулированные чашки Петри и тест-системы типа «ДипСтрик» в последующем инкубировали в условиях обычной атмосферы при 37°С в течение 22 ч.
После инкубации проводили учет результатов с определением морфологических типов выделенных культур и их концентрации. Диагностически значимым титром патогенных бактерий в 1 мкл исследованной мочи считали титр ≥103 КОЕ/мл (для первичных патогенов I группы – E. coli и S. saprophyticus), 103 и 104 КОЕ/мл (для вторичных патогенов группы II – P. mirabilis), группа KES (бактерии родов Klebsiella spp., Enterobacter spp. и Serratia spp.), P. aeruginosa, P. vulgaris, S. Pneumoniae и др.) при изоляции их от мужчин и женщин в монокультуре соответcтвенно [9]. После идентификации патогенных бактерий определяли чувствительность микроорганизмов к антибактериальным препаратам путем засеивания выделенных культур на агар Мюллера–Хинтона (толщина агара – 4±0,5 мм). После инокуляции и нанесения дисков с антибиотиками чашки Петри помещали в термостат при температуре 35±1°С на 16–20 ч. Зоны подавления роста измеряли оптическим способом по внутреннему диаметру роста единичных колоний.
Для расчетов описательной статистики использовали программу Microsoft Exсel 2010, с помощью которой проведены объективное сравнение полученных результатов и комплексная оценка достоверности различий данных. Оценка степени формирования биопленки на наружной и внутренней поверхностях уретрального катетера в данном исследовании не проводилась.
Результаты. Бактериологический анализ мочи, полученной до установки уретрального катетера, показал отсутствие клинически значимых титров патогенных бактерий, что объясняется селекцией пациентов на этапе включения в исследование. В группе больных с хронической задержкой мочи (n=10), а также больных, у которых установка уретрального катетера преследовала цель контроля диуреза (n=10), был выявлен рост E. coli и Enterobacter spp. в титре 102 КОЕ/мл соответственно.
Средний срок нахождения уретрального катетера во всех группах составлял 15 и более дней. После удаления уретрального катетера у 61 пациента восстановлено самостоятельное мочеиспускание, у 6 пациентов из группы больных с хронической задержкой мочи самостоятельное мочеиспускание не восстановилось, в связи с чем была выполнена троакарная цистостомия, а спустя некоторое время – трансуретральная резекция предстательной железы.
Длительное нахождение уретрального катетера (≥15 дней) было связано с увеличением скорости развития симптоматической КАИМП. Лихорадка >38°С, боль и дизурические явления после удаления уретрального катетера имели место у 7 (37%) больных 1-й группы, у 2 больных 2-й и 3-й групп (по 18% соответственно) и у 1 (5%) пациента 4-й группы (р=0,83 и р=0,19 для 1-й и 2–4-й групп соответственно).
Микробиологический анализ мочи в 1-й группе больных показал наличие бактерий из группы первичных и вторичных патогенов в титре 104 и 103 КОЕ/мл для E. coli и Enterobacter spp. соответственно (для мужчин) и наличие бактерий из группы первичных патогенов в титре 103 и 104 КОЕ/мл для E. coli и S. saprophyticus соответственно (для женщин). Во 2–4-й группах была отмечена более низкая скорость бактериурии (концентрация выделенных патогенных бактерий не превышала диагностически значимый титр, р=0,001). Подробная информация о наиболее значимых бактериях, выделенных из мочи и экссудата, представлена в табл. 2.
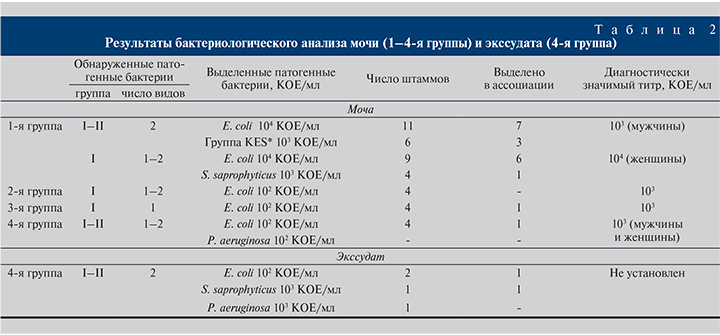
Микробиологический анализ позволил выделить 42 штамма микроорганизмов, из которых 32 штамма E. coli, 6 штаммов Enterobacter spp. и 4 штамма S. saprophyticus. Из общего числа нозокомиальных штаммов E. coli в ассоциацию было выделено более половины (59%), в то время как во 2–4-й группах из общего числа штаммов выделено лишь 2 ассоциации. При бактериологическом исследовании полученного экссудата в ассоциацию было выделено 2 штамма группы первичных патогенов.
У десяти пациентов развитие симптоматической КАИМП потребовало проведения системной антибактериальной терапии в срок до 7 дней, учитывая спектр чувствительности в зависимости от значений минимально подавляющей концентрации (МПК) и диаметра зон подавления роста. Для наиболее распространенного патогенного штамма E. coli нами был взят диаметр зоны подавления ≥30 мм (табл. 3).

Обсуждение. Анализ литературы показывает, что спектр возбудителей, приводящих к развитию КАИМП при длительном дренировании мочевого пузыря, широко варьируется в различных стационарах, однако наиболее распространенными на протяжении последних лет являются микроорганизмы кишечной группы (E. coli и другие представители семейства Enterobacteriaceae). Данный факт подтверждается более высокой частотой инфекций мочевыводящих путей (ИМП) у женщин по сравнению с мужчинами и повышенным риском развития ИМП после катетеризации или инструментальных вмешательств на мочевом пузыре [12]. Наиболее частыми осложнениями, связанными с длительной катетеризацией, являются симптоматическая или бессимптомная бактериурия и уретрит. По мнению B. S. Niël-Weise et al. [13], длительное нахождение уретрального катетера связано с увеличением скорости развития симптоматической КАИМП. Согласно данным S. A. Rani et al. [14], длительное нахождение уретрального катетера также сопряжено с инкрустацией последнего солями за счет образования кристаллической биопленки. Данное обстоятельство в свою очередь может приводить к КАИМП за счет возрастающего числа уреазопродуцирующих микроорганизмов, среди которых можно выделить Proteus, Providencia, Morganella spp. и Corynebacterium urealyticum. На их долю может приходиться до 82 % случаев ИМП.
Существующий риск формирования антибиотикорезистентных штаммов ограничивает назначение рутинной антибактериальной терапии в лечении бессимптомной бактериурии как при краткосрочной (<30 дней), так и при длительной (>30 дней) катетеризации [15]. В случае симптоматической бактериурии лечение проводится на основании данных культурального исследования мочи и определения чувствительности к антибиотикам. По-прежнему основными факторами, определяющими выбор лечебной тактики при необходимости длительного дренирования мочевого пузыря, являются простота в использовании, удобство применения для пациента и для медицинского персонала, а также экономические затраты, связанные с использованием того или иного уретрального катетера [16]. Cкопление микроорганизмов и их внеклеточных продуктов, формирующих структурное сообщество на уретральном катетере (так называемая биопленка), лежит в основе развития КАИМП [17]. В настоящее время большое внимание уделяется разработке профилактических мер, направленных на предупреждение образования биопленки как на наружной, так и на внутренней поверхности уретрального катетера, а также снижение колонизации и размножения бактерий. Антибактериальная терапия в большинстве случаев снижает колонизацию бактерий, однако способствует образованию антибиотикорезистентных штаммов. В связи с этим рутинное применение антибиотиков (в случае бессимптомной бактериурии) не рекомендуется [4]. Формирование резистентности к антисептикам, напротив, происходит медленно, поэтому их использование в составе покрытия уретрального катетера либо в комплексной профилактике при механическом орошении слизистой мочеиспускательного канала является обоснованным.
Проведенное сравнительное исследование по оценке эффективности различных видов уретрального катетера в профилактике и снижении риска КАИМП у пациентов с длительным дренированием мочевого пузыря показало сопоставимую эффективность уретральных катетеров, покрытых антисептическими веществами (2-я и 3-я группы) и разработанной новой модели уретрального катетера с возможностью контролируемого орошения слизистой мочеиспускательного канала антисептическими растворами и отведением экссудата (4-я группа). Данный факт имел решающее значение при развитии симптоматической КАИМП, частота которой была выше в основной группе (наличие бактерий при микробиологическом исследовании мочи ≥103 КОЕ/мл) по сравнению с контрольными группами (диагностически значимый титр не превышал 103 КОЕ/мл).
Заключение. В наибольшей степени риску развития катетерассоциированной инфекции подвержены пациенты с длительным дренированием мочевого пузыря на фоне нейрогенной дисфункции, травматической болезни спинного мозга, а также пациенты, которым проводится интермиттирующая катетеризация. В ходе проведенного исследования было показано, что длительное дренирование мочевого пузыря уретральным катетером в срок до 15 дней является закономерным фактором риска контаминации органов мочевыделительной системы, способствующим развитию бактериурии и в конечном счете – КАИМП. Увеличение финансовых затрат на борьбу с возникшими инфекционными осложнениями предопределяет поиск новых альтернативных способов профилактики развития катетерассоциированной инфекции. Проведенное микробиологическое исследование мочи показало, что использование уретральных катетеров с антисептическим или антибактериальным покрытием, а также разработанной новой модели уретрального катетера в должной степени позволяет снижать риск развития симптоматической КАИМП за счет местного бактерицидного эффекта, а также механического удаления бактериальных агентов из экстралюминального пространства.



