Введение. Почечная ангиомиолипома (АМЛ) – редкое новообразование почек, которое, несмотря на доброкачественный характер, вызывает множество противоречий при ее верификации и выборе тактики лечения. В 1911 г. В. Фишер впервые описал гистопатологию данного новообразования, включающую три компонента, которые и дали название этой опухоли: кровеносные сосуды неправильной формы, гладкую мышечную и зрелую жировую ткани [1]. Таким образом, эта опухоль имеет мезенхимальное происхождение. Предполагается, что АМЛ развивается из околососудистых эпителиальных клеток. Тем не менее термин «ангиомиолипома» активно употребляется с середины ХХ в. Данные опухоли могут появляться независимо или вместе с комплексом туберозного склероза (КТС) или (реже) не связанным с ним лимфангиолейомиматозом (ЛАМ).
Диагностика и лечение почечной АМЛ не подвергались обстоятельному изучению более 10 лет. В это время начали активно использовать малоинвазивные подходы к лечению и новейшие виды целевой химиотерапии.
Почечная АМЛ – редко встречающаяся опухоль. В России АМЛ почки составляет около 5% среди всех новообразований на фоне «лидеров»: молочной железы (11,4%) и кожи (12,5%) [2, 3]. Почечная АМЛ у женщин выявляется чаще, чем у мужчин [2, 3]. Средний возраст больных составляет 48 лет [4, 5]. В Японии встречаемость почечных АМЛ составляет 0,13%, среди которых 0,22% – женщины и 0,1% – мужчины (среди 17 941 взрослого). Почечная АМЛ иногда встречается как часть КТС (примерно в 20% наблюдений) или (реже) в сочетании с ЛАМ. Комплекс туберозного склероза – аутосомно-доминантное заболевание, которое у взрослых диагностируют с частотой 1:12000, у новорожденных – 1:6000. При этом КТС чаще встречается в возрасте 20–30 лет, ЛАМ – 40–50 лет [4, 7]. Молекулярный статус КТС хорошо изучен: у двух третей обследованных пациентов выявлена мутация генов TSC1 и TSC2, расположенных в хромосоме 9q34 и 16p13.3 соответственно. Эти гены кодируют белки, известные как гамартин и туберин: они взаимодействуют друг с другом, образуя гетеродимеры, главная роль которых – ингибирование метаболизма mTOR [8, 9].
Почечная АМЛ может быть достоверно верифицирована по результатам компьютерной (КТ) и магнитно-резонансной томографии (МРТ), если речь идет об опухоли менее 4 см. Компьютерная томография обладает исключительной чувствительностью, точностью и надежностью как положительных, так и отрицательных диагностических результатов в отношении АМЛ и почечных новообразований в целом [1, 2].
Размеры, локализация, степень поражения почечной паренхимы, прорастание в крупные магистральные сосуды – основные параметры, определяющие тактику ведения больных почечными АМЛ. Гистологический и иммуногистохимический анализы биопсийного и операционного материала имеют важное диагностическое значение при определении типа и субтипов новообразований почек, а также возможных рисков малигнизации. Морфологическая картина опухоли также определяет выбор хирургического пособия: нефрэктомия или резекция, а также выбор способа вмешательства – открытый, лапароскопический или hand-assistant-лапароскопия.
Цель исследования: выявление патоморфологических и прогностических особенностей АМЛ почки (иммуногистохимическая характеристика).
Материалы и методы. Клинико-морфологическое ретроспективное исследование операционного материала проведено в патологоанатомическом отделении Медицинского радиологического научного центра им. А. Ф. Цыба (г. Обнинск) с октября 2015 по декабрь 2016 г.
Полученные в ходе операций новообразования почек у 42 пациентов, находившихся на стационарном лечении в отделении лучевого и хирургического лечения урологических заболеваний с группой брахиотерапии рака предстательной железы, были изучены с помощью методов световой микроскопии и иммуногистохимии.
Физикальные, клинико-лабораторные и инструментальные данные (анализ историй болезни пациентов). Большинство (n=34) пациентов поступали в ЛПУ экстренно, чаще без симптомов (n=23). Три пациента предъявляли жалобы на тянущие боли в области поясницы, у 12 обнаружили гематурию и у 4 – резкие перепады артериального давления. Семейный и наследственный анамнезы не отягощены.
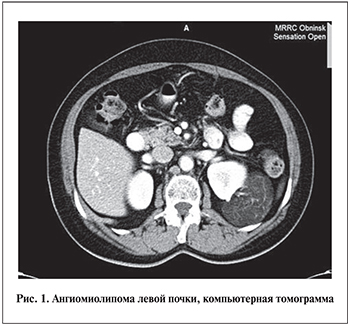 Компьютерная томография. Почки расположены типично. Справа (n=29) и слева (n=13) на границе верхнего и среднего полюсов по наружному краю (n=22) и в нижнем сегменте (n=20) определены объемные образования неправильной формы. Размеры варьировались от 15×20 до 74×91 мм с признаками интра- и экстраренального роста; образования были неоднородной кистозно-солидной структуры, интенсивно накапливающие контраст при внутривенном усилении. Полостная система не расширена. Чашечно-лоханочная система незначительно деформирована. Сосудистые ножки почек структурные. В воротах почек визулизировались отдельно расположенные лимфоузлы до 5 мм в диаметре. Концентрационная функция обеих почек сохранена. Увеличенных лимфоузлов по ходу магистральных сосудов не определялось (рис. 1). Описанная картина совпадала с данными УЗИ.
Компьютерная томография. Почки расположены типично. Справа (n=29) и слева (n=13) на границе верхнего и среднего полюсов по наружному краю (n=22) и в нижнем сегменте (n=20) определены объемные образования неправильной формы. Размеры варьировались от 15×20 до 74×91 мм с признаками интра- и экстраренального роста; образования были неоднородной кистозно-солидной структуры, интенсивно накапливающие контраст при внутривенном усилении. Полостная система не расширена. Чашечно-лоханочная система незначительно деформирована. Сосудистые ножки почек структурные. В воротах почек визулизировались отдельно расположенные лимфоузлы до 5 мм в диаметре. Концентрационная функция обеих почек сохранена. Увеличенных лимфоузлов по ходу магистральных сосудов не определялось (рис. 1). Описанная картина совпадала с данными УЗИ.
Гемограмма и биохимический анализ крови: в пределах возрастной нормы.
Оперативное пособие. Во всех случаях была выполнена частичная нефрэктомия (резекция) под эндотрахеальным наркозом. Опухоли почек были промаркированы и направлены на патологоанатомическое исследование.
Морфологическое исследование. Фрагменты почки с опухолью фиксировали в 10%-ном нейтральном формалине, забуференном по Лили (при рН 7,2–7,4), заливали в парафин по стандартной методике. Парафиновые срезы толщиной ≈5 мкм помещали на обычные, а для иммуногистохимического исследования – на специальные адгезивные предметные стекла, после депарафинизации окрашивали гематоксилином и эозином (H&E) для гистологического исследования.
Иммуногистохимический метод (ИГХ). После депарафинизации и регидратации парафиновых срезов проводили ИГХ-исследование по стандартному протоколу в автоматическом режиме в иммуногистостейнере Bond-Max («Leica», Германия).
Первичные антитела (в готовом к использованию разведении), классы Ig и фирма-производитель приведены в табл. 1. Вторичные антитела – универсальные (HiDef Detectionтм HRP Polymer system; «Cell Marque», США), позволяющие выявлять мышиные и кроличьи первичные антитела, конъюгированные с ферментным комплексом на основе пероксидазы хрена. Для каждого маркера выполнялись контрольные исследования с целью исключения псевдопозитивных и псевдонегативных результатов. Ядра клеток докрашивали гематоксилином Mayer; срезы промывали под проточной водой; дегидратировали и заключали в гель «Aquatex»® (aqueous mounting agent; «Andwin Science», Франция) под покровные стекла.

Визуализацию биопсийного материала выполняли на светооптическом микроскопе Carl Zeiss Lab.A1 («Carl Zeiss», Германия), совмещенном с видеокамерой AxioCam ERc5s («Carl Zeiss Microscopy GmbH», Германия) и программным обеспечением ZEN Lite.
Согласно рекомендациям (Dabbs D.J. Diagnostic immunohistochemistry. 4th ed., 2014), проводили подсчет количества иммунопозитивных клеток (в %) в зависимости от числа случаев (пациентов) (ve +/–): «–» – отсутствие, «+» – слабая (1–10% клеток), «++» – умеренная (11–50% клеток), «+++» – выраженная (≥51% клеток).
Статистический анализ. Полученные в результате подсчета данные обрабатывали с использованием компьютерной программы SPSS 7,5 for Windows statistical software package (IBM Analytics, США). Так рассчитывали средние арифметические величины с ее предельными отклонениями и среднеквадратичную ошибку. Соответствие данных нормальному распределению подтвердили с применением критерия Колмогорова–Смирнова. При статистической обработке для оценки достоверности различий средних значений между группами использовались следующие непараметрические критерии: U-критерий Манна–Уитни, Н-критерий Краскела–Уоллеса. В отсутствие нормального распределения данных использовали непараметрический критерий F. Wilcoxon (Statistical methods for research workers) с уровнем значимости p<0,05.
Результаты и их обсуждение. Мы наблюдали 15 (35,1%) мужчин и 27 (64,9%) женщин в возрасте от 32 до 75 лет (средний возраст – 50±13 лет). Поражение левой почки обнаружили у 13 (30,9%) больных, правой – у 29 (69,1%). Солитарные опухолевые узлы были выявлены у 41 пациента, у 1 из больных наблюдали 3 опухолевых узла. Среди 42 частичных нефрэктомий (резекций) 38 (90,48%) выполнены лапароскопическим доступом, 3 (7,14%) – открытым, 1 (2,38%) – hand-assistant. Продолжительность операций составила в среднем 183±55 мин, объем кровопотери – 100±20 мл. Выбор хирургического пособия, течение операции и постоперационное наблюдение наших пациентов сопоставлены с данными специализированной литературы [6] и приведены в табл. 2.

Макроскопическая картина. Размеры опухолей варьировалиcь от 2 (n=27) и 4 (n=11) до 8 см (n=4) в диаметре. Новообразования были темно-бордового цвета, снаружи покрыты тонкой полупрозрачной капсулой толщиной до 0,1 см. В некоторых участках отмечены разрывы капсулы с зонами кровоизлияния, начинающиеся от капсулы и уходящие вглубь до средостения опухоли.
Микроскопическая картина. Многокомпонентная опухоль состояла из множества кровеносных сосудов, гладкой мышечной и жировой тканей. Местами определялись небольшие участки склероза. Опухоль была образована кровеносными сосудами двух типов: 1) толстостенными (псевдоартерии), не содержащими эластических волокон, с признаками слабовыраженного фиброза или гиалиноза стенки; 2) тонкостенными. Гладкие миоциты с гиперхромными ядрами образовывали вокруг сосудов муфтообразные утолщения. В некоторых участках опухоли среди пучков гладких миоцитов располагалось множество мелких сосудистых щелей, выстланных эндотелием. В ряде случаев (n=12) опухоль по строению напоминала гемангиоперицитому, или ветвистую ангиому. Зрелый тип опухоли отличался наличием компактно расположенных узких веретеновидных гладкомышечных клеток. В незрелой опухоли преобладали мелкие гладкие миоциты, не склонные к формированию пучков. Жировой компонент опухоли был представлен белой жировой тканью, состоящей из зрелых мононуклеарных липоцитов с единичными липобластами (рис. 2).

В единичных (n=2) образцах были обнаружены фокусы с признаками цитологической атипии или дистрофическими изменениями эпителиоцитов. Кроме того, в АМЛ присутствовали (n=4) зоны гиалинизации или кальцификации. Лишь в одном случае жировой компонент отсутствовал.
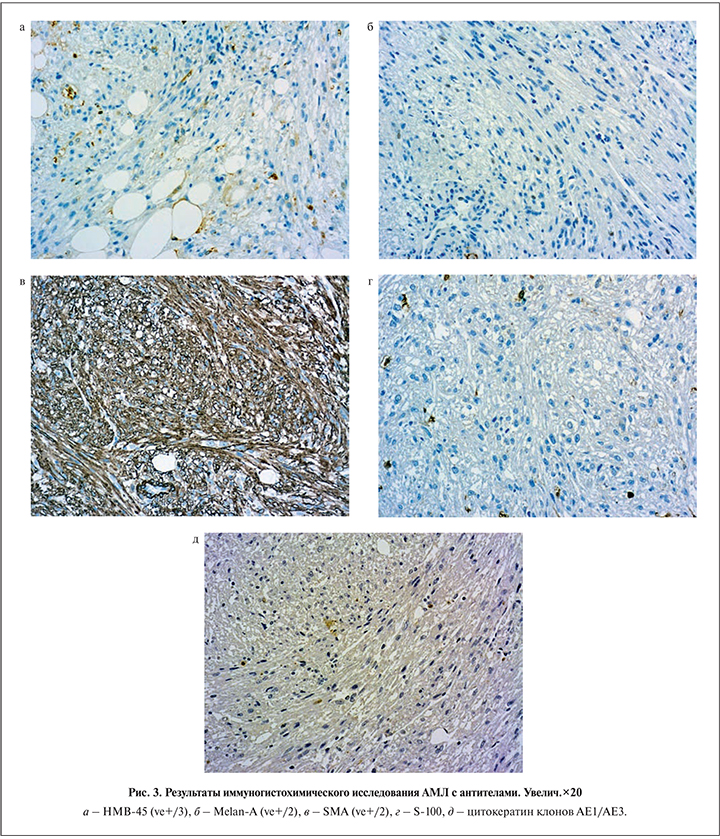
Результаты иммуногистохимического исследования. Во всех (n=42) случаях в структурах АМЛ почки отмечена положительная реакция на антитела к HMB-45 (ve+/3), Мелан-А (ve+/2) и SMA (ve+/2). Иммунонегативная реакция обнаружена с антителами к S-100 и общим цитокератинам клонов AE1/AE3 (рис. 3).
Почечная АМЛ – редкая доброкачественная опухоль, которая встречается самостоятельно или в комплексе с КТС или ЛАМ. Большинство (n=36) из исследуемых нами АМЛ были обнаружены случайно и не имели признаков кровоизлияния. Ангиомиолипомы чаще расположены в паренхиме почки, чем в капсуле или чашечно-лоханочной системе. При гистологическом изучении типичная АМЛ – это опухоль, состоящая из трех компонентов, а именно сосудистого (ангио-), веретеновидного (мио-) и жирового (липо-). В исследуемых образцах большинство кровеносных и лимфатических сосудов были толкостенными, их окружали веретеновидные клетки опухоли, обладавшие цитологическими признаками гладких миоцитов и меланоцитов. Согласно данным специализированной литературы среди веретеновидных клеток различают незрелые, зрелые гладкомышечные клетки и эпителиоидные клетки [9]. Обнаруженные липоциты располагались в АМЛ диффузно, между веретеновидными клетками, они были зрелыми и без признаков цитологической атипии. В связи с тем что для АМЛ характерно множество гистологических вариантов, она может маскироваться под другие новообразования, что затрудняет дифференциальную диагностику. Например, дистрофические изменения эпителиоцитов могут быть ошибочно приняты за варианты почечно-клеточного рака или за саркому. Тем не менее эти атипичные признаки не связаны со злокачественным характером опухоли [6].
Проведенное ИГХ-исследование во всех случаях демонстрировало положительное маркирование веретеновидных клеток на антитела к HMB-45 и Melan-A, что указывает на их меланоцитарное происхождение. Клетки мышечного компонента АМЛ показали позитивную реакцию на маркер гладких миоцитов (α-SMA). Отсутствие окрашивания в ходе ИГХ-анализа на белок S-100 и общие цитокератины свидетельствует о доброкачественном характере новообразования независимо от его размеров, что подтверждает данные единичных работ [6, 10, 11].
Результаты представленных иммуногистохимических реакций подтвердили заключение ранее проведенных биопсий (на дооперационном этапе), что позволяет рекомендовать их в качестве одной из обязательных диагностических манипуляций. Поскольку данные КТ не были абсолютно достоверными для АМЛ больше 4 см, связанных с быстрым ростом, а также с нечеткими границами и повышенной гетерогенной плотностью, морфологическая верификация (пред- и интраоперационная, плановая) остается приоритетной.
Ретроспективное исследование с использованием клинических и инструментальных методов в совокупности с морфологическими данными позволяет резюмировать, что независимо от размеров и гистологических вариантов АМЛ почек является доброкачественной опухолью (табл. 3).

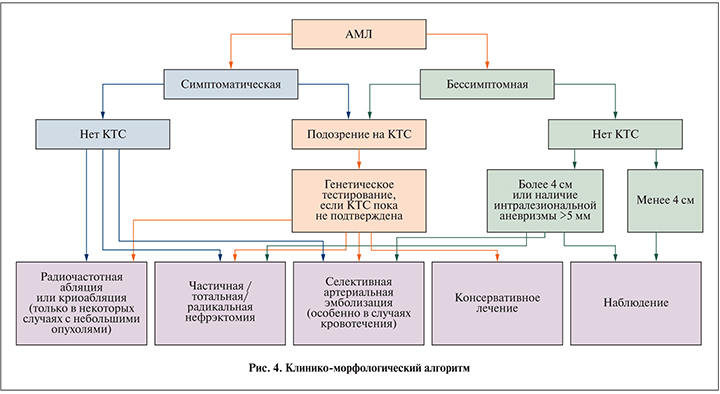
В настоящее время нет критериев, определяющих частоту, с которой пациенты должны проходить плановый осмотр (инструментальную диагностику). Ввиду отсутствия протоколов применяется индивидуальный подход, который учитывает размер опухоли, степень ее инвазии и прорастания в крупные кровеносные сосуды, а также наличие или отсутствие признаков КТС. Чаще всего после резекции признаков рецидива заболевания или метастазов не наблюдается [4, 11]. Анализируя данные специализированной литературы [4, 5, 8, 11] и сопоставляя их с результатами нашего исследования, был составлен клинико-морфологический алгоритм ведения пациентов с почечной АМЛ (рис. 4).
Заключение. Данные морфологического исследования АМЛ почек указывают, что данная опухоль является доброкачественной, поэтому частичную нефрэктомию (резекция почки), по нашему мнению, следует рассматривать в качестве альтернативы радикальной нефрэктомии, в том числе при спорадических гигантских ренальных АМЛ.



