Введение. Традиционно методом раздельной оценки почечной функции остается динамическая нефросцинтиграфия (ДН), поскольку введенный в кровеносное русло радиофармпрепарат фильтруется в почечном клубочке и не подвергается процессам реабсорбции и секреции [1].
В нескольких работах [2–4] показано, что погрешность результатов нефросцинтиграфии зависит от специалиста, выполняющего исследование, и может достигать 10%. Другими причинами, обусловливающими появление разночтений в интерпретации данных ДН, служат факторы со стороны пациента, а именно диурез, масса тела, которые могут влиять на функциональные расчеты при этом методе [5, 6]. Несмотря на это, ДН остается стандартным рутинным исследованием для раздельной оценки почечной функции, поскольку спектр альтернативных методов ограничен [6–8].
В данной статье мы хотим представить новый метод оценки функции почек на основе численного анализа результатов мультиспиральной компьютерной томографии (МСКТ) органов брюшной полости с контрастированием.
Современные трехатомные рентгеноконтрастные вещества (РКВ), используемые в лучевой диагностике, также представляют собой оптимальные в отношении физических свойств препараты, поскольку, так же как и, к примеру, технеций, не секретируются и не реабсорбируются, а только фильтруются [6]. С учетом вышеописанных фармакодинамических свойств современных контрастных веществ (КВ) информация, которую получают специалисты лучевой диагностики в ходе обследования пациента, может быть потенциально использована не только для описания анатомии, но и для оценки функции органа [1, 6, 9, 10].
Цель работы: изучить возможности численного анализа данных МСКТ почек с контрастированием для оценки ренальной функции.
Материалы и методы. С ноября 2015 по февраль 2017 г. на базе Клиники урологии им. Р. М. Фронштейна проведено проспективное исследование. Критериями включения в исследование стали наличие у пациента заболевания, приведшего к утрате части паренхимы почки и ретенционным изменениям в ней: опухоли, мочекаменной болезни, кист почек, гидронефроза, рефлюксной нефропатии, а также наличие данных инструментальных обследований, выполненных по протоколу: ДН и МСКТ почек с контрастированием. Критерии исключения: добровольный отказ от дальнейшего наблюдения; летальный исход за время наблюдения при необходимости повторного исследования. Критерии невключения: аллергическая реакция на контрастное вещество; беременность; наличие анатомически или функционально единственной почки (за исключением аномалии формы почек); пациенты с клаустрофобией, с когнитивно-мнестическими расстройствами (не в состоянии собрать мочу для пробы Реберга–Тареева, Зимницкого); уровень креатинина плазмы крови, который не позволяет проводить МСКТ с контрастированием.
В исследование вошел 31 (12 мужчин, 19 женщин) пациент, их средний возраст составил 58±21,7 года. У 14 пациентов диагностированы образования почки, у 9 –гидронефроз, у 7 – мочекаменная болезнь, у 1 – опухоль мочевого пузыря.
Обследование всех пациентов предусматривало проведение стандартных лабораторных тестов (клинический анализ крови и мочи, биохимический анализ крови), лабораторных тестов для оценки суммарной функции почки (проба Зимницкого, проба Реберга–Тареева); использование лучевых методов диагностики структурно-функционального состояния почек – УЗИ (в режиме «серой шкалы», а также допплерографии и импульсно-волнового сканирования), ДН, МСКТ почек с контрастированием.
В дополнение к стандартным методикам оценки функционального состояния почек выполнен математический анализ трехмерных изображений, полученных при МСКТ с контрастированием. Это позволило получить информацию о функциональном состоянии почек и процессах, обеспечивающих интраренальный транспорт мочи.
В качестве РКВ использованы препараты с рассчитанной рентгенологической плотностью 3200–4200 HU. Все расчеты продвижения РКВ по сосудам, интраренальным структурам и мочевым путям, а также построение и цифровая обработка трехмерных изображений проведены с использованием программы Amirа версии 5.4.5. Расчеты выполнены исследователем, не имевшим данных о ДН.
Полученные данные сопоставлены с заключением ДН. Четырем пациентам выполнено гистологическое исследование полученного в ходе оперативного вмешательства материала ткани почки под световым микроскопом. Это позволило получить дополнительную информацию о состоянии клубочкового и канальцевого аппарата, а также информацию о состоянии перигломерулярного и перитубулярного пространства.
Предлагаемый нами метод оценки раздельной функции почек (почки) при их заболеваниях основан на численном анализе данных МСКТ органов брюшной полости с контрастированием.
Последовательность исследования почек при МСКТ с контрастированием:
- сканирование до введения РКВ (нативная фаза – t0);
- сканирование после достижения РКВ, введенного в вену, уровня почечных артерий (артериальная фаза – t1) происходит по достижении порогового значения плотности РКВ в триггерной области интереса, равной 100 HU (отклонение от стандартов сканирования зависит от величины сердечного выброса и массы тела пациента);
- третье сканирование через 50–60 с после артериальной фазы (при этом поток РКВ минует почечные артерии [венозная фаза – t2]);
- заключительное сканирование через 7 мин после артериальной фазы (отложенная, или выделительная, фаза – t3), когда распределение КВ выходит на квазистационарный режим (перестает быстро меняться во времени).
Момент сканирования t1 (артериальная фаза) определяется автоматически по достижении заданной величины плотности РКВ в аорте (100 HU) в месте отхождения почечных артерий. Моменты t2 и t3 определяются исследователем (рентген-лаборантом).
Наш опыт показал, что для оценки функции почки лучше всего подходят следующие временные интервалы:
t2 = t1+55 (с),
t3 = t1+7 мин.
 В качестве РКВ использованы следующие препараты (обладают схожими физико-химическими свойствами – выводятся почками путем фильтрации): визипак 320 (4000 HU), омнипак 350 (3500 HU), ультравист 370 (3200 HU), сканлюкс 370 (4200 HU).
В качестве РКВ использованы следующие препараты (обладают схожими физико-химическими свойствами – выводятся почками путем фильтрации): визипак 320 (4000 HU), омнипак 350 (3500 HU), ультравист 370 (3200 HU), сканлюкс 370 (4200 HU).
Поскольку в инструкциях к препаратам нам не удалось найти их рентгенологическую плотность, мы сами провели ее измерение для каждого контрастного вещества на том же томографе, на котором в дальнейшем было проведено рентгенологическое исследование.
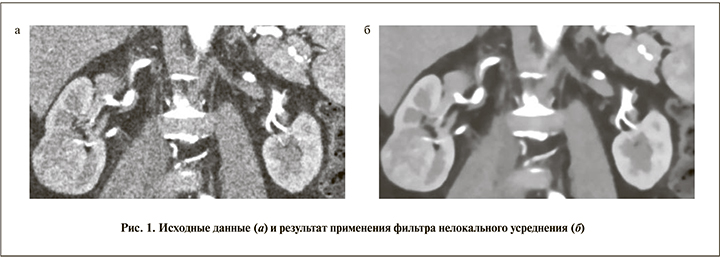
Исходными данными служили результаты МСКТ почек пациента с контрастированием в формате DICOM, полученные в нативную, артериальную, венозную и выделительную фазы (рис. 1, а). Данные МСКТ всегда весьма сильно искажены так называемым белым шумом. Перед выполнением всех основных расчетов мы избавлялись от этих шумов с помощью фильтров.
Самые высокочастотные шумы убирали с помощью трехмерного медианного фильтра. Применения только этого фильтра недостаточно, так как остаются шумы с большей длиной волны (их наличие обусловлено техническими особенностями регистрации и записи информации на цифровые носители), поэтому мы использовали еще один фильтр – нелокального усреднения (Noise-Reduction-Non local means; рис. 1, б). После применения двух фильтров мы получали изображения, с которыми и работали дальше.
Артериальная фаза исследования. К моменту времени t1 РКВ успевает проникнуть в корковый слой паренхимы и сконцентрироваться в почечных артериях, клубочках нефронов и венах (в концентрации менее 100 HU).
В программе Amira 5.4.5 имеется очень полезный и удобный инструмент редактирования трехмерных данных – редактор объема (Volume Edit).
Кисты не накапливают РКВ в процессе исследования, поэтому их удаление не обязательно. Так как опухоли накапливают РКВ, их необходимо удалить из набора данных, поскольку опухолевая ткань не участвует в нормальной функции почки.
Сделать это можно следующим образом:
- Используя имеющееся в Amira 5.4.5 средство сегментации, выделяем опухоль (значение 1 внутри опухоли, 0 вне опухоли).
- Используя модуль вычислений (Arithmetic (Amira)), заменяем значения плотности РКВ в опухоли на -1000 (рентгенологическая плотность воздуха по шкале Хаунсфилда)1.
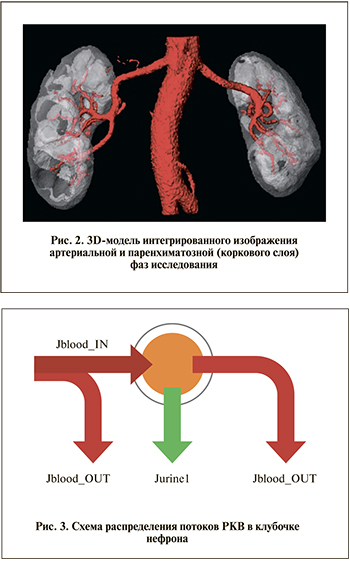
Используя все то же средство сегментации, выделяем области высокой концентрации РКВ за вычетом артерий и части вен. Будем называть эти области корковым слоем паренхимы (хотя это и не совсем точно; рис. 2).
Уже на этом этапе можно провести первые вычисления: найти сравнительные потоки РКВ в корковые слои паренхимы правой и левой почек (Crust Stream).
Используя в качестве области суммирования, полученные выше корковые слои паренхимы Ωcrust (R) и Ωcrust (L), находим массу РКВ в этих областях:
 С другой стороны, масса РКВ, поступившая в корковый слой, равна произведению среднего тока РКВ, умноженному на временной промежуток2, 3.
С другой стороны, масса РКВ, поступившая в корковый слой, равна произведению среднего тока РКВ, умноженному на временной промежуток2, 3.
Присутствующий в Amira 5.4.5 модуль Material Statistics вычисляет объемы выделенных областей и среднее значение распределения РКВ в них, т.е. позволяет найти MΩ, а следовательно, и распределение потоков крови между почками.
За промежуток времени t2–t1 между артериальной и венозной фазами поток РКВ в аорте успевает уйти из области почек.
Часть РКВ (Jblood_IN), поступившего в почку с кровью, в клубочке нефрона делится на два потока (рис. 3):
- РКВ, переносимое с первичной мочой, – Jurinel1;
- РКВ, следующее в выносящую артериолу, − Jblood_OUT.
Поскольку процессы образования первичной мочи и ее преобразования во вторичную достаточно медленные (гораздо медленнее процессов кровообращения в почке), необходимо, чтобы между артериальной и венозной фазами прошло достаточно времени с тем, чтобы значимое количество РКВ было перенесено вместе с первичной мочой из коркового слоя паренхимы в пирамиды мозгового вещества.
По нашему опыту, это время приблизительно соответствует 50 с в случаях, близких к норме (т.е. в условно здоровых почках). Если промежуток времени мал (порядка 25–30 с), РКВ не успевает в заметных количествах распространиться по структурам нефронов.
Для того чтобы вычислить поток первичной мочи (клубочковую фильтрацию), мы поступаем следующим образом. Выделяем из данных венозной фазы по отдельности области правой и левой почек. Далее, проведя процедуру удаления шумов (аналогично артериальной фазе), выравниваем изображение правой почки в венозной фазе к данным правой почки в артериальную фазу. То же выполняется для левой почки. Этот шаг необходим, так как во время измерения возможны небольшие движения пациента. После выравнивания мы можем сравнивать данные венозной и артериальной фаз.
Распределение РКВ в венозной фазе обусловлено двумя потоками: кровоснабжением самой почки и переносом его с первичной мочой. В артериальной же фазе концентрация РКВ в паренхиме почки настолько низкая, что в ней РКВ не регистрируется ≈0. Если мы вычтем из распределения плотности контраста n(x, t2) в венозной фазе распределение n(x, t1) в артериальной с коэффициентом, равным отношению средней плотности РКВ в корковом слое паренхимы венозной фазы к аналогичной величине в артериальной фазе, получим распределение той части РКВ, которая переносится с первичной мочой4.
 Далее мы поступаем аналогично тому, как это было сделано при вычислении потока РКВ в корковом слое.
Далее мы поступаем аналогично тому, как это было сделано при вычислении потока РКВ в корковом слое.
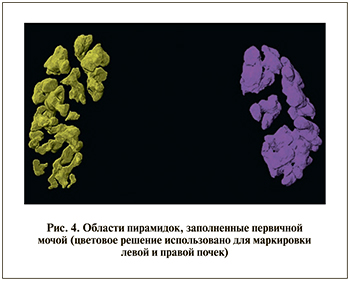
Используя методы сегментации, имеющиеся в Amira, мы выделяем области достаточно высокой концентрации РКВ в Δnurine1(x, t2) (по отдельности в правой и левой почках; рис. 4).
Используя Material Statistics, находим количество РКВ, перенесенного первичной мочой5.
Так как это количество пропорционально потоку, умноженному на время (а время одно и то же), распределение этих масс пропорционально распределению потоков первичной мочи.
Принимая полный поток первичной мочи за 100%, вычисляем его распределение между правой и левой почками (Urine1Stream).
Кроме распределения потоков между почками в этой фазе можем вычислить процент РКВ, переносимый с первичной мочой за 1 с из коркового слоя в пирамидки6, 7.
Выделительная фаза. Анализ показателей на данной фазе позволяет оценивать выделительную способность почек, т.е. процессы образования вторичной мочи.
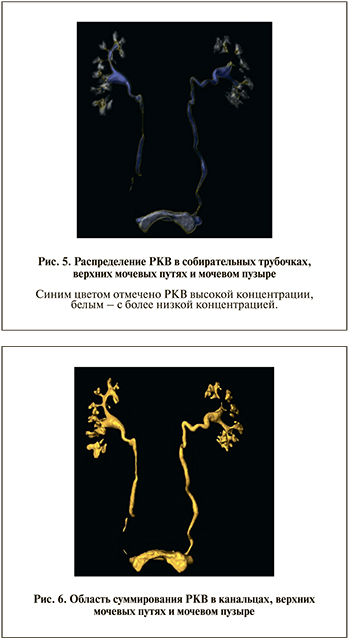
Следует отметить, что к выделительной фазе, как правило, потоки вторичной мочи успевают сместиться в мочевой пузырь. В этих условиях мы можем вычислить только количество РКВ, выделенное обеими почками (рис. 5).
Для выделения области распределения РКВ в канальцах, верхних мочевых путях и мочевом пузыре используем модуль LabelVoxel (Amira) и находим область суммирования (рис. 6).
С помощью Material Statistics находим Mcontrast (t3) массу РКВ в этой системе, а разделив его на массу введенного РКВ (которое получится из произведения плотности РКВ на введенный объем РКВ), получаем процент РКВ, выделившегося к 7-й минуте.
Полученная величина tot (%) характеризует выделительную функцию почек.
Если у пациента имеются камни почек, то их «массу» в HU нужно вычесть из той массы, которую мы получили ранее, просуммировав n (x, t3) по выделенной области, с тем чтобы получить «массу» РКВ, принесенную с вторичной мочой.
В ряде случаев РКВ из почки не попадает в мочевой пузырь в регистрируемых концентрациях к моменту t3.
В такой ситуации мы можем разделить правую и левую подсистемы мочевыделения и вычислить распределение РКВ во вторичной моче справа и слева.
По отдельности вычислив массы РКВ в левой и правой подсистемах, находим массу РКВ во вторичной моче.
А так как эти массы=JΩ*(t3-t1), находим распределение потоков вторичной мочи (перфузию)8. Однако такие ситуации, когда время достижения РКВ мочевого пузыря с обеих сторон сильно различается, встречаются достаточно редко (односторонние обструкции верхних мочевых путей различного генеза).
В ситуациях же, когда сроки достижения мочевого пузыря примерно равны и потоки РКВ успевают сильно переместиться в мочевом пузыре, используем другой способ оценки перфузии (т.е. распределение потоков вторичной мочи). Поскольку количество РКВ в канальцах приблизительно пропорционально проходящим по ним потокам, выделяем области канальцев в правой и левой почках по отдельности, находим количество РКВ в них и по этому количеству судим о распределении потоков (перфузии) вторичной мочи.
Формулы те же, что и выше, но под Млевая или Мправая подразумевается количество РКВ в канальцах.
Подчеркнем, что этот способ оценочный. Однако в тех случаях, когда подсистемы (право–лево) были разделены, а области канальцев можно было выделить (т.е. они не были повреждены, как при гидронефрозе), значения перфузии, полученные прямым вычислением по количеству образовавшейся вторичной мочи и по количеству контрастирования в канальцах, различались мало.
Важной характеристикой работы почек является удельная способность коркового слоя паренхимы (нефронов) вырабатывать вторичную мочу. Данная величина может быть посчитана по формуле9 и получается делением вычисленного ранее процента полного выделения РКВ к 7-й минуте на объем коркового слоя паренхимы правой и левой почек с учетом перфузии.

Еще одной величиной, характеризующей распределение потоков РКВ между образованием мочи и возвратом части его (РКВ) в большой круг кровообращения, является коэффициент, который получается делением количества РКВ во всей паренхиме в венозной фазе (столб РКВ миновал почечные артерии, а в почке осталось РКВ, удерживаемое в нефронах) на количество выделенного РКВ данной почкой в выделительной фазе – К2310.
Величина Мparankhima (2), отнесенная к полной рентгенологической массе введенного РКВ, характеризует принимающую способность почки, а Мurine_2(3) – ее выделительную способность.
По величине K23 можно судить о разделении общего потока РКВ между системами кровоснабжения и фильтрации в процессе очищения крови почкой.
Так, например, у здорового 21-летнего мужчины при введении 100 мл визипака-320 со скоростью 4 мл/с – Mparenkhima (2)/MКВ≈3,2% на каждую почку, а Мurine_2(3)/MКВ≈4,5%, т.е. К23≈0,7, при этом скорость переноса массы РКВ с первичной мочой MassVelocityurine1≈0,56% в с.
В тех случаях, когда имеется локальное повреждение паренхимы почки, можем поступить следующим образом: разделить почку на подобласти – более и менее поврежденную (например, правая верхняя половина, правая нижняя половина); дальнейший анализ провести как для двух разных почек.
Такой подход дает нам возможность судить о посегментарной функции почек.
Программа Amira помогает существенно дополнить расчеты воксельными трехмерными графиками. Визуализация распределения РКВ с помощью модуля Volren (Amira) со специально построенными картами передачи цвета и прозрачности позволяет быстро и наглядно определять функциональное состояние почек по виду распределений РКВ в артериальной, венозной и выделительной фазах.
Помимо оценки почечной функции с помощью методики, основанной на численной обработке данных МСКТ почек с контрастированием мы сравнили полученные данные с результатами ДН.
Данный общепризнанный инструментальный метод позволяет оценивать раздельную функцию почек на основании применения радиофармпрепаратов (РФП), гамма-камер с компьютерной обработкой данных. Принцип метода основан на исследовании функционального состояния почек путем регистрации активного накопления почечной паренхимой меченых нефротропных соединений (⁹⁹mTc-ДТПА-диэтилтриаминопетатцитат) и выведения их по верхним мочевым путям. Дифференцированные уравнения определяют скорость выделения изотопа [6, 11].
Для оценки статистической значимости различий была использована программа статистической обработки данных MedCalc Statistical Software version 17.0.4 (MedCalc Software bvba, Ostend, Belgium; https://www.medcalc.org; 2017).
Результаты. Целью настоящей работы было сравнить данные МСКТ с контрастированием и выполненной по протоколу ДН с целью оценки функциональных возможностей почки на основании. Проведенный анализ выявил статистически значимую корреляцию показателей, полученных с помощью этих методик (рис. 7).
Для иллюстрации данной методики приведем клиническое наблюдение.
П а ц и е н т к а 54 лет. Диагноз: терминальный гидронефроз левой половины подковообразной почки. Исходно при ДН получены данные, позволяющие надеяться на восстановление функции в послеоперационном периоде: перфузия слева – 43,6%, справа – 56,4%; почечный плазмоток: слева – 68,6 мл/мин, справа – 190,3 мл/мин (в пересчете на относительные величины: слева – 26%, справа – 74%). При оценке функционального состояния обеих половин подковообразной почки с помощью численного анализа данных МСКТ с контрастированием по сравнению с ДН получены менее оптимистичные данные, а именно: перфузия слева – 15%, справа – 85%, плазмоток слева – 26,5%, справа – 73,5%. С учетом относительной сохранности левой половины подковообразной почки, по данным ДН, принято решение о выполнении пластической операции на верхних мочевых путях слева – лапароскопической пластики лоханочно-мочеточникового сегмента слева по Андерсену–Хайнсу–Кучере. Дренирование верхних мочевых путей слева выполнено катетером-стентом. Кроме того, для получения данных о морфологическом состоянии левой половины подковообразной почки интраоперационно была выполнена биопсия из ее визуально наиболее сохранного участка паренхимы. Патоморфологические данные свидетельствовали о значительно сниженной функциональной способности ткани почки (в клубочках перигломерулярный склероз, расширение мезангия, очаговое утолщение базальной мембраны); эпителий в состоянии белковой дистрофии и атрофии (более 60%). Именно это в большей степени соответствовало результатам численного анализа данных МСКТ почек с контрастированием, нежели ДН. Действительно, существуют определенные ошибки при экстраполяции качественных данных, которой является описательная часть патоморфологического заключения, на количественные показатели ДН и предложенной методики. Тем не менее по данному патоморфологическому заключению косвенно судить о неблагоприятном состоянии функции почки данной пациентки можно. Для оценки анатомо-функционального состояния подковообразной почки после пластической операции через 8 мес. были проведены контрольные исследования. При ДН: ренограммы асимметричны по амплитуде. Справа кривая функционального типа, выделение умеренно замедлено, равномерно. Слева низкоамплитудная кривая аккумулятивного типа. Перфузия: слева – 36%, справа – 64%. Почечный плазматок (в пересчете на относительные величины): слева – 21%, справа – 79%. При сравнительной оценке функции обеих половин подковообразной почки с помощью численного анализа результатов МСКТ с контрастированием в динамике получены следующие данные: перфузия слева – 18%, справа – 82%, почечный плазмоток слева – 15%, справа – 85%.
Обсуждение. Предложенный нами метод численной оценки функции почек позволил получить результаты, сходные с данными ДН. Такой инновационный метод оценки почечной функции дает возможность не только определить топографические взаимоотношения нормальных и измененных анатомических структур в зоне хирургического интереса [12], но и более прецизионно выбрать объем вмешательства, исходя из сохранности функции органа в предоперационном и прогнозируемом послеоперационном периодах.
Численная обработка данных МСКТ почек с контрастированием для оценки интраренального транспорта мочи показала сопоставимые предварительные результаты по сравнению с ДН. Новые результаты данной инновационной разработки дают возможность получать дополнительную информацию о процессах, обеспечивающих транспорт мочи в почечной паренхиме (из почечной коры в канальцы и чашечно-лоханочную систему) при урологических заболеваниях у разных групп больных. Использование указанного программного обеспечения с обработкой данных в трехмерном режиме позволит не только получать информацию о почечном плазматоке, клубочковую фильтрацию, показатели перфузии, пересчитанные на объем паренхимы (как при ДН), но и самое важное – определять не только локализацию, но и объем функционально несостоятельной паренхимы пораженных почек. В зависимости от поставленной задачи данная инновационная методика дает возможность выполнять посегментарные количественные расчеты функционирующей почечной паренхимы, более точные (по сравнению с ДН) расчеты при ретенционных изменениях паренхимы, связанных с нарушением оттока мочи, в частности при гидронефрозе.
По предварительным расчетам, на относительно небольшом количестве пациентов в данном пилотном исследовании мы получили результаты, сопоставимые с данными нефросцинтиграфии, причем здесь стоит еще раз подчеркнуть, что специалист (физик-теоретик), рассчитавший функцию почек новым методом, не был осведомлен о результатах радиоизотопного исследования до начала расчетов. Единственная группа пациентов, у которых наблюдались расхождения в значениях перфузии и других показателей, которые можно определять с помощью данного метода, – это пациенты на различных стадиях гидронефротичекой трансформации. Известно, что для расчета функции почки с помощью ДН у данной группы пациентов разработаны специальные протоколы, которые позволяют дифференцировать ретенционную нефропатию от исходно сниженной функции почки с имеющимся наряду с этим гидронефрозом [3]. Поскольку анатомия органа неразрывно связана с его функцией и, наоборот, для определения состояния клубочков и перигломерулярного пространства, а также канальцев и перитубулярного пространства, мы выполнили дополнительное гистологическое исследование (n=4) с использованием световой, у некоторых пациентов (n=3) – электронной микроскопий.
Таким образом, можно отметить, что функциональных резервов у левой половины подковообразной почки данной пациентки оказалось гораздо меньше, поскольку каких-либо изменений в работе почки после улучшения оттока мочи по верхним мочевым путям слева не произошло как по данным ДН, так и по результатам численного анализа данных МСКТ. Именно это и подтверждают результаты патоморфологического исследования, к которым наиболее близки были расчеты, полученные с помощью предложенной методики обработки данных.
Интересно, что ответ на некоторые вопросы, которые стояли перед исследователями в отношении работы почки, был получен при детальном анализе данных микроскопии.
Предварительные результаты указывают на то, что показатели оценки функции почек при помощи МСКТ и специального программного обеспечения не отличаются от таковых, полученных при ДН, за исключением наблюдения с терминальным гидронефрозом. Кроме того, предлагаемый инновационный подход позволяет получать дополнительную информацию о функциональном состоянии почек и интраренальном транспорте мочи, что не представляется возможным при рутинных методах диагностики (проба Реберга, проба Зимницкого, расчетная СКФ, допплерография почек, ДН, статическая нефросцинтиграфия, экскреторная урография, МСКТ с контрастированием).
Заключение. Приведенные результаты предварительные, но совершенно очевидно, что предлагаемый инновационный метод оценки интраренального транспорта мочи и анализа раздельной функции почек может быть реализован в рамках одного высокотехнологичного лучевого исследования, что может снизить не только финансовые затраты на каждого больного, но и лучевую нагрузку на организм пациента.
Мы рассчитываем внедрить эту инновационную методику в качестве нового емкого диагностического способа оценки раздельной функции почек. Получение более точных результатов оценки функции почек методом численной трехмерной обработки данных МСКТ позволит разрабатывать персонифицированный подход к каждому конкретному пациенту, что благотворным образом отразится как на результатах лечения, так и на дальнейшем прогнозе течения заболевания в целом. Новые данные могут помочь в понимании патофизиологических процессов, происходящих при широком спектре уро- и нефрологических заболеваний.






