Миопатия Ландузи-Дежерина (лице-лопаточно-плечевая миодистрофия, ЛЛПМД) является третьей наиболее распространенной мышечной дистрофией после мышечной дистрофии Дюшенна и миотонической дистрофии, с распространенностью ≈12–15 случаев на 100 тыс. насления. Заболевание может дебютировать как при рождении, так и в более позднем возрасте. В среднем у мужчин заболевание чаще начинается в подростковом возрасте, у женщин – в возрасте от 20 до 30 лет [1].
Классически заболевание проявляется слабостью мышц лица и проксимального отдела верхней конечности, из-за чего лопатка приобретает характерный внешний вид («крыловидная лопатка») (рис. 1). Вслед за этим развивается слабость мышц тыльной стороны стопы и тазобедренного пояса. Кроме того, ассиметрично поражаются мышцы туловища, включая параспинальные и брюшные мышцы. Асимметричное вовлечение встречается часто и часто очень заметно. Таким образом, ЛЛПМД может приводить к значительной инвалидизации – 20% пациентов становятся зависимыми от инвалидных колясок после 50 лет. С учетом литературных данных имеет место широкий спектр возраста начала заболевания, а также изменчивости скорости прогрессирования заболевания, но в целом которая медленна [2].
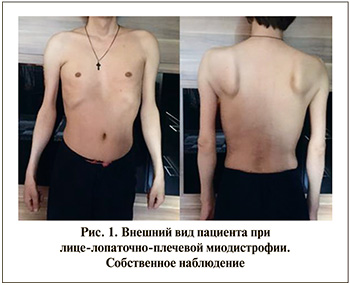
Существует консенсус в отношении того, что ЛЛПМД вызывается аберрантной продукцией фактора транскрипции гена DUX4 в скелетных мышцах. DUX4 обычно экспрессируется во время раннего эмбрионального развития, а затем эффективно подавляется во всех тканях, кроме яичек и тимуса [3]. При ЛЛПМД DUX4 ассоциирован с активацией путей, токсичных для мышечной ткани, включая окислительный стресс и повреждение ДНК, ингибирование мышечной дифференцировки и воспаление, приводящее к апоптозу мышечных клеток [4].
Были описаны другие первичные проявления, включая слабость мышц тазового пояса, изолированное поражение конечностей, тяжелое поражение лица в младенчестве и камптокормию. Несмотря на то что отдельные пациенты могут описывать почти рецидивирующее течение с периодами, когда определенная мышца вовлекается и истощается, за которыми следуют периоды незначительного прогрессирования или отсутствия прогрессирования, обычно у пациентов с ЛЛПМД наблюдается медленное, но неуклонное прогрессирование слабости мышц туловища, затем дистальных отделов нижних конечностей и более проксимальных мышц. Риск стать прикованным к инвалидному креслу является бимодальным с пиком во втором десятилетии для пациентов с более тяжелыми проявлениями в младенчестве, за которым следует медленное увеличение риска с возрастом [5].
Ниже будет продемонстрировано клиническое наблюдение ассоциации вышеуказанной нозологической формы с неишемическим приапизмом как проявление высокой травматической компрометации при данном заболевании.
Клиническое наблюдение
21.02.2022 в клиническую больницу им. Святителя Луки обратился пациент 42 лет с жалобами на увеличение в размерах полового члена (тумесценция на протяжении 11 дней). Из анамнеза известно, что около 2 нед. назад у пациента имела место травма промежности во время прогулки, после чего появились вышеуказанные жалобы. В результате исследования на амбулаторном этапе (пенильная допплерография) был установлен диагноз неишемического приапизма.
Сопутствующие заболевания: миопатия Ландузи-Дежерина.
При физикальном обследовании пациента отмечается умеренно выраженная пенильная тумесценция, половой член при пальпации безболезненный. При пальпации предстательной железы выявлена незначительная болезненность.
Диагноз неишемического приапизма был подтвержден посредством допплерографии полового члена, в результате которой была выявлена артериовенозная фистула правого кавернозного тела (Рис. 2).
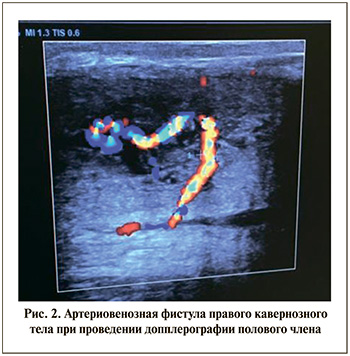
С учетом данных физикального обследования и допплерографии полового члена пациенту рекомендовано проведение оперативного пособия в объеме эндоваскулярной эмболизации артериовенозной фистулы.
Под местной анестезией (новокаин 0,25% – 30 мл) пунк-тирована и катетеризирована левая бедренная артерия (Интродьюсер 5 Fr Avanti, Cordis). Диагностический катетер Roberts 5Fr по гидрофильному проводнику заведен в контралатеральную (правую) внутреннюю половую артерию. При ангиографии – участок экстравазации в проекции проксимальной части полового члена. Смена катетера по гидрофильному проводнику на VERT 4 Fr. Внутриартериально введен гепарин 2500 EД. По коронарному проводнику Sion 0,014 микрокатетером Excelsior последовательно селективно катетеризирована артерия полового члена, далее дорсальная артерия полового члена и первая (скомпроментированная) окружающая артерия полового члена.
При селективной ангиографии выявлено контрастирование полости в проксимальной части правого пещеристого тела размером 10х7мм (рис. 3). Выполнена суперселективная эмболизация скомпроментированной ветви артерии полового члена микроспиралью. При контрольной ангиографии участков экстравазации не выявлено (рис. 4). Дорсальная артерия полового члена не скомпрометирована. Интродьюсер и катетер удалены. После операции – мануальный гемостаз, давящая асептическая повязка. За время операции введено 55 мл ОМНИПАК (350 мг йода/мл).

Во время осмотра спустя час после операции у больного отмечалось наличие пенильной тумесценции. Состояние пациента оценено относительно удовлетворительным. Пациент не лихорадил. Локально: повязка сухая, пенильная тумесценция сохранялась в прежнем объеме.
На третьи сутки после операции пациент предъявлял жалобы на незначительные периодические боли в области оперативного вмешательства. Состояние больного удовлетворительное, не лихорадил. Локально: рана без признаков воспаления. Пенильная тумесценция регрессировала.
На седьмые сутки после операции пациент выписан из стационара в удовлетворительном состоянии.
Рекомендации:
1. Наблюдение урологом, неврологом по месту жительства;
2. УЗИ полового члена 1 раз в месяц;
3. Детралекс 1000 мг 1 р. в.д. – 30 дней;
4. Профилактика травматизма на фоне миопатии.
При проведении контрольного осмотра спустя 3 мес. после выписки из стационара состояние пациента удовлетворительное, при допплерографическом исследовании – отсутствие патологического соустья сосудов, сексуальная функция не нарушена (21 балл по шкале МИЭФ-5).
Приапизм определяется как продолжительная эрекция, не связанная с сексуальной стимуляцией, которая не регрессирует самостоятельно [6]. Частота приапизма составляет 0,5–0,9 случая на 100 тыс. человек в год в общей популяции [7]. Большая часть литературы по приапизму представлена в виде небольших серий наблюдений, в которых выделяются три типа: ишемический, неишемический и перемежающийся приапизм. Неишемический приапизм (НИП), также известный как артериальный, или приапизм «высокого потока», был впервые описан Бертом в 1960 г. и встречается значительно реже, чем ишемический тип, составляя всего 5% всех случаев приапизма [8].
При широко распространенном ишемическом варианте приапизма внутри кавернозных тел возникает давление, вызывающее компартмент-синдром и приводящее к развитию гипоксии, гиперкапнии и ацидоза в этих тканях. Это неотложная урологическая ситуация, и в отсутствие лечения ее устранение может занять несколько дней, что приведет к фиброзу тел полового члена и эректильной дисфункции.
В отличие от ишемического варианта НИП не является чрезвычайной ситуацией. НИП связан с нерегулируемым артериальным притоком в тела, как правило, из поврежденной ветви кавернозной артерии или самой кавернозной артерии. Несмотря на то что такая ситуация обычно развивается в результате травмы, фистула может быть непреднамеренно создана во время процедуры шунтирования для лечения ишемического варианта приапизма [9].
При травматическом механизме половой член обычно вялый в момент травмы, следовательно, артерии сужены. Приапизм обычно возникает после ночной эрекции, во время которой увеличение кровотока разрушает любой сгусток и оказывает давление на поврежденную стенку артерии, что приводит к образованию артериолакунарной или артериосинусоидальной фистулы и нерегулируемому кровотоку. Это может частично объяснять, почему может быть задержка между повреждением и развитием приапизма, который может проявиться неделями позже. Все пациенты с приапизмом подвержены риску развития кавернозного фиброза в той или иной степени [8].
Физикальное исследование должно включать осмотр гениталий, промежности. Выраженная ригидность и болезненность пениса свидетельствуют об ишемическом приапизме. Неишемический приапизм может вызывать дискомфорт, но обычно не вызывает острой боли. При этом кавернозные тела эрегированы, но не полностью ригидны, хотя они могут стать такими при сексуальной стимуляции. Вследствие того, что болевой синдром при НИП, как правило, слабо выражен или не выражен вовсе, пациенты вовремя не обращаются к профильному специалисту [10].
Лабораторные анализы включают общий анализ крови с развернутой лейкоцитарной формулой и коагулограммой для исключения анемии и других гематологических заболеваний. Аспирация крови из кавернозных тел является ключом к классифицированию состояния. При ишемическом приапизме кровь темная с парциальным давлением кислорода (pO2) <30 мм рт.ст., парциальным давлением углекислого газа (pCO2) >60 мм рт.ст. и pH <7,25. При неишемическом приапизме кровь ярко-красная, с pO2 >90 мм рт.ст., pCO2 <40 мм рт.ст. и рН 7,4 [8].
Цветное дуплексное допплеровское ультразвуковое сканирование (ЦДДУС) полового члена и промежности рекомендуется для дифференцировки неишемического и ишемического приапизма и иногда может идентифицировать место артериовенозной фистулы, что может быть полезно для дальнейшего оперативного вмешательства. ЦДДУС почти на 100% чувствителен к локализации фистул со специфичностью 73%. Ультразвуковое сканирование должно включать осмотр всего ствола пениса в периуретральной сагиттальной плоскости с двух сторон, а также ножек пениса с двух сторон, чему способствует размещение пациента в литотомическом положении с приподнятой мошонкой, поскольку свищи и псевдоаневризмы чаще локализуются в промежностной части кавернозных тел. Доплеровские сигналы с пиковой систолической скоростью >50 см/с и конечная диастолическая скорость, равная 0 или отрицательная, свидетельствуют о неишемическом приапизме [11].
Пудендальная артериография может быть полезной при неишемическом приапизме для определения местоположения места повреждения для эмболизации артерии. Магнитно-резонансная артериография (МРТ-артериография, МРА) рассматривалась как способ лучшего определения количества, размеров и расположения сосудов фистулы, что может быть полезно для проведения суперселективной ангиоэмболизации. МРА может помочь в планировании оперативного вмешательства. Компьютерная томографическая ангиография также может использоваться для диагностики, хотя она используется редко [12].
Наличие у пациента мышечно-дистрофического заболевания, в частности миопатии Ландузи-Дежерина, является фактором, предрасполагающим к более частой травматизации пациентов по сравнению с общей популяцией. Травма полового члена или промежности при повреждении артерии и формировании артерио-лакунарной фистулы может приводить к развитию симптомов неишемического приапизма.
Данное клиническое наблюдение призвано насторожить коллег о возможности развития у пациентов с заболеванием опорно-двигательного аппарата такой редкой разновидности приапизма, а также напомнить о необходимости пристального осмотра наружных половых органов с учетом возможного отложенного характера возникновения симптомов. Однако окончательно дифференцировать неишемический вариант приапизма от ишемического возможно только после проведения допплерографии или газометрии крови, аспирированной из кавернозных тел.



