Введение. Мочекаменная болезнь необычайно широко распространена в мире. Примерно 10% населения в течение жизни получают медицинскую помощь по поводу уролитиаза [1]. По поводу мочекаменной болезни в США ежегодно госпитализируют 185 тыс. пациентов, 2 млн получают лечение амбулаторно; суммарные затраты на лечение больных уролитиазом составляют 2,1 млрд долл. в год [2, 3].
Основным условием образования камней всегда считали перенасыщенность мочи, что ведет к кристаллизации растворенных солей; исходя из этого постулата больным мочекаменной болезнью, как правило, рекомендуют прием повышенного объема жидкости, что не всегда оправданно.
Урогенитальные инфекции и уролитиаз тесно взаимосвязаны. Доказана роль уреазопродуцирующих бактерий в формировании струвитных конкрементов [4], но на их долю в структуре нефролитиаза приходится не более 4%. Напротив, Oxallobacter formigenes препятствует образованию камней. В свою очередь микробная флора формирует на поверхности камня биопленку, что поддерживает хроническую мочевую инфекцию [5–8].
В Российской Федерации, особенно в Сибири и на Дальнем Востоке, сохраняется неблагополучная эпидемическая ситуация по туберкулезу [9–12]. Туберкулезный очаг воспаления может заживать посредством имбибирования солями кальция, во фтизиатрии существует понятие «туберкулезные очаги в фазе обызвествления». Такой очаг обызвествления в почке ошибочно может быть диагностирован как камень почки. В этом случае выполнение контактной и тем более дистанционной литотрипсии за счет разрушения старых туберкулезных очагов может способствовать выходу микобактерии туберкулеза в кровь и привести к генерализации туберкулеза, включая фатальные формы менингоэнцефалита.
Туберкулез мочевого пузыря и половых органов мужчин в ряде случаев может быть верифицирован патоморфологически [9, 13, 14]; при дифференциальной диагностике между мочекаменной болезнью и туберкулезом почек это крайне маловероятно. Более того, стандартная диагностическая процедура – терапия ex juvantibus 1-го типа – также может оказаться неэффективной для этих пациентов из-за сопутствующего вторичного неспецифического пиелонефрита [15].
Цель исследования: проанализировать частоту коморбидности нефротуберкулеза и уролитиаза и определить влияние мочекаменной болезни на клиническое течение туберкулеза почек.
Материалы и методы. Проведено открытое когортное ретроспективное исследование. В исследование включили 843 больных туберкулезом почек, наблюдавшихся в урогенитальной клинике ФГБУ «Новосибирский НИИ туберкулеза» Минздрава России, а также 245 пациентов, поступивших в клинику на дифференциальную диагностику, в ходе которой был установлен диагноз «мочекаменная болезнь». 1088 историй болезни проанализировали с целью выявления сочетания этих двух заболеваний и определения клинической картины туберкулеза почек, мочекаменной болезни и коморбидного состояния.
Для выявления возможных причин развития мочекаменной болезни у больных туберкулезом изучили концентрацию общего кальция и фосфора в сыворотке крови: у больных туберкулезом легких (44 человека), урогенитальным туберкулезом (17) и у пациентов с хроническим неспецифическим пиелонефритом (12).
Статистическая обработка результатов проведена на персональном компьютере с помощью пакетов статистических программ Мicrosoft Eхсе1 2007 и Statistiсa for Windows 6.0. Значимость различий (p) оценивали, используя t-критерий Стьюдента и критерий Манна–Уитни. Частоты признаков сравнивали с помощью критерия χ2-квадрат Пирсона. Статистически значимыми считали различия при р<0,05.
Результаты. Из 843 больных туберкулезом почек у 39 (4,6%) заболевание сочеталось с нефролитиазом.
Как видно из таблицы, сочетание мочекаменной болезни с нефротуберкулезом закономерно проявляется более выраженной симптоматикой, вероятность рецидива туберкулеза у таких пациентов повышается более чем в 2 раза. За исключением частоты почечной колики и дизурии, клинические проявления мочекаменной болезни и нефротуберкулеза статистически значимо не различались.

До начала приема противотуберкулезных химиопрепаратов средняя концентрация общего кальция в сыворотке крови составила 2,58 мкмоль/л у больных туберкулезом легких, 2,64 мкмоль/л у больных урогенитальным туберкулезом, 2,63 мкмоль/л у больных пиелонефритом и достоверных различий не имела.
Однако у больных как туберкулезом легких, так и урогенитальным уберкулезом по сравнению с больными пиелонефритом наблюдалась тенденция к гипоальбуминемии (38,5, 38,8 и 40,2 г/л соответственно), что косвенным образом свидетельствует о повышении ионизированного кальция в сыворотке крови у этих пациентов.
Мы также сравнили суточную экскрецию ряда камнеобразующих элементов: оксалатов, мочевой кислоты и фосфатов у больных уротуберкулезом и неспецифическим пиелонефритом. Выяснилось, что длительный инфекционно-воспалительный процесс в почках независимо от его этиологии приводит к повышению экскреции оксалатов, причем более выраженно при неспецифическом пиелонефрите – 64,3 и 81,6 ммоль/сут (р<0,05). Трехмесячный курс противотуберкулезной химиотерапии привел к увеличению экскреции оксалатов у больных уротуберкулезом до 87,6 ммоль/сут, что составило 36,2% (р<0,05).
Экскреция мочевой кислоты, не имевшая достоверных отличий исходно в обеих группах (4,97 и 5,19 ммоль/сут), статистически значимо увеличилась (до 6,64 ммоль/сут) через 3 мес. приема противотуберкулезных препаратов.
Установлено, что более высокий уровень экскреции фосфатов характерен для больных пиелонефритом – 87,44 ммоль/сут. У больных урогенитальным туберкулезом экскреция фосфатов была в 2 раза ниже (39,65 ммоль/сут), чем у больных хроническим пиелонферитом, и прием противотуберкулезных препаратов не повлял на этот параметр (39,15 ммоль/сут).
При этом ни в одном случае и ни в одной группе нами не зафиксировано наличия уреазопродуцирующей флоры в моче и повышения рН мочи выше 7,0.
Таким образом, нами выявлено увеличение суточной экскреции оксалатов и мочевой кислоты в процессе терапии больных туберкулезом мочевой системы. Первое может быть связано с длительным приемом антибактериальных препаратов. Доказано, что в составе нормальной микрофлоры кишечника обитают бактерии, метаболизирующие оксалаты и уменьшающие их всасывание [4–8, 16]. Гиперурикозурия не только служит причиной формирования солей мочевой кислоты, но и повышает сатурацию мочи, благоприятствуя образованию кальциево-оксалатных конкрементов.
Изменение суточной экскреции камнеобразующих элементов у больных туберкулезом может служить фактором риска формирования конкрементов в мочевой системе. Для профилактики камнеобразования больным туберкулезом показана фитотерапия.
Обсуждение. Проблема дифференциальной диагностики мочекаменной болезни и нефротуберкулеза актуальна во всем мире. В двух статьях описаны наблюдения «сочетания» мочекаменной болезни и нефротуберкулеза у трех жительниц Канады. Мы намеренно взяли слово «сочетания» в кавычки, поскольку пристальный анализ показал, что в этих ситуациях имели место ошибки дифференциальной диагностики. Чернокожей жительнице Канады 76 лет была проведена перкутанная нефролитотомия (так у авторов) по поводу камня нижнего полюса правой почки. Туберкулез у нее все же подозревали, поэтому выполнили посев мочи на микобактерию туберкулеза, но получили отрицательный результат [17]. На рис. 1 хорошо визуализируются полости с краевым обызвествлением. Однако камня, который бы стал показанием к нефролитотрипсии, на наш взгляд, не видно. Тем не менее операцию выполнили, но стенки лоханки оказались настолько воспалены, что было принято решение о проведении биопсии; гистологически обнаружен туберкулез.
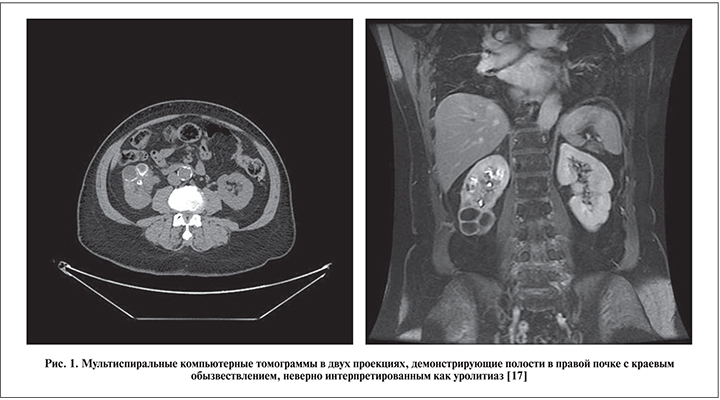
В послеоперационном периоде была найдена и микобактериурия.
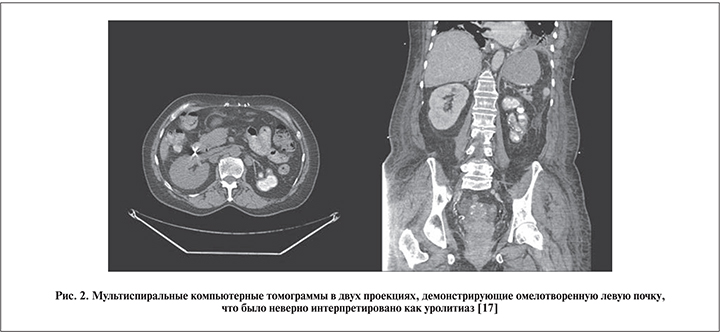
Второй пример – также пожилая 70-летняя канадка греческого происхождения, которая была оперирована по поводу коралловидного камня вторично сморщенной почки. Тридцать лет назад ей была выполнена илеоцистопластика по поводу сморщенного мочевого пузыря, который выявили во время лечения туберкулеза легких. Совершенно очевидно, что в то время у нее был и туберкулез почек, поскольку туберкулез мочевого пузыря всегда вторичен по отношению к нефротуберкулезу, но почему-то диагностирован не был. В результате погибшая почка имбибировалась солями кальция (так называемая аутоампутация почки), но это исход нефротуберкулеза, а не сопутствующая мочекаменная болезнь (рис. 2).
Основная часть работ по уролитиазу посвящена или совершенствованию хирургических методик удаления, или деструкции конкремента [18–22], или метафилактике этого заболевания после оперативного пособия [23–25]. Помимо уже упомянутого выше влияния патогенной микрофлоры на формирование мочевых камней была отмечена роль аномалий развития почек и нарушение метаболизма как предпосылок к развитию мочекаменной болезни [26, 27]. Считается, что мужской пол, ожирение и возраст моложе 75 лет служат независимым фактором риска уролитиаза [28]. В настоящее время изучены генетические аспекты мочекаменной болезни, поскольку был обнаружен риск наследственной предрасположенности к этому заболеванию [29]. Так как мочекаменная болезнь и нефротуберкулез в силу схожести рентгенологической картины стоят в одном дифференциально-диагностическом ряду, следует иметь высокий уровень настороженности в отношении туберкулеза при обследовании всех пациентов с конкрементами мочевыводящей системы.
Заключение. В нашем исследовании частота сочетанного заболевания мочекаменной болезнью и урогенитальным туберкулезом была невысокой, однако коморбидность существенно осложняла течение и ухудшала прогноз нефротуберкулеза.
Противотуберкулезная полихимиотерапия создает дополнительные предпосылки к формированию конкрементов в мочевыводящих путях; вопросы профилактики требуют дальнейшего изучения. Поскольку противотуберкулезная терапия создает дополнительные предпосылки к формированию конкрементов в мочевыводящих путях, необходим комплекс мер, направленный на устранение/компенсацию этих факторов. Однако в настоящее время этот комплекс еще не разработан, это задача следующего этапа нашего исследования.



