Введение. Проблема репродуктивного здоровья нации – один из факторов национальной безопасности государства. Неблагополучие репродуктивного здоровья одного из родителей делает невозможным зачатие ребенка. На основании исследований массы центров, специализирующихся в области репродуктивной медицины, выявлено, что доля мужчин, испытывающих трудности с зачатием ребенка, достигает 30%. Существуют различные гипотезы, объясняющие снижение мужской фертильности. По мнению ряда авторов, инфекционные агенты являются одной из ведущих причин, обусловливающих нарушение репродуктивного здоровья мужчин [1, 2]. Регулярно обсуждается вопрос о влиянии факторов внешней среды на репродуктивное здоровье, и если факторы радиационного риска изучены достаточно полно за исключением «эффекта свидетеля», то влияние ксеноэстрогенов, пестицидов и тяжелых металлов на фертильность мужского населения остается предметом интенсивного изучения. Так, экзогенные эстрогены нарушают не только пренатальное развитие тестикул, но и их постнатальное развитие, и процесс сперматогенеза [3]. Наряду с ксеноэстрогенами пестициды являются веществами, повреждающими гормональные механизмы регуляции сперматогенеза [4]. Достаточно полно изучено токсическое влияние тяжелых металлов на клетки сперматогенеза [5]. Предполагается, что образ жизни и аддикции также влияют на репродуктивное здоровье. Так, измерение уровня кадмия в семинальной плазме выявило, что этот вид тяжелого металла достоверно повышен у курильщиков [6].
Как следует из приведенных примеров, существует мириада факторов, потенциально обладающих повреждающим эффектом как на процесс сперматогенеза, так и на спермиогенез. При этом повреждающее воздействие может отразиться как на функциональных особенностях сперматозоидов (прежде всего подвижность), так и на их морфологической характеристике. К настоящему времени удалось стандартизировать морфологическую оценку сперматозоидов, что выразилось в разработке так называемого строгого критерия [7]. Это позволило не только стандартизировать морфологические исследования спермиев, но и выработать информативные критерии и коэффициенты (например, индекс тератозооспермии), позволяющие достаточно точно оценить репродуктивное здоровье мужчин в связи со структурными особенностями сперматозоидов. Вместе с тем по-прежнему противоречивы данные относительно индекса тератозооспермии и других параметров, отражающих качество семени [8]. Поэтому цель данного исследования – оценить морфофункциональную характеристику сперматозоидов и стабильность ДНК у пациентов с нормальными показателями семени и с ИТЗ, превышающим пороговое значение.
Пациенты и методы исследования
За период с 2017 по 2019 г. обследованы 85 пациентов на предмет репродуктивного здоровья (по поводу не наступающего в течение года зачатия), средний возраст которых на момент исследования составлял 32 года. Период абстиненции, что определялось при собеседовании, был не менее 3 сут. и в среднем сдача эякулята осуществлялась на 4-е сутки. Материал собирался в стерильные сухие прозрачные контейнеры естественным способом и сразу же направлялся для исследования в лабораторию. Контейнер помещался при 37°С. Согласно рутинной процедуре исследования, регистрировались не только структурно-функциональные характеристики сперматозоидов, но и физико-химические параметры: время разжижения, вязкость, рН и т.д. [1, 9]. По подвижности сперматозоиды делились на три класса: активноподвижные (со скоростью более 16 мкм/c), малоподвижные (со скоростью менее 16 мкм/с) и неподвижные. Концентрацию сперматозоидов определяли в камере Горяева (спермии с отсутствием хвоста в подсчет не входили). Обездвиживание и разведение сперматозоидов осуществлялось раствором Барбагалло. Для исследования морфологии спермиев приготавливали препараты на предметных стеклах, которые высушивали при комнатной температуре, фиксировали в абсолютном спирте в течение 10 мин и окрашивали по Романовского–Гимза. Анализ препаратов проводили под иммерсионным объективом в проходящем свете при увеличении 1000 на микроскопе Leica DM4000B. Для количественного анализа морфологии сперматозоидов также использовалась программа «Видеотест–Морфология». На предмет морфологических аномалий анализировали не менее 200 клеток. Каждый сперматозоид исследовался на аномалию головки, средней части (шейки) и хвоста согласно общепризнанным морфологическим критериям [10]. На основе полученных данных рассчитывали индекс тератозооспермии (ИТЗ), который варьируется от 1 до 3, но в норме должен быть меньше 1,6 (N<1,6). Всем пациентам, ИТЗ которых на основе морфологического исследования полученного материала превышал норму, ставилась тератозооспермия.
Для ответа на вопрос, отличается ли сперматозоиды пациентов в норме и при ИТЗ, превышающем пороговые значения, по стабильности ДНК был проведен микро-электрофорез ДНК одиночных (сперматозоидов) клеток (МФК), согласно методу, предложенному ранее [11]. Для выявления ДНК сперматозоидов проводили окрашивание серебром. В препаратах, окрашенных нитратом серебра, анализировали не менее 150 клеток. Статистический анализ проводили посредством t-критерия Стъюдента.
Результаты и обсуждение. Морфологический анализ показывает, что у каждого обследуемого в исследуемом материале (эякуляте) можно выявить сперматозоиды с морфологическими аномалиями. У одного пациента частота клеток с глобозооспермией достигала 34%. Однако ни в одном из исследуемых случаев глобозооспермия не была тотальной. Наиболее выразительной аномалией являются случаи выявления сперматозоидов, несущих две головки.
К аномалии средней части несомненно можно отнести увеличение размера цитоплазматической капли. По-видимому, отхождение хвоста от головки сперматозоида под острым углом, которое напоминает «излом», не артефакт, а истинная аномалия средней части. К аномалии хвоста, по-видимому, можно отнести случаи выявления сперматозоидов, у которых хвост «закручен» к головке. То есть можно говорить об аномалии «хвост к головке». Иногда она принимает причудливые формы и напоминает «капюшон кобры». На основе проанализированных аномалий у всех 85 пациентов был рассчитан индекс тератозооспермии (ИТЗ), который позволил разделить выборку пациентов на две группы. Так, у 11 обследованных ИТЗ в среднем составил 1,807±0,090, что превысило пороговое значение индекса 1,6. На этом основании у обследованных мужчин была верифицирована тератозооспермия. У 74 из 85 обследованных в среднем ИТЗ составил 1,243±0,017, что укладывается в норму. Частота активноподвижных спермиев в группе обследованных, у которых частота морфологически измененных сперматозоидов находится в пределах нормы (ИТЗ<1,6), в среднем составила 56,34±2,84%, тогда как в группе с ИТЗ более 1,6 средняя частота активноподвижных форм не превышала 31,1±4,21% (р<0,01). Следует отметить, что среди 74 мужчин, у которых ИТЗ<1,6, были выявлены 42, у которых была верифицирована астенозооспермия. Исследование этой подгруппы на предмет ИТЗ показало, что в выделенной по подвижности спермиев выборке средний показатель по индексу тератозооспермии составил 1,262±0,023, т.е. находится в пределах нормы. Исследование количества сперматозоидов в эякуляте показало, что средняя концентрация (млн/мл) спермиев во всей выборке у 85 обследованных составила 77,92±5,95. При этом исследование количества сперматозоидов в эякуляте пациентов, у которых ИТЗ был в норме (N<1,6) или выше порогового значения (N>1,6), не выявило достоверных значений между этими группами пациентов. Считается общепризнанным, что повышенная частота морфологических аномалий сперматозоидов непосредственно влияет на мужскую фертильность [10, 12]. Полученные нами результаты указывают, что повышение ИТЗ выше порогового значения всегда ассоциировано со снижением подвижности сперматозоидов. Однако обратное не является закономерностью: нами была выявлена подгруппа из 42 пациентов, у которых в эякуляте достоверно выявлялась повышенная частота спермиев со сниженной подвижность, но ИТЗ был ниже порогового значения (N<1,6).
При проведении микроэлектрофореза ДНК одиночных сперматозоидов у пациентов с ИТЗ, превышающим пороговые значения, было выявлено (см. рисунок), что частота спермиев с нестабильным геномом составила 39,6±7,4%, тогда как у пациентов с ИТЗ в пределах нормы данный показатель составил 3,1±0,6% (p<0,01).
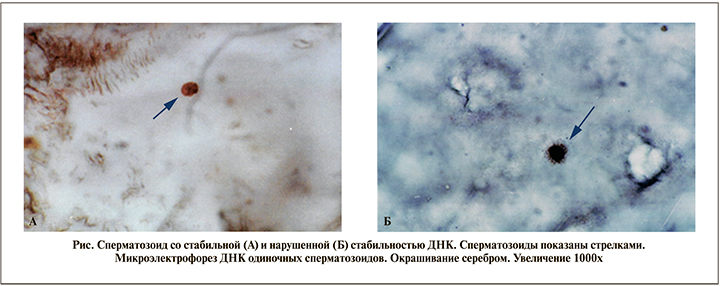
Выводы. Полученные нами результаты позволяют предположить, что незначительные морфологические изменения сперматозоидов не влияют на их подвижность, тогда как значимые морфологические аномалии с ИТЗ, превышающим пороговые значения, тесно ассоциированы с нарушением стабильности ДНК и драматически снижают качество семени пациентов.
Заключение. При первичной оценке фертильности пациентов следует ориентироваться главным образом на комплексное исследование морфологии и стабильности ДНК сперматозоидов.



