Диагностика рака предстательной железы (РПЖ) остается одной из наиболее актуальных областей исследований в современной урологии.
До сих пор биохимический скрининг на РПЖ основывается на оценке уровня простатического специфического антигена (ПСА) крови. Вследствие того, что используемый во всем мире анализ крови на ПСА в большей степени специфичен для определения непосрежственно факта наличия заболевания в простате, а не конкретно РПЖ, поиск новых маркеров РПЖ служит одним из приоритетных направлений развития урологии.
Скрининг и ранняя диагностика РПЖ, контроль прогрессиррвания опухоли и ее рецидивирования нуждаются в более точных, чем ПСА, онкоспецифических маркерах. Результаты исследований последних двух десятилетий, посвященных поиску новых маркеров РПЖ, позволили выделить несколько перспективных соединений, требующих подробного изучения. В настоящей статье приведены как уже используемые маркеры РПЖ, так и те, которые, на наш взгляд, имеют потенциал широкого использования в качестве дополнительных показателей активности РПЖ. Кроме того, представлена новая методика определения ангиотензинпревращающего фермента (АПФ), вырабатываемого тканью предстательной железы, которая может позволить использовать АПФ человека как новый дополнительный маркер РПЖ.
Для преодоления проблем специфичности ПСА была предложена модификация его исследования. Одним из первых вариантов было определение скорости изменения концентрации ПСА или скорости удвоения значений ПСА: нарастание концентрации антигена более чем на 0,75 нг/мл/год предположительно свидетельствовало о злокачественном онкологическом процессе, однако крупные когортные исследования не выявили диагностической ценности этих модификаций [1]. В попытках снизить влияние размеров органа на значение уровня ПСА предлагался показатель плотности ПСА (отношение концентрации ПСА к объему простаты – PSAD), показавший более высокую чувствительность по сравнению с традиционным измерением ПСА (верхняя граница референсных значений – 0,15 нг/мл/см3). Расширением этой методики стало определение плотности ПСА переходной зоны (отношение концентрации ПСА к объему переходной зоны простаты – TZPSAD) как основного продуцента антигена в органе при ДГПЖ [2]. Предполагалось, что это увеличит диагностические возможности метода в дифференцировании РПЖ и ДГПЖ [3], однако другие исследования не выявили его значимого преимущества перед обычным исследованием плотности ПСА [4]. Одна работа выявила преимущество TZPSAD над PSAD в диапазоне значений ПСА 10,1–20 нг/мл [5].
Сегодня продолжается поиск новых молекулярных маркеров РПЖ, в некоторых за основу взят ПСА. До 2011 г. наиболее применимой модификацией ПСА-теста стало определение отношения свободного ПСА (свобПСА) к общему ПСА (общПСА). Было показано, что для пациентов с РПЖ характерны увеличение доли ПСА, связанного с белками сыворотки крови, и сопутствующее уменьшение отношения свобПСА/общПСА (далее%свобПСА). При значениях свобПСА <14,7854% чувствительность метода достигала 89,29%, специфичность – 54,29%; при значениях связПСА >89,7796% чувствительность метода составляла 71,43%, специфичность – 71,43% [6]. Пороговым значением %свобПСА при выявлении РПЖ считается 15%, при более низких значениях вероятность обнаружения РПЖ возрастает до 71% [7]. Однако сравнительно низкая специфичность показателя %свобПСА (18% при общПСА 4–10 нг/мл и 6% при общПСА 2–4 нг/мл [11]) обусловила необходимость более надежных маркеров, способных предсказать наличие РПЖ в биоптате при общПСА 2–10 нг/мл. В качестве решения были предложены [-2]проПСА (изоформа ПСА, далее п2ПСА) и индекс здоровья простаты (п2ПСА/свобПСА ∙ √общПСА – PHI), позволяющие на их основе с приемлемой достоверностью выявлять РПЖ, дифференцировать его от ДГПЖ, а также различать высокоагрессивные (сумма Глисона >7) формы РПЖ от менее агрессивных (сумма Глисона <7). При 90%-ной специфичности %п2ПСА (п2ПСА/общПСА) и PHI обеспечивали чувствительность в 38,8 и 42,9% соответственно. Увеличение чувствительности влекло за собой падение специфичности метода [8]. Хотя %п2ПСА и PHI дают лучшее из доступных ныне соотношений специфичность/чувствительность в выявлении РПЖ и предсказании его злокачественности, это соотношение трудно назвать идеальным.
PCA3
Отходя от идеи применения ПСА и его производных в качестве предикторов РПЖ, ряд авторов предлагают использовать иные соединения в качестве маркеров этого заболевания. Одно из них – продукт гена Prostate Cancer Antigen 3 (PCA3, антиген рака простаты 3). Это матричная РНК, уровень которой в клетках, подвергнутых раковому перерождению, в 60 раз выше, чем в клетках нормальной или гиперплазированной простаты [9]. Ген PCA3 расположен на 9-й хромосоме в районе 9q21-22, имеет размер 25 тыс. пар нуклеотидов. В состав гена входят четыре экзона, содержащих 7 сайтов полиаденилирования. На сегодня известно несколько альтернативных изоформ зрелой РНК, транскрибируемой на основе гена PCA3, в большинстве из них отсутствует экзон 2. Чаще всего экспрессируются изоформы, содержащие экзоны 1, 3 и 4a или 4b. Зрелая РНК PCA3 имеет несколько открытых рамок считывания и множество стоп-кодонов. Известно, что ген PCA3 расположен в 6-м интроне другого гена BMCC1/PRUNE2, который транскрибируется в обратном по отношению к PCA3 направлении. Ген BMCC1/PRUNE2 кодирует белок, участвующий в регуляции пролиферации, апоптоза и опухолевого перерождения клеток простаты. Группой ученых во главе с Clarke показано, что экспрессия ВМСС1 увеличена в озлокачествленных клетках простаты, а обработка клеток аденокарциномы человека дигидротестостероном повышает экспрессию ВМСС1 и РСА3 [10]. Однако M. Salagierski et al. не нашли изменения экспрессии BMCC1 при РПЖ и наблюдали подавление экспрессии ВМСС1 на фоне обработки клеток аденокарциномы человека дигидротестостероном [11]. Тем не менее оба коллектива полагают, что PCA3 может участвовать в регуляции экспрессии BMCC1 через регуляцию локальной структуры хроматина, контроль сплайсинга мРНК ВМСС1 или благодаря другим механизмам [12]. Таким образом, функция PCA3 пока окончательно не выяснена. M. J. Bussemakers et al. [10] показали, что РНК ПСА3 может присутствовать в моче и эякуляте больных РПЖ. Исследования клинической применимости анализа клеточного осадка мочи на РСА3 показали, что метод обладает чувствительностью 66–67% и специфичностью 83–89% [13]. На данный момент существует три поколения тест-систем для количественного анализа содержания продукта гена PCA3 в моче или ее клеточном осадке. Системы третьего поколения позволяют выявлять РНК РСА3 в нативном образце мочи без предварительного осаждения клеток. Пороговым значением для предположения РПЖ установлен уровень экспрессии ≥35, соответствующий оптимальному соотношению чувствительности и специфичности метода [14].
ADAM15
Другим возможным маркером считают ADAM15 (A Disintegrin and Metalloproteinase 15, дизентегрин и металлопротеиназы доменсодержащий белок 15). ADAM15 – один из более чем 20 членов семейства мультидоменных трансмембранных гликопротеинов 1-го типа, функционирующих в качестве цинкзависимых эндопептидаз [15]. ADAM15 участвует в протеолитической обработке цитокинов, факторов роста и молекул адгезии, провоцирует развитие опухолей желудка [16], легких [17], толстой кишки [18] и меланомы [19]. Считается, что онкогенное действие ADAM15 связано с нарушением межклеточных [20] и клеточно-матриксных связей [21], а также высвобождением мембранассоциированных факторов роста [22]. Многоцентровое клиническое исследование, в котором был проведен анализ 9826 образцов РПЖ, выявило, что присутствие в ткани маркера ADAM15 характерно для небольшой доли РПЖ особенно высокой злокачественности. Наличие ADAM15 выраженно коррелирует с патологоанатомической степенью злокачественности, высоким числом Глисона и метастазированием в лимфоузлы [23]. Однако этот маркер трудно обнаружить в физиологических жидкостях организма, поэтому его использование в рутинной практике представляется нецелесообразным.
EPCA
Потенциальным ранним маркером РПЖ может служить ранний антиген РПЖ (early prostate cancer antigen – EPCA). EPCA – белок ядерного матрикса. Патоморфологические исследования обнаружили, что интенсивность иммуногистохимического окрашивания на EPCA значимо больше у пациентов с РПЖ с чувствительностью 84% и специфичностью 85% [24]. Было показано, что у мужчин, в чьих биоптатах простаты не было признаков рака, но присутствовал EPCA, был диагностирован РПЖ в течение 5 лет и более [25]. Изменения в белках ядерного матрикса могут быть одним из первых этапов канцерогенеза. B. Paul et al. [26] показали, что среди пациентов с различными опухолями, спинальной травмой, РПЖ и здоровых добровольцев EPCA повышен только у пациентов с РПЖ, чувствительность и специфичность метода составили 92 и 94% соответственно. Новейшие исследования показали, что чувствительность и специфичность EPCA-2 в сыворотке крови составили 94 и 92% соответственно, более того, это исследование позволило различить локализованный и метастатический РПЖ [27]. Вероятно, EPCA предсказывает микроскопические изменения в простате, а потому позволяет обнаруживать ранние признаки рака. Однако, несмотря на имеющиеся успехи, требуется дальнейшее изучение его роли в развитии заболевания.
Слияние генов TMPRSS2 и ETS
Активно исследуется роль генетических аномалий, свидетельствующих о раковых изменениях в простате. Одной из таких аномалий считается слияние генов TMPRSS2 и ETS (далее TMPRSS2:ETS). TMPRSS2 кодирует андрогензависимую трансмембранную сериновую протеазу, а ETS – транскрипционный фактор, регулирующий канцерогенные процессы в клетке – деление, преобразование и дифференцировку. Многочисленные исследования обнаружили связь между слиянием гена TMPRSS2 и генов семейства ETS (например, ERG, ETV1, ETV4, ETV5) и РПЖ [36]. Слияние этих генов делает возможной активацию генов ETS под действием активаторов гена TMPRSS2, запуская таким образом раковый процесс в клетках простаты. Последние исследования выявили TMPRSS2:ETS более чем 50% локализованных РПЖ на ранней и средней стадиях, а также гормоннезависимых метастатических РПЖ. В то же время во внутриэпителиальной неоплазии предстательной железы (prostatic intraepithelial neoplasia – PIN) TMPRSS2:ETS выявлено не было [28]. Чувствительность, специфичность, отрицательная и положительная прогностическая значимости анализа на TMPRSS2:ETS составили 37, 93, 36 и 94% соответственно [29]. Это позволяет говорить о перспективности поиска признаков этой мутации в моче, однако предполагаемая прогностическая ценность данного исследования требует дополнительной оценки.
AMACR
Другим генетическим маркером могла бы служить альфа-метилацил-КоА рацемаза (alpha-methylacyl-CoA racemase – AMACR). AMACR – фермент, участвующий в β-окислении разветвленных жирных кислот и превращении R-изомеров жирных кислот в L-изомеры, продукт гена P504S. Для типичной аденокарциномы предстательной железы чувствительность иммуногистохимического окрашивания на P504S/AMACR составила 80–100% [30]. Отмечено, что при ПСА в диапазоне 4–10 нг/мл увеличение концентрации анти-AMACR антител может стать ключом к различению здоровых мужчин от больных РПЖ. В таком случае диагностическая чувствительность и специфичность метода составили 62 и 72% соответственно [31]. Главным ограничением теста на AMACR является продукция искомого фермента как здоровыми, так и малигнизированными клетками, что сводит специфичность исследования к нулю.
GOLPH2
Изменения во внутриклеточных структурах также могут свидетельствовать о РПЖ. Фосфопротеин Гольджи 2 (Golgi phosphoprotein 2 – GOLPH2), также известный как GOLM1 или GP73, – мембранный белок комплекса Гольджи 2-го типа. Уже проведенные исследования выявили увеличение экспрессии мРНК GOLPH2 в тканях РПЖ [32]. Так как белки и липиды, синтезированные в эндоплазматическом ретикулуме, могут подвергаться модификации комплексом Гольджи перед экскрецией и встраиванием в цитолемму, изменения в его активности могут влиять на структуру этих молекул. Исследования показали, что экспрессия GOLPH2 в тканях РПЖ значительно превышает (р<0,001) таковую в нормальных клетках простаты. Экспрессия GOLPH2 была увеличена в 567 из 614 образцов РПЖ, при этом в 26 из 31 AMACR-негативных образцов РПЖ [33].
GSTP1
Окислительный стресс – важный компонент канцерогенеза. В норме электрофильные канцерогены инактивируются глутатионом под воздействием ферментов семейства глутатион-s-трансфераз. Экспрессия одного из таких ферментов, глутатион-s-трансферазы-1 (далее GSTP1), зависит от активности гена GSTP1, который может быть инактивирован метилированием. Проведенные исследования показывают, что в клетках РПЖ часто отсутствует активность GSTP1. Используя специфичную к метилированию ПЦР, можно обнаружить метилированный CpG- участок на 5-терминальном конце гена GSTP1. Причем подобная модификация ДНК может быть обнаружена в простате и физиологических жидкостях пациентов при PIN и РПЖ, но не ДГПЖ [34]. Последние исследования подтверждают способность анализа на метилирование гена GSTP1 дифференцировать РПЖ от ДГПЖ [35]. Хотя отключение гена GSTP1 способно приводить к раковому перерождению клеток простаты, оно же может быть причиной увеличения чувствительности измененных клеток к химиотерапии и как следствие – улучшения прогноза.
Продукты измененного метаболизма
Изменения метаболизма опухолевых клеток наталкивают на мысль о том, что в крови больных РПЖ могут присутствовать какие-то аномальные вещества, не характерные для здоровых мужчин. Группа под руководством P. Derezinski в пилотном исследовании на ограниченной группе испытуемых анализировала аминокислотный профиль мочи и плазмы крови у больных РПЖ, затем сравнивая его с соответствующими показателями здоровых добровольцев. Было выявлено, что в сыворотке больных РПЖ снижена концентрация метионина и повышены концентрации саркозина (непротеиногенной аминокислоты), β-аланина и аспарагиновой кислоты. В моче больных РПЖ выявлено увеличение концентрации таурина и снижение концентраций γ-амино-n-масляной кислоты, фосфоэтаноамина, этаноламина, гомоцитруллина, аргинина, аспарагина, цистатионина и метионина [36]. К сожалению, малый объем выборки не позволяет однозначно опираться на эти сведения при постановке диагноза. Более того, указанные в статье аминокислоты могут также служить маркерами других заболеваний, не связанных с РПЖ, при которых это исследование не проводилось.
PAGE4
Новой группой маркеров РПЖ считают тестикулярно-раковые антигены, которые в норме экспрессируются в яичках, но выявляются и в некоторых типах рака. Предварительные исследования показывают, что белок PAGE4 (простатассоциированного гена 4) обнаруживается в сыворотке крови при РПЖ [37]. И хотя авторы оценивали PAGE4 в качестве биомаркера, разделяющего симптоматическую и бессимптомную ДГПЖ, он потенциально может разграничивать случаи РПЖ от нормы и таким образом заменять собой ПСА. Возможно, он позволит дифференцировать «доброкачественный» (локализованный/андрогензависимый) и «злокачественный» (метастатический/андрогеннезависимый) РПЖ. Требуются дальнейшие исследования роли этого маркера в развитии РПЖ [38].
PSMA
Текущие исследования, посвященные изучению простатспецифического мембранного антигена (prostate-specific membrane antigen – PSMA), в основном рассматривают его как терапевтическую мишень для анти-PSMA дендритных клеток и анти-PSMA антител, несущих на себе радиоактивные изотопы и токсины. Изучение же антигена простатических стволовых клеток (prostatic stem cell antigen – PSCA) в основном базируется на его связи с факторами риска РПЖ, высокими значениями суммы Глисона, частоты метастазирования и терапевтическими задачами. Остается неизвестным, могут ли эти молекулярные структуры стать частью диагностики и лечения РПЖ.
К другим перспективным маркерам относятся пептидаза, родственная каллекреину 2 (kallikrein related peptidase 2 – KLK2), урокиназный активатор плазминогена и его рецептор (uPA and uPAR), гепсин, аннексин А3 (ANAXA3), инсулиноподобный фактор роста и связывающие его белки (IGFs и IGFBPs), трансформирующий фактор роста β, простатический секреторный белок 94 (prostate secretory protein 94 – PSP94) и богатый цистеином секреторный белок 3 (cysteine rich secretory protein 3, CRISP3) [23].
4k-Панель
Было обнаружено, что метод, учитывающий данные о калликреиновом профиле наряду с концентрацией ПСА, имеет большую чувствительность и специфичность для выявления рака предстательной железы, чем изолированный анализ ПСА. Комбинирование данных о калликреиновом профиле пациента и уровне ПСА повышает чувствительность и специфичность выявления РПЖ. В рамках множества исследований показано, что комбинация 4 калликреинов (общПСА, свобПСА, одноцепочечный iPSA, and hK2) сыворотки, 4k-панель, имеет большую предсказательную силу в обнаружении видимого на биопсии РПЖ по сравнению с изолированным анализом ПСА. Определение свободного и общего ПСА сейчас широко доступно, однако обнаружение и измерение iPSA и hK2 требуют особых лабораторных методик, пока не доступных повсеместно.
Согласно данным обзора G. I. Russo et al. [39], чувствительность 4k-панели в диагностике РПЖ (вне зависимости от стадии) составила 0,74 (95% ДИ – 0,726–0,76), специфичность – 0,60 (95% ДИ– 0,59–0,61). При этом негативный предиктивный потенциал колебался от 0,28 до 0,64, положительный – от 0,59 до 0,92. Диагностическое соотношение вероятностей (odds ratio) составило 4,62 (95% ДИ – 3,52–6,06).
По данным тех же авторов, для определения РПЖ высокой степени злокачественности чувствительность 4k-панели составила 0,87 (95% ДИ – 0,85–0,89), специфичность – 0,61 (95% ДИ – 0,60–0,62). При этом негативный предиктивный потенциал колебался от 0,08 до 0,43, положительный – от 0,95 до 0,99. Диагностическое соотношение вероятностей (odds ratio) составило 10,15 (95% ДИ – 8,06–12,79) [39].
МикроРНК
МикроРНК – небольшие эндогенные некодирующие молекулы, изменяющие экспрессию генов через посттранскрипционную регуляцию мРНК. Суммарные данные свидетельствуют о значимой роли микро-РНК и эволюции онкологических заболеваний, в частности РПЖ, и пророчат им высокий диагностический и прогностический потенциал в качестве биомаркеров. Этому способствует и то, что микро-РНК очень стабильны и легко обнаруживаются в любом биологическом материале (сыворотке, плазме, моче, слюне, семенной жидкости) с помощью тривиальной ПЦР в реальном времени. Согласно данным литературы, существует более 50 видов микро-РНК, участвующих в развитии онкологических заболеваний, которые принципиально делят на онкогенные микро-РНК (гиперэкспрессия вызывает заболевание) и микро-РНК-онкосупрессоры (уменьшение количества провоцирует развитие заболевания). К онкогенным микро-РНК относят андрогенрегулирующие, энхансеры клеточного цикла, молекулы кластера miR-17-92. К онкосупрессорным микро-РНК относят регуляторы эпителиально-мезенхимального перехода, регуляторы онкогенов, микро-РНК, влияющие на андрогенные рецепторы, влияющие на прогрессирование заболевания, микро-РНК семейства онкосупрессоров Let-7. Несмотря на проводимые обширные исследования в области выявления профилей микро-РНК, присущих конкретным новообразованиям, результаты пока противоречивы и требуют внимательного изучения на предмет использования этих молекул в качестве биомаркеров.
Несколько исследований показали, что экспрессия отдельных микро-РНК меняется при РПЖ. Так, синтез miR-205 и miR-214 уменьшен при РПЖ, в то время как экспрессия miR-21 намного выше при андрогеннезависимом РПЖ, чем при андрогензависимом. Концентрации циркулирующих miR-21, miR-141 и miR-221 чаще всего снижены у пациентов с РПЖ высокой степени злокачественности, метастазами РПЖ и РПЖ, устойчивым к кастрации.
Так как дифференциальная экспрессия микро-РНК коррелирует с развитием и прогрессированием РПЖ, измерение паттернов экспрессии микро-РНК, вероятно, позволит достоверно различать ДГПЖ, локализованную и метастатическую формы РПЖ [40].
Циркулирующие опухолевые клетки
Циркулирующие опухолевые клетки (ЦОК) и внеклеточная опухолевая ДНК (воДНК) в крови недавно стали объектом исследования в роли аватаров опухоли нового поколения. Ведутся проспективные исследования как для ЦОК, так и для воДНК.
Для анализа ЦОК требуется два ключевых этапа: обогащение среды и обнаружение. Техники обогащения основываются на размере и плотности клеток, их микротекучести и технологиях микрочипов. Единственная методика, на данный момент одобренная FDA, – CellSearch®. Альтернативные методы – проточная цитометрия, ПЦР с обратной транскриптазой, иммуноферментный анализ, AdnaTest и ЦОК-чипы – имеют как преимущества, так и ограничения. Оценка количества ЦОК с помощью CellSearch® при метастатическом устойчивом к кастрации РПЖ была валидирована в проспективном рандомизированном клиническом исследовании III фазы [41], тем не менее у этой системы остается несколько недостатков, требующих ее дальнейшего улучшения. При этом недавно было совершено несколько прорывов в обнаружении единичных клеток, единичной ЦОК РНК и мРНК, а анализ мРНК предоставляет важные прогностические сведения о потенциальной эффективности таких широко используемых химиотерапевтических средств, как абиратерон, энзалутамид и таксаны.
В то же время исследование воДНК потенциально может определить порядок назначения химиотерапевтических препаратов при метастатическом устойчивом к кастрации РПЖ. Ключевыми проблемами воДНК являются неопределенная кинетика и клиренс, а также низкая концентрация в крови и отсутствие стандартизированных методик их изоляции и обнаружения.
К сожалению, до сих пор ни ЦОК, ни воДНК не были внедрены в рутинную клиническую практику, однако ситуация может измениться с появлением на рынке новых платформ для обнаружения ЦОК и воДНК [42].
PTEN
Потеря функции онкосупрессора PTEN, приводящая к дизрегуляции фосфоинозитид-3-киназного сигнального пути, считается наиболее частым механизмом развития РПЖ. Обнаруженные механизмы потери функции PTEN разнообразны, но часто встречаются одно- и двуаллельные делеции, обусловливающие невозможность обнаружить белок-продукт с помощью иммуногистохимии. Встречаемость потери PTEN максимальна при агрессивном метастатическом РПЖ, что делает его перспективным маркером для обнаружения агрессивных форм заболевания. Обсуждается его использование с этой целью как самостоятельно, так и в комбинации с другими факторами в надежде достоверно различить опухоли с низким потенциалом злокачественности и образования с высоким риском прогрессирования [43].
АПФ
В качестве еще одного потенциального маркера РПЖ может быть рассмотрен АПФ.
Ангиотензинпревращающий фермент (кининаза 2) – Zn-зависимая С-концевая карбоксипептидаза с широким спектром субстратов (ангиотензин 1, брадикинин, N-ацетил-серил-аспартил-лизил-пролин (Ac-SDKP)). Она широко известна благодаря участию в регуляции артериального давления и водно-электролитного баланса, где ее субстратом является декапептид ангиотензин I, расщепляемый до октапептида ангиотензина II. Также АПФ играет важную роль в развитии ряда сердечно-сосудистых патологий, таких как ишемическая болезнь сердца, болезни, сопровождающиеся гипертрофией миокарда, сердечной недостаточностью. Кроме того, АПФ вовлечен в метаболизм нейропептидов, процессы иммунной системы и репродуктивной системы человеческого организма [44]. Данный фермент служит интегральным белком цитоплазматической мембраны, располагающимся на ее наружной поверхности [45].
 Большая часть молекулы АПФ локализуется экстрацеллюлярно на поверхности эндотелиальных клеток: специализированных эпителиальных клеток, находящихся в местах интенсивного всасывания и выделения воды и солей, нейроэпителиальных клеток на нервных окончаниях, клеток мононуклеарного ряда, а также эпителиальных клеток половой системы. Существует также и свободная (растворенная) форма АПФ, которая циркулирует в крови и присутствует практически во всех биологических жидкостях [46].
Большая часть молекулы АПФ локализуется экстрацеллюлярно на поверхности эндотелиальных клеток: специализированных эпителиальных клеток, находящихся в местах интенсивного всасывания и выделения воды и солей, нейроэпителиальных клеток на нервных окончаниях, клеток мононуклеарного ряда, а также эпителиальных клеток половой системы. Существует также и свободная (растворенная) форма АПФ, которая циркулирует в крови и присутствует практически во всех биологических жидкостях [46].
Ранее читалось, что преимущественная локализация АПФ – легкие, однако позднее было показано, что специфические изоформы встречаются и в других тканях [47], например в простате, семенных пузырьках и яичках. Соматическая (сАПФ) и тестикулярная (тАПФ) изоформы АПФ кодируются одним и тем же геном. Высокие уровни экспрессии сАПФ были обнаружены в эндотелии сосудов легких, а также эпителии кишечника, почек и мужского полового тракта; АПФ был присвоен статус CD-маркера – CD143 [48].
Хотя физиологическая функция АПФ в репродуктивных системах обоих полов еще не до конца ясна, существующие данные позволяют предположить, что тАПФ играет ключевую роль в мужской репродуктивной функции. Его можно обнаружить уже на постмейотических сперматидах 3-го порядка, по мере дальнейшей дифференцировки его концентрация возрастает. В то же время сАПФ выявляется на поверхности эпителиальных клеток придатка яичка, простаты и клеток Лейдига. Роль тАПФ в мужской репродуктивной функции активно исследуется, но имеющиеся сведения противоречивы. Опыты на хомяках не выявили снижения подвижности сперматозоидов при фармакологическом ингибировании АФП, но показали снижение связывания сперматозоидов с яйцеклетками, уменьшение акросомальной реакции. Недавно было обнаружено, что тАПФ отщепляет внеклеточные фрагменты белков TSP5 и PH-20, фиксированных на мембране гликозилфосфатидилинозитольным якорем и необходимых для оплодотворения. Другие исследования показали, что тАПФ также отвечает за передвижение сперматозоида по маточным трубам и капацитацию [49].
Хотя структура тАПФ (рис. 1) отличается от сАПФ (рис. 2), тестикулярная форма содержит те же 665 С-терминальных аминокислотных остатков сАПФ, а также 36 дополнительных обширно О-гликозилированных N-концевых остатков. Ввиду такой структуры роль тАПФ в оплодотворении может быть даже неферментативной природы. Благодаря гликозилированным остаткам тАПФ может служить сайтом связывания для иных, пока еще не известных субстратов женских половых путей.
Что касается растворенной формы АПФ, циркулирующей в физиологических жидкостях (кровь, семенная жидкость), то ее источником, вероятней всего, является эндотелий сосудов легких, с поверхности которого фермент срезается пока еще не идентифицированной АПФ-секретазой. Ангиотензинпревращающий фермент семенной жидкости скорее всего происходит из железистого эпителия придатка яичка и простаты, экспрессирующих значительные количества сАПФ.
Физиологическая функция этих АПФ еще до конца не ясна, предполагают участие в обеспечении подвижности сперматозоидов и пролиферации опухолевых клеток (через АТ1-рецепторы ангиотензина II) [50]. Примечательно, что концентрация АПФ в сперме до 50 раз выше, чем в крови, хотя уровень экспрессии значимо не отличается от такового в клетках эндотелия сосудов. Существует два объяснения этому явлению. Первое состоит в том, что в мужских половых путях больше соотношение поверхности АПФ-продуцирующего эпителия к объему проходящей по ним жидкости. С другой стороны, АПФ-продуцирующий эпителий мужских половых путей больше подвержен «слущиванию» фермента. Причин повышенного слущивания две: повышенная секреция АПФ-секретазы и аномальная конформация АПФ, обнажающая участок отщепления фермента от мембраны [51].
Многие авторы связывают концентрацию АПФ с прогрессированием РПЖ, отмечая, что при ДГПЖ уровень АПФ повышен, а при раке, напротив, снижен [56]. Другие отмечают увеличение транскрипции генов АПФ и рецепторов ангиотензина в клетках гормоннезависимого РПЖ. Отмечалось, что наличие у пациента изоформ фермента, содержащих делеции, также ассоциировано с высоким риском заболевания РПЖ [52]. Вариабельность АПФ еще связывают с различными участками гликозилирования фермента в легких и мужских половых путях. Гликозилирование по Asn9 характерно для спермоплазмы [53], по Asn480,666,685 – для плазмы крови [54].
Предстательная железа – это паренхиматозный орган, состоящий из двух основных элементов: железистого и мышечно-стромального. Функция предстательной железы осуществляется железистым эпителием. Учитывая полученные зарубежными коллегами данные об изменении концентрации АПФ при заболеваниях предстательной железы (ДГПЖ, РПЖ), можно предположить, что АПФ может являться еще одним потенциальным маркером РПЖ.
Учитывая разнообразие источников АПФ в человеческом организме, а также преимущественную выработку АПФ легочной тканью, возникает вопрос: отличить и детектировать АПФ, непосредственно продуцируемый предстательной железой?
Разные изоформы АПФ обладают различными антигенными свойствами, что потенциально позволяет различать их, используя специфические антитела.
Ангиотензинпревращающий фермент привлекает внимание исследователей и изучается в течение более 50 последних лет. В различных исследованиях биохимических особенностей АПФ велась научная работа по выявлению и подборке моноклональных антител к структурным и конформационным эпитопам АПФ человека. Было показано, что связывание некоторых антител очень чувствительно к тонким изменениям конформации АПФ, вызванным локальной денатурацией или инактивацией, связыванием ингибиторов, антител или некоторыми болезнями. У С. М. Данилова появилась возможность детектировать и локализовать мутации АПФ человек. Была сформулирована концепция конформационного фингерпринтинга АПФ с помощью моноклональных антител, что в свою очередь позволило доказать тканевую специфичность АПФ [55].
С. М. Данилов и соавт. [55] определили способность 17 антител к разным эпитопам функционального центра АПФ связываться с той или иной изоформой фермента. Были выведены графики, отражающие степень взаимодействия антитела с соответствующим эпитопом по отношению к таковой для АПФ в легких. На основании полученных данных выделено несколько моноклональных антител, позволяющих специфично выявлять простатический АПФ (рис. 3).
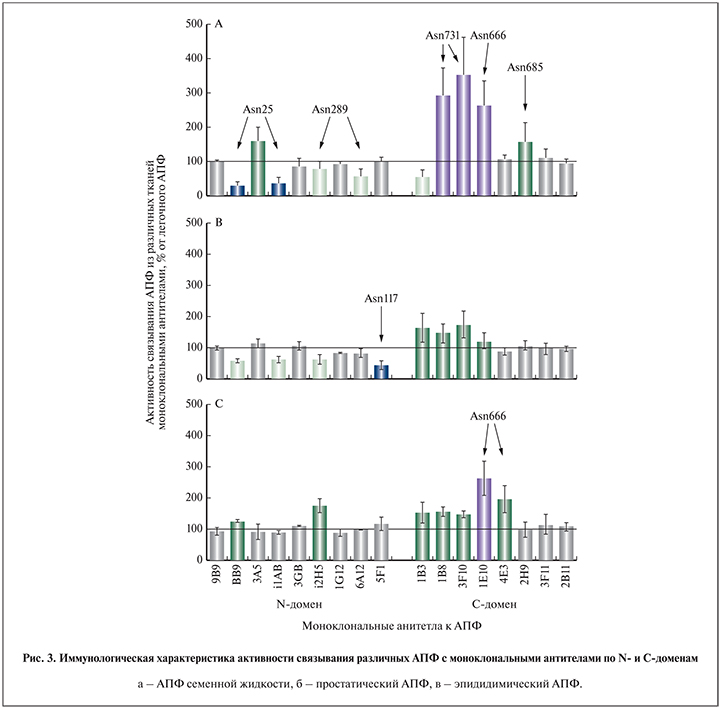
- BB9, i1A8, i2H5, 5F1 – связывается с Asn117 в простатическом АПФ значительно слабее, чем с легочным АПФ; 5F1 отличается наиболее слабым связыванием с простатическим АПФ;
- 1В8, 3F10, 1E10 – позволяют выявлять АПФ семенной жидкости (специфичность к АПФ простаты невысока, так как АПФ семенной жидкости вырабатывается яичками, семенными пузырьками и простатой).
Учитывая накопленные знания о том, что конформационные перестройки в молекуле АПФ могут провоцироваться наличием определенного заболевания в том органе, который является источником исследуемой изоформы АПФ, можно предположить, что в зависимости от характера патологии, которая имеет место в предстательной железе, при проведении биохимического анализа образцов ткани предстательной железы и плазмы крови пациентов будут определяться различные специфические и патогномоничные формы соответствующего АПФ.
С момента открытия ПСА в конце 1980-х гг. диагностика и лечение заболеваний предстательной железы, в частности рака и доброкачественной гиперплазии, достигли больших высот. Это позволяет сегодня с большим успехом вовремя диагностировать то или иное заболевание у урологических пациентов и вовремя предлагать необходимую схему лечения, являющуюся оптимальной в каждом конкретном наблюдении.
Тем не менее до сих пор остаются спорными моменты, не позволяющие в ряде случаев достоверно судить о характере гиперпластического процесса. В таких случаях единственным методом диагностики, позволяющим формировать дальнейшую тактику лечения, выступает биопсия предстательной железы. По результатам биопсии в ряде случаев приходится констатировать, что результаты инструментальной и лабораторной диагностики были ложноположительными. Таким образом, до сих пор остается актуальной проблема создания новых биохимических маркеров РПЖ для более точной постановки диагноза ДГПЖ или РПЖ.
В качестве потенциальных маркеров РПЖ рассматриваются различные микро- и макромолекулярные соединения, являющиеся внутриклеточными белками, внеклеточными белками ткани предстательной железы, соединения, являющиеся частью генетического материала ткани простаты.
Если рассматривать АПФ, вырабатываемый в предстательной железе как новый маркер РПЖ, то методика его определения должна обладать следующими качествами: высокая специфичность, достоверность, давать возможность оценить риск малигнизации процесса и сформировать наиболее правильную тактику ведения пациентов, находящихся в группе риска.
Исходя из вышесказанного, простатический АПФ может обладать необходимой специфичностью, чтобы использоваться в качестве нового маркера РПЖ при его выявлениях с использованием моноклональных антител. В случае обнадеживающих результатов потребуется создание тест-системы для рутинного определения концентрации АПФ в клинической практике и определение референсных диапазонов специфических изоформ АПФ.



