В России показатель заболеваемости раком мочевого пузыря (РМП) находится на третьем месте среди онкоурологических заболеваний после рака предстательной железы и рака почки. По данным систематического ежегодного анализа, заболеваемость РМП в России в 2016 г. составила 71,3 на 100 тыс. населения против 47,8 на 100 тыс. в 2006 г.
Удельный вес пациентов с диагнозом, подтвержденным морфологически, среди больных с впервые установленным диагнозом РМП на 2016 г. составил 92,4%, из них 46,7% приходится на рак стадии Т1 и 2,8% – на неустановленную стадию [1]. Летальность в течение первого года с момента постановки диагноза (из числа больных, впервые взятых на учет в предыдущем году) на 2016 г. составила 16,6%, в то время как в 2006 г. данный показатель был равен 23,1%. Своевременная диагностика, адекватное лечение и контроль за пациентом, которому проводится лечение по поводу РМП, – актуальные задачи современной урологии.
Уротелиальный РМП является гетерогенной группой заболеваний и подразделяется на мышечно-инвазивный (T2–T4) и немышечно-инвазивный, к которому относятся стадии Ta, T1 и Tis. На долю немышечно-инвазивного рака приходится около 75% случаев [2]. «Золотым» стандартом в верификации диагноза и лечении немышечно-инвазивного РМП является цистоскопия с проведением трансуретральной (ТУР) стенки мочевого пузыря (МП) с опухолью, а также биопсия подозрительных участков слизистой МП, с дальнейшим гистологическим исследованием полученного материала [3].
Основные цели ТУР МП: удаление видимой патологически измененной ткани МП, определение гистологического типа опухоли, оценка глубины инвазии и степени злокачественности [4]. Несмотря на постоянное совершенствование технологического обеспечения, наличие возможностей наиболее достоверной верификации диагноза и не прекращаемые поиски новых методов визуализации опухоли МП на самых ранних стадиях, частота рецидива после проведения стандартной ТУР остается достаточно высокой [5, 6]. Высокая вероятность рецидивирования опухоли после первичной ТУР, отсутствие мышечного слоя в гистологических образцах при проведении резекции не в полном объеме, а также выявление низкодифференцированной опухоли требуют проведения повторной ТУР МП [3]. Так, согласно исследованию D. A. Lazica et al. [7], частота развития рецидива опухоли после первичной ТУР, диагностируемого при повторной ТУР МП, составляет 41,4%, причем cреди женщин, несмотря на более низкую заболеваемость, чем среди мужчин, риск рецидивирования опухоли выше [8]. Данный факт можно связать с несоответствием стандартной ТУР МП как полноценной самостоятельной операции, критериями радикальности в подходах к лечению онкологических заболеваний. В том числе из-за вероятности опухолевой имплантации при обсеменении МП и уретры опухолевыми клетками при фрагментации опухоли в ходе проведения стандартной ТУР [9, 10]. Невозможность проведения резекции в полном объеме из-за большого размера опухоли, неудобного ее расположения, а также при недостаточном опыте хирурга и боязни осложнений в виде перфорации стенки МП увеличивает риск оставления остаточной опухоли в зоне резекции [11]. Так, при повторной ТУР остаточная опухоль стадии рT1 выявляется в 25% случаев [12]. Кроме вышеперечисленного недостатком стандартной ТУР МП является нерепрезентативность гистологического материала, взятого в ходе резекции, в связи с чем патоморфолог не всегда может дать достоверное заключение [13–17]. Отсутствие мышечного слоя в препарате, термическое повреждение ткани в ходе ТУР и нарушение микроархитектоники ткани из-за фрагментации опухоли затрудняют оценку качества проведенной резекции, как следствие – постановку точного диагноза, что служит показанием к проведению повторной резекции [18–21]. Такие осложнения, как инфекция мочеполовых путей, встречающаяся в 23% случаев, перфорация стенки МП (5%) и кровотечение, требующее трансфузионной терапии (13%) [22], катетер-ассоциированная боль [23] и задержка мочеиспускания [24], увеличивают продолжительность нахождения пациента в стационаре, следовательно, увеличивают расходы ЛПУ [22]. Появление опухолевых клеток в общем кровотоке [25], стимуляция запирательного нерва при резекции МП и как следствие – неконтролируемая перфорация стенки МП с последующей экстравезикальной диссеминацией опухолевых клеток [26, 27] исключают радикальность проведенной операции [28]. Таким образом, ТУР МП является не только лечебным мероприятием, но и диагностической процедурой, а качество и полнота ее проведения прямо коррелируют с наличием периоперационных осложнений. Оптимизация методики резекции необходима как для предотвращения возможных осложнений, так и для увеличения показателя безрецидивной выживаемости пациентов и повышения их качества жизни.
 В поисках оптимального подхода к удалению опухоли, удовлетворяющего всем вышеизложенным требованиям, T. Kawada в 1997 г. описал новую методику резекции стенки МП с опухолью единым блоком (en-bloc) посредством нового арочного электрода, представляющего собой незамкнутую дугу (рис. 1).
В поисках оптимального подхода к удалению опухоли, удовлетворяющего всем вышеизложенным требованиям, T. Kawada в 1997 г. описал новую методику резекции стенки МП с опухолью единым блоком (en-bloc) посредством нового арочного электрода, представляющего собой незамкнутую дугу (рис. 1).
Техника предусматривала выполнение резекции стенки МП путем проведения электрода под основание опухоли. Одновременно осуществлена ротация электрода рукой на 180° таким образом, чтобы относительно опухоли выгнутая часть петли описывала дугу окружности по внешнему радиусу, а вогнутая – по внутреннему (рис. 2). Было отмечено более высокое качество гистологического материала из-за возможности визуализации интактного мышечного слоя в ходе резекции, а также меньшая вероятность интраоперационного кровотечения [17]. Недостаток данной техники в том, что она не может быть применена при более крупных опухолях и не всегда позволяет удалить ее с окружающей интактной тканью [15, 17].
В 2000 г. R. Ukai описал резекцию en-bloc, которая и легла в основу техники, используемой на данный момент в клинической практике. После нанесения вспомогательных точечных прижиганий на интактной слизистой на расстоянии 5–10 мм от основания опухоли осуществляется разрез, соединяющий эти точки, до момента визуализации поверхностного мышечного слоя МП (рис. 3 а, б). Далее опухоль постепенно отделяется за счет движений, производимых непосредственно в мышечном слое и направленных параллельно слизистой оболочке МП (рис. 3 в–д). В данном исследовании использован J-образный электрод, представляющий собой модифицированный петлевой электрод (рис. 4).
Опухоль извлекалась через резектоскоп с помощью биопсийных щипцов с дальнейшим патоморфологическим исследованием. Авторы отметили высокое качество гистологического материала с сохранением анатомической ориентации, что предоставляет патоморфологам возможность объективно оценить глубину инвазии опухоли [16], однако позднее отмечено неудобство данного электрода при работе в толще мышечной стенки из-за его маленького размера [15]. S. Saito в 2001 г. впервые описал резекцию стенки МП с опухолью единым блоком с использованием гольмиевого лазера, отметив удобство его применения при расположении новообразования в шейке МП, где опухоль малодоступна для монополярного электрода. Часть новообразований МП была удалена с помощью электроножа единым блоком. После отсечения опухоль со стенкой МП извлечена посредством петлевого электрода. Проведение дополнительной биопсии участков зоны резекции стенки МП позволило автору сделать выводы о радикальности выполненной операции и о высоком качестве гистологического материала для проведения патоморфологического исследования [15]. M. Lodde et al. опубликовали свой опыт резекции en-bloc-стенки МП с опухолью с применением стандартного плоского петлевого электрода (с возможностью его сгибания в случае необходимости), также сделав заключение о высоком качестве гистологического материала. Однако к недостаткам применения описанной техники авторы отнесли невозможность ее выполнения при расположении опухоли на передней стенке и/или на верхушке МП и при размере опухоли более 2,5 см. Кроме того, отмечена возможность перфорации стенки МП при применении электрода вышеописанной конфигурации [29]. Обобщая вышеизложенное, суть резекции en-bloc заключается в том, что опухоль удаляется единым конгломератом с окружающей ее основание интактной слизистой и подлежащим мышечным слоем [13, 14, 17, 30, 31]. Сама резекция происходит под контролем зрения в мышечном слое МП без разделения экзо-/эндофитной части опухоли, что обеспечивает попадание мышечного слоя в образец более чем в 95% случаев [32].
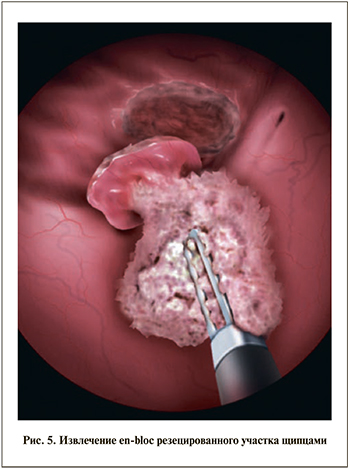
 В рекомендациях Европейского и Японского обществ урологов резекция en-bloc показана для опухолей менее 1 см в диаметре, в то время как Международный урологический консилиум допускает применение данной методики при опухолях размером до 3 см в диаметре [21, 33]. При резекции МП с опухолью более 3 см возникают трудности с дальнейшим удалением препарата через тубус резектоскопа [9]. R. Ukai et al. [34] описали «раздельную резекцию», когда опухоль, удаленная единым блоком, разделяется на две или более части для дальнейшего последовательного извлечения через тубус резектоскопа. Авторы акцентировали внимание на возможности сопоставления этих участков с сохранением изначальной анатомической ориентации перед фиксацией, что позволит морфологу объективно оценить степень инвазии. При этом были отмечены более низкое качество препаратов по сравнению с истинной резекцией en-bloc и более высокое по сравнению с традиционной ТУР. Данных о рецидивировании после «раздельной резекции» не представлено [34]. Описана методика удаления опухоли размером до 4,5 см, когда резецированный участок стенки захватывается щипцами и извлекается из МП с одновременной тракцией резектоскопа, при этом в процессе извлечения опухоль должна постоянно находиться под контролем зрения (рис. 5). Авторы отмечают возможность применения данного способа для извлечения папиллярных опухолей, в то время как с солидными образованиями могут возникать сложности. Не исключается вероятность имплантации опухолевых клеток при ее продвижении по уретре, данных о безрецидивной выживаемости не приводится [31].
В рекомендациях Европейского и Японского обществ урологов резекция en-bloc показана для опухолей менее 1 см в диаметре, в то время как Международный урологический консилиум допускает применение данной методики при опухолях размером до 3 см в диаметре [21, 33]. При резекции МП с опухолью более 3 см возникают трудности с дальнейшим удалением препарата через тубус резектоскопа [9]. R. Ukai et al. [34] описали «раздельную резекцию», когда опухоль, удаленная единым блоком, разделяется на две или более части для дальнейшего последовательного извлечения через тубус резектоскопа. Авторы акцентировали внимание на возможности сопоставления этих участков с сохранением изначальной анатомической ориентации перед фиксацией, что позволит морфологу объективно оценить степень инвазии. При этом были отмечены более низкое качество препаратов по сравнению с истинной резекцией en-bloc и более высокое по сравнению с традиционной ТУР. Данных о рецидивировании после «раздельной резекции» не представлено [34]. Описана методика удаления опухоли размером до 4,5 см, когда резецированный участок стенки захватывается щипцами и извлекается из МП с одновременной тракцией резектоскопа, при этом в процессе извлечения опухоль должна постоянно находиться под контролем зрения (рис. 5). Авторы отмечают возможность применения данного способа для извлечения папиллярных опухолей, в то время как с солидными образованиями могут возникать сложности. Не исключается вероятность имплантации опухолевых клеток при ее продвижении по уретре, данных о безрецидивной выживаемости не приводится [31].
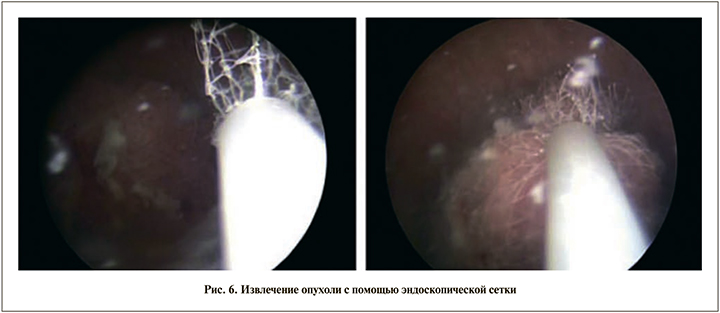
Описан метод извлечения опухоли с помощью эндоскопических захватывающих сеток (рис. 6), которые могут быть применены для опухолей небольшого размера [35].
 Удаление опухоли МП единым блоком может быть выполнено с применением различных методик: монополярной и биполярной резекции, резекции с применением водоструйного гибридного ножа, а также лазерной (гольмиевая, тулиевая и калий-титанил-фосфатная) резекции [36, 37]. Монополярная резекция по сравнению с биполярной чаще вызывает стимуляцию запирательного нерва, что сказывается на частоте перфораций стенки МП во время проведения операции [19]. M. Kramer et al. [32] провели мультицентровое исследование по сравнению резекции en-bloc с применением электрохирургии и лазеров. Авторы не выявили существенной разницы в идентификации мышечного слоя на препаратах при патоморфологическом исследовании, отрицательный хирургический край констатировали в обеих группах. В группе электрической резекции чаще регистрировали осложнения в виде кровотечения, однако послеоперационное снижение гемоглобина было незначительным, в той же группе был зарегистрирован один случай стимуляции запирательного нерва. Продолжительность операции и сроки госпитализации в группах не различались. Авторы отметили более высокую эффективность лазерной резекции при опухолях большого размера [32].
Удаление опухоли МП единым блоком может быть выполнено с применением различных методик: монополярной и биполярной резекции, резекции с применением водоструйного гибридного ножа, а также лазерной (гольмиевая, тулиевая и калий-титанил-фосфатная) резекции [36, 37]. Монополярная резекция по сравнению с биполярной чаще вызывает стимуляцию запирательного нерва, что сказывается на частоте перфораций стенки МП во время проведения операции [19]. M. Kramer et al. [32] провели мультицентровое исследование по сравнению резекции en-bloc с применением электрохирургии и лазеров. Авторы не выявили существенной разницы в идентификации мышечного слоя на препаратах при патоморфологическом исследовании, отрицательный хирургический край констатировали в обеих группах. В группе электрической резекции чаще регистрировали осложнения в виде кровотечения, однако послеоперационное снижение гемоглобина было незначительным, в той же группе был зарегистрирован один случай стимуляции запирательного нерва. Продолжительность операции и сроки госпитализации в группах не различались. Авторы отметили более высокую эффективность лазерной резекции при опухолях большого размера [32].
В другом проспективном исследовании, где сравнивались монополярная и гольмиевая резекциb en-bloc, также не было выявлено значительной разницы между группами. Однако при использовании монополярной резекции отмечено большее число осложнений, таких как стимуляция запирательного нерва и перфорация МП [38]. Основным преимуществом применения моно-/биполярных резектоскопов является их материальная доступность. Описан опыт одной клиники по применению гибридного ножа для резекции en-bloc, в котором отмечено высокое качество гистологических образцов [39]. На данный момент ведутся клинические исследования по применению этого метода в комбинации с флуоресцентным агентом [40]. В работе [41] представлены результаты эксперимента с удалением опухоли методом подслизистой эндоскопической диссекции с использованием ножа двойного действия после введения в мышечный слой МП раствора гиалуроновой кислоты (создание гидравлической подушки). Авторы сообщили о присутствии мышечного слоя в препаратах и об эффективности инъекций препарата гиалуроновой кислоты в качестве гемостатического агента; время безрецидивного выживания не исследовалось [41]. По мнению ряда авторов, применение лазерной резекции en-bloc позволяет достигать наилучших результатов за счет минимального термического повреждения тканей, что обеспечивает репрезентативность гистологического материала. Это также исключает вероятность раздражения запирательного нерва в ходе резекции и как следствие – снижает вероятность перфорации стенки МП, а также риск послеоперационных осложнений, таких как кровотечение и тампонада МП [30]. В исследовании [38] отмечается отсутствие симптомов раздражения МП после одноразовой инстилляции митомицина С в группе пациентов, которым проведена лазерная резекция en-bloc, в отличие от тех, кому была выполнена монополярная стандартная ТУР. R. Migliari et al. [42] опубликовали исследование, целью которого было сравнить монополярную электрорезекцию стенки МП и энуклеацию опухоли посредством тулиевого лазера с комбинацией волн (1940 +1470 нм).
При использовании лазера авторы отметили отсутствие таких осложнений, как кровотечение и неконтролируемая перфорация МП из-за стимуляции запирательного нерва, а также сокращение продолжительности послеоперационной катетеризации и сроки госпитализации по сравнению с группой электрорезекции. По результатам биопсии основания опухоли (спустя 90 дней), не было зарегистрировано ни одного случая рецидива в группе лазерной энуклеации в отличие от группы, в которой осуществлена монополярная резекция. Частота рецидивирования при последующих исследованиях была выше в группе электрорезекции, однако была отмечена гетерогенность полученных результатов. Авторы акцентируют внимание на удобстве и безопасности применения тулиевой резекции en-bloc при опухолях любой локализации, в том числе вблизи устья мочеточника, на боковых стенках и на верхушке МП [42].
Высокое качество гистологического материала из-за минимального повреждения резецируемых тканей при максимальной интраоперационной дифференцировке слоев МП говорит о перспективности применения тулиевого лазера для лечения немышечно-инвазивного РМП.
Z. Zhang et al. [43] описали свой опыт применения тулиевого лазера с длиной волны 1940 нм с режимом холодного резания для en-bloc-резекции МП с опухолью размером от 0,5 до 3 см. После резекции проведена биопсия зоны резекции и только в одном случае была обнаружена опухолевая ткань (стадия T2b), после чего пациенту была выполнена цистэктомия. Средний срок наблюдения за пациентами составил 21,8 мес., в течение которого проведены цистоскопия, цитологическое и радиологическое исследования. Частота развития рецидивов в течение года составила 21,6%. Авторы отмечают меньшее количество осложнений, более высокое качество гистологического материала и удобство использования тулиевого лазера [43].
Одним из основных преимуществ удаления опухоли МП en-bloc по сравнению со стандартной резекцией является сохранение как макроскопической ориентации всего опухолевого конгломерата, так и микроскопической архитектоники резецируемых образцов. При этом опухоль окружена интактной тканью на нижней поверхности (наличие детрузора в срезах) и на периферии опухоли (наличие неизмененного уротелия в срезах). За счет большого массива ткани минимизируется вероятность термического повреждения образцов, что дает возможность максимально адекватно верифицировать диагноз при гистологическом исследовании [14, 34, 44]. При резекции en-bloc соблюдается критерий полноты удаления опухоли, соответственно, увеличивается срок безрецидивной выживаемости. Благодаря этому уменьшается число повторных резекций, рекомендованных в отсутствие мышечного слоя в гистологическом препарате [45]. В конечном итоге это приводит к уменьшению расходов больницы на одного пациента и улучшению качества жизни пациента [9, 46].
В проспективном нерандомизированном исследовании [6] приводятся данные сравнения частоты рецидивов и случаев прогрессирования опухолей после стандартной ТУР и еn-bloc-резекции МП, где рецидивы встречались в 62,5 и 28,6% случаев соответственно, а частота прогрессирования составила 33,3 против 19% (со средним сроком наблюдения 30 и 40 мес.) соответственно. В другом проспективном одноцентровом исследовании при проведении повторной цистоскопии через 40 дней не было выявлено опухоли ни в одном из случаев после проведения резекции еn-bloc [47]. Молекулярные исследования показали, что в большинстве случаев мультифокальные опухоли уротелия моноклональные [48], чем объясняется необходимость соблюдения критерия радикальности резекции. При проведении стандартной резекции происходит фрагментация опухоли и как следствие – обсеменение раковыми клетками поверхности МП, в том числе раневой поверхности, что может служить причиной их имплантации с последующим развитием рецидива заболевания [25, 32]. Вышеописанный патогенез опухолевой инвазии исключается при удалении опухоли en-bloc с окружающими неизмененными тканями, что подтверждает клиническую значимость данного метода резекции МП. Для снижения вероятности развития рецидивов может быть применена адъювантная терапия [49]. Резекция en-bloc, как уже было сказано выше, минимизирует риск перфорации МП, что дает возможность немедленно вводить химиопрепарат. Мета-анализ данных рандомизированных клинических исследований показал, что немедленная после ТУР инстилляция химиопрепарата снижает риск развития рецидива при одиночных опухолях МП [50] низкого и промежуточного рисков [51, 52].
Заключение. Несмотря на достигнутые успехи в подходах к ведению пациентов с РМП, есть необходимость во внедрении новых методов как диагностики, так и лечения данной патологии. Еn-bloc-резекция МП позволяет объективно оценивать глубину инвазии опухоли, снижать количество периоперационных осложнений, уменьшать частоту развития рецидивов, а также сокращать сроки госпитализации пациента и повышать качество его жизни. Резекция en-bloc с применением лазерных технологий представляется наиболее перспективным методом лечения пациентов с немышечно-инвазивным раком МП, так как лишена множества недостатков применения электрохирургии.



