При всей многогранности дисциплины едва ли не самым замысловатым направлением урологии является реконструктивно-пластическая хирургия, где особое место отведено протяженным стриктурам и облитерациям мочеточника. Этиология последних разнообразна. Это могут быть последствия лучевой терапии и комбинированного лечения опухолей малого таза, изъяны гинекологических вмешательств и протезирования магистральных сосудов, болезнь Ормонда. Хотя в последнее время все чаще причиной становятся осложнения внутрипросветных эндоурологических манипуляций, на долю которых приходится более трети [1, 2]. При тотальных дефектах операцией выбора служит их замещение изолированным сегментом подвздошной кишки, один из концов которого анастомозируют с лоханкой, другой – с мочевым пузырем [3]. Однако выраженные инфильтративно-воспалительные изменения тканей, педункулит и склерозирующий паранефрит (как ответ на предшествовавшие интервенции) могут поставить под сомнение безопасность мобилизации лоханки, делая это вóвсе невозможным при ее внутрипочечном характере. Единственный выход из такой ситуации – илеокаликостомия, когда краниальное соустье кишечного неоуретера формируют с большой почечной чашкой [4]. Трудно представить себе более сложную хирургию, которая остается крайне редкой даже в традиционном лапаротомном исполнении, не говоря уж о минимально инвазивном. Так, на запрос «ileocalicostomy» библиотекой PubMed предложено лишь три публикации по этой теме. В свою очередь поиск русскоязычной литературы успехом не увенчался: ни одной статьи в eLIBRARY.ru обнаружить не удалось. Перечисленное побудило поделиться первым собственным опытом лапароскопической илеокаликостомии, включая ее отдаленные функциональные результаты. Приводим клиническое наблюдение.
Пациентка Х. 50 лет. Рост – 190 см, масса тела – 93 кг.
Жалобы на периодические боли в пояснице справа, наличие нефростомического дренажа. Из анамнеза известно, что, находясь в процессе комбинированного лечения билатерального рака молочной железы, спустя срок после дистанционной лучевой терапии жестокая атака обструктивного пиелонефрита потребовала пункционного дренирования. По купировании воспаления предпринята антеградная пиелография, верифицировавшая отсутствие проходимости пиелоуретерального сегмента внутрипочечной лоханки. При уретероскопии выше уровня подвздошных сосудов по мере продвижения вверх мочеточник постепенно меняет свой характер: белесый уротелий без сосудистого рисунка, стенки ригидны, а просвет прогрессивно сужается. Ретроградное контрастирование определило стриктуру правого мочеточника протяженностью около 10 см. Больная направлена в урологический центр ЧУЗ «КБ «РЖД-Медицина» г.Нижний Новгород», госпитализирована. Диагноз при поступлении: протяженная стриктура верхней трети правого мочеточника, функционирующая нефростома. Хронический пиелонефрит, ремиссия. Вынесены показания к хирургическому лечению, предпринятому 11.01.2019.
 Техника операции (видео доступно по ссылке https://youtu.be/bIW_m3lwXWY). Положение на спине с поворотом операционного стола на здоровую сторону. Однопрокольный доступ в пупке, куда установлен оптический порт. Карбоксиперитонеум – 12 мм рт.ст. Схема расположения рабочих троакаров отражена на рис. 1. При ревизии брюшной полости патологии не выявлено. Восходящая кишка мобилизована медиально, двенадцатиперстная – по Кохеру. В забрюшинном пространстве выраженные фиброзные изменения, не позволившие верифицировать ни мочеточник, ни гонадную вену. Тщетные попытки диссекции ворот: внутрипочечная лоханка и сосудистая ножка в стекловидном периренальном жире единым конгломератом, фиксированным к стенке нижней полой вены так, что передняя почечная губа частично перекрывает правую переднебоковую ее полуокружность. Нормальный мочеточник обнаружен лишь ниже общих подвздошных сосудов. Принято решение о заместительной кишечной пластике – илеокаликостомии.
Техника операции (видео доступно по ссылке https://youtu.be/bIW_m3lwXWY). Положение на спине с поворотом операционного стола на здоровую сторону. Однопрокольный доступ в пупке, куда установлен оптический порт. Карбоксиперитонеум – 12 мм рт.ст. Схема расположения рабочих троакаров отражена на рис. 1. При ревизии брюшной полости патологии не выявлено. Восходящая кишка мобилизована медиально, двенадцатиперстная – по Кохеру. В забрюшинном пространстве выраженные фиброзные изменения, не позволившие верифицировать ни мочеточник, ни гонадную вену. Тщетные попытки диссекции ворот: внутрипочечная лоханка и сосудистая ножка в стекловидном периренальном жире единым конгломератом, фиксированным к стенке нижней полой вены так, что передняя почечная губа частично перекрывает правую переднебоковую ее полуокружность. Нормальный мочеточник обнаружен лишь ниже общих подвздошных сосудов. Принято решение о заместительной кишечной пластике – илеокаликостомии.
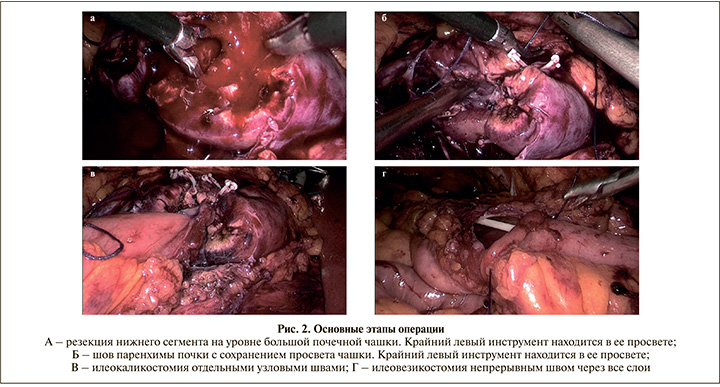
В аорто-кавальном промежутке (тотчас у аорты) мобилизована правая почечная артерия. На фоне тепловой ишемии (25 мин) нижний сегмент почки ампутирован на уровне большой почечной чашки (рис. 2А). Раздельно ушиты сосуды паренхимы. Ренораффия по методике скользящих клипс, но с сохранением зияющего просвета шейки чашки, чья беспрепятственная проходимость оценена введением стерильного раствора по нефростоме (рис. 2Б). Контроль гемостаза. Отсчитав 40 см от илеоцекального угла, пересечена подвздошная кишка. Отводящий ее конец фиксирован провизорным швом к мочевому пузырю. Для определения адекватной длины будущей вставки до пересечения приводящий конец расправлен вверх и подведен к зоне планируемого почечного соустья. Вследствие особенностей анатомического строения – короткой брыжейки и сосудистых аркад – длина извитого сегмента кишки, предполагавшегося для замещения мочеточника, составила более 50 см. Снят провизорный шов с мочевого пузыря. Последний мобилизован по переднебоковой полуокружности и фиксирован к правой подвздошной мышце по методике psoas hitch. После этого маневра проведена повторная «примерка» илеовставки: в изоперистальтическом положении длина уже прямого фрагмента 25 см, натяжения нет. На этом уровне пересечен приводящий конец кишки. Проходимость ее восстановлена аппаратным анастомозом «бок-в-бок» в стандартной манере. Сквозь изолированный сегмент проведен внутренний стент, один из концов которого заведен в лоханку через чашку. К шейке последней отдельными узловыми швами фиксирован краниальный конец неоуретера (рис. 2 В). Анастомоз циркулярно укутан прядью большого сальника, раскроенной по типу хвоста ласточки, и проверен на герметичность через нефростому. В максимально «высокой» точке мочевого пузыря выполнено овальное отверстие, соответствующее просвету каудального отдела кишечного импланта. Их соединение произведено непрерывным швом и тестировано на состоятельность наполнением пузыря через уретральный катетер (рис. 2Г). Дренаж в малый таз установлен через рану троакара подвздошной области. Шов ран. Асептические наклейки. Кровопотеря – 200 мл.
Продолжительность вмешательства – 300 мин. Спустя 3 ч работы предпринята «остановка безопасности»: десуффляция и перевод в физиологическое положение на 20 мин, после чего операция продолжена до конца. По ее завершении пробуждение и экстубация на столе. Вечером того же дня активизирована в пределах палаты реанимации, утром переведена в отделение, где провела 12 койко-дней. Обострение пиелонефрита потребовало дополнительной медикаментозной терапии. Однако в целом послеоперационный период протекал без осложнений. Восстановление функции кишечника пришлось на третьи сутки. Через 10 дней после пластики антеградная пиело- и ретроградная цистографии подтвердили проходимость нового мочеточника и состоятельность всех анастомозов. Нефростома и уретральный катетер поэтапно удалены, пациентка выписана с внутренним стентом, который простоял 1 мес.
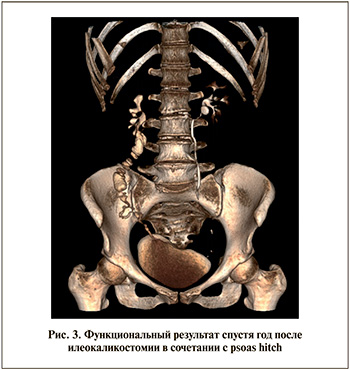 Продолжая бороться с онкологией, больная регулярно наблюдается и проходит разностороннее обследование. Последнее – в январе 2020 г. Общий клинический и биохимический анализы крови в норме; посев мочи стерилен. По данным компьютерной томографии с контрастным усилением, функция почек сохранена и своевременна; признаков нарушения уродинамики нет, интестиноуретер работает адекватно и проходим на всем протяжении (рис. 3).
Продолжая бороться с онкологией, больная регулярно наблюдается и проходит разностороннее обследование. Последнее – в январе 2020 г. Общий клинический и биохимический анализы крови в норме; посев мочи стерилен. По данным компьютерной томографии с контрастным усилением, функция почек сохранена и своевременна; признаков нарушения уродинамики нет, интестиноуретер работает адекватно и проходим на всем протяжении (рис. 3).
Вне зависимости от доступа – открыто или лапароскопически – заместительная кишечная пластика мочеточников в виде илеокаликостомии является эксклюзивной и технически сложной хирургией. Проведя литературный поиск, удалось отыскать только три статьи на эту тему. Самая ранняя, вышедшая в 2006 г., посвящена лапароскопически-ассистированному вмешательству, предпринятому в связи с туберкулезом верхних мочевых путей. На страницах Journal of Endourology N. Kamat и P. Khandelwal поведали историю болезни двадцатилетнего индийца, попавшего к ним в связи с множественными разнокалиберными стриктурами левого мочеточника и стенозом лоханки, послужившими поводом к заместительной интестинопластике. Комбинированная операция начата из лапароскопического доступа: низведена нисходящая кишка; выделен и иссечен после клипирования у лоханки и мочевого пузыря мочеточник; почка мобилизована снизу; выполнена каликотомия. Последняя, принимая во внимание атрофию паренхимы нижнего сегмента, произведена без ишемиии – так, как иссекают кисту почки. Второй этап осуществлен через нижнесрединную лапаротомию: резецирован сегмент подвздошной кишки, через который проведен внутренний стент; сформирован классический межкишечный анастомоз двурядным ручным швом. Рана ушита и пневмоперитонеум восстановлен. Соустья илеоуретера с почечной чашкой и мочевым пузырем выполнены интракорпорально: один конец кишки в пузырь, другой – в истонченную паренхиму. Продолжительность вмешательства – 7 ч при кровопотере 200 мл. Послеоперационный период осложнился развитием кишечной непроходимости, устраненной при релапаротомии, и продолжался 19 дней на фоне антибиотик-индуцированной диареи. Несмотря ни на что, пациент выздоровел, а контрольное обследование, предпринятое спустя 3 мес., продемонстрировало восстановление функции почки и нормальную работу воссозданного мочеточника [5].
Следующая публикация увидела свет лишь спустя 12 лет.
J. Konheim и D. Khaled из Нового Орлеана описали два случая правосторонней илеокаликостомии, предпринятой из широкой срединной лапаротомии. Особенностью их хирургической техники стало формирование анастомозов: и дистальный и проксимальный исполнялись «в бок кишки». Истонченная почечная паренхима позволила получить беспрепятственный доступ к нижней группе чашек, а объединяли их с просветом кишки отдельными швами в два ряда. Длительность операций составила 436 и 264 мин при кровопотере 300 и 200 мл соответственно. Послеоперационный период составил 8 и 6 дней, протекал без осложнений Clavien ≥III, но с обострением хронической мочевой инфекции, потребовавшей повторной госпитализации одной из больных. Контрольное обследование, предпринятое через полгода, показало восстановление оттока мочи и улучшение почечной функции [4].
Первое и пока последнее сообщение об илеокаликостомии уже в роботическом исполнении датируется 2018 г., когда S. Kumar и A. Chandna поделились своими впечатлениями от использования «da Vinci Si». Их молодая пациентка (с единственно функционирующей почкой) была прооперирована в связи протяженным дефектом левого мочеточника в сочетании со стенозом лоханки. Они оказались исходом осложненной открытой пиелолитотомии с пиелопластикой, ранее предпринятых по поводу коралловидного камня на фоне стриктуры лоханочно-мочеточникового сегмента. Опуская подробности истории болезни, внимания заслуживают аспекты хирургической техники и исходного состояния паренхимы. Операция проводилась в два этапа. На первом пациентка располагалась на спине в положении Тренделенбурга. Произведена резекция подвздошной кишки, проходимость которой восстановлена сшивающими аппартами «бок-в-бок» интракорпорально. После наполнения мочевого пузыря через дополнительный прокол над лоном внебрюшинно в его полость проведен катетер Фолея 16 Ch. В области верхушки, сместившись влево, выполнено цистотомическое отверстие, соответствовавшее диаметру кишечной вставки. Через это отверстие упомянутый катетер проведен сначала в брюшную полость, потом – через просвет неоуретера. Илеовезикостомия исполнена непрерывным обвивным швом абсорбируемой нитью 2–0. Приступая ко второму этапу вмешательства, – re-docking робота, пациентку перевели в положение «на боку». Нисходящая кишка широко мобилизована медиально. Осуществлен доступ к нижнему полюсу почки. Как и в предыдущих наблюдениях, выраженная каликоэктазия с атрофией паренхимы позволила сформировать адекватное просвету кишки отверстие (2,5 см), не прибегая к тепловой ишемии. Кончик катетера Фолея (из просвета кишечного импланта) заведен в полость чашечно-лоханочной системы; его баллончик раздут на 5 мл. Илеокаликоанастомоз непрерывным швом аналогичной нитью. Страховой дренаж в малый таз. Длительность вмешательства составила 270 мин; кровопотеря – 50 мл. Послеоперационный период протекал гладко. Уретральный катетер удален через 1, а нефростома – через 2 нед. и после антеградной урографии, продемонстрировавшей состоятельность всех анастомозов. Спустя еще 7 дней пациентку избавили и от импровизированного кишечного интубатора. Сроки стационарного пребывания в статье не отражены, как и отдаленные результаты. Однако, со слов авторов, спустя полгода после операции пациентка чувствовала себя хорошо при адекватном диурезе и нормальных показателях шлаков крови [6].
Представленное нами клиническое наблюдение в своем роде уникально. Это первое сообщение о полностью интракорпоральной илеокаликостомии, выполненной из классического лапароскопического доступа от начала и до конца. В отличие от других, здесь для обнажения большой чашки пришлось прибегнуть к резекции полноценного почечного сегмента, представленного полнокровной сочной паренхимой. Причем сделать это так, чтобы, с одной стороны, швы ренографии обеспечили надежный гемостаз, с другой – свободный и беспрепятственный отток мочи через изолированную шейку, к которой пришивали конец кишечной вставки. Последнюю, кстати, удалось расположить изоперистальтически, что не всегда удается с правой стороны. В свою очередь маневр с psoas hitch-фиксацией мочевого пузыря позволил существенно сократить длину илеоуретера и расположить его прямо, без лишних петлевых изгибов, несмотря на анатомические особенности брыжейки. В обсуждаемом контексте обнаружить публикации о подобном приеме в доступной литературе не удалось.
Независимо от манеры исполнения заместительная илеокаликостомия – чрезвычайно редкое и непростое вмешательство, таящее множество препятствий и трудностей, преодоление которых требует немало усилий. Первый собственный опыт показал не только техническую возможность выполнения всех этапов этой операции из лапароскопического доступа, но и хорошие отдаленные функциональные результаты. Последнее позволяет расценивать подобную хирургию как минимально инвазивную альтернативу в спектре способов лечения этой сложной категории больных.



