Введение. Рак предстательной железы (РПЖ) является наиболее распространенным злокачественным заболеванием у мужчин как в Европе, так и в США [1]. Основным методом лечения пациентов с локализованным РПЖ и ожидаемой продолжительностью жизни более 10 лет является радикальная простатэктомия (РПЭ) [2].
Радикальное лечение часто ассоциировано с существенными и длительными осложнениями, среди которых наиболее значимые недержание мочи (НМ) и эректильная дисфункция, оказывающие негативное влияние на качество жизни пациентов и удовлетворенность оперативным лечением [3, 4]. При этом H.V. Holm et al. [5] показали, что НМ после простатэктомии в отличие от эректильной дисфункции не только ухудшает качество жизни, но и тесно связано со значительным снижением работоспособности и депрессией. Несмотря на достижения в области тазовой анатомии и хирургической техники [6], общая частота НМ после РПЭ продолжает расти вследствие увеличения числа выполняемых операций [2]. В систематическом обзоре F. Ferronha et al. [7] не было выявлено существенных различий в частоте и степени послеоперационного НМ между пациентами после робот-ассистированной РПЭ (РАРП), лапароскопической РПЭ и позадилонной РПЭ (ПРПЭ) [7].
По данным различных авторов, этиология НМ после РПЭ может быть обусловлена не только послеоперационной недостаточностью сфинктера уретры, но и дисфункцией мочевого пузыря, возникшей de novo и существовавшей до операции [8–10].
На сегодняшний день наряду с радикальным оперативным лечением широко используются аблативные методы лечения локализованного РПЖ, которые при правильном отборе пациентов имеют сопоставимые онкологические и лучшие функциональные результаты [11]. В линейке аблативных методов лечения на сегодня доступны высокоинтенсивный фокусированный ультразвук (HIFU), криоаблация, фотодинамическая и брахитерапия [12]. Однако данные долгосрочных сравнительных исследований, доказательно демонстрирующие, что аблативные методы лечения имеют эквивалентные или превосходящие онкологические и функциональные результаты по сравнению с РПЭ, в современной научной литературе отсутствуют.
В клинико-диагностическом центре «Здоровье» г. Ростова-на-Дону для лечения РПЖ с учетом оценки онкологического и соматического статуса пациента применяются современные органосохраняющие (HIFU, криоаблация) и органоуносящие (робот-ассистированная, позадилонная и промежностная простатэктомии) методы оперативного лечения.
В настоящем исследовании нами проведена сравнительная оценка изменений уродинамических показателей пациентов после HIFU, РАРП и ПРПЭ.
Материалы и методы. Нами проведен ретроспективный анализ данных комплексных уродинамических исследований (КУДИ), выполненных с марта по декабрь 2017 г. пациентам после оперативного лечения локализованного РПЖ, предъявлявшим жалобы на НМ. Комплексное уродинамическое исследование выполнялось, если через 6 мес. и более после оперативного вмешательства у пациента сохранялось НМ. Недержание мочи определялось нами как необходимость использования пациентом уропрезервативов, подгузников или прокладок в количестве 1 и более в сутки.
Исходно в исследовании приняли участие 190 пациентов. Критерии включения пациентов: НМ после оперативного лечения РПЖ, отсутствие в анамнезе нейрогенной дисфунции нижних мочевых путей, оперативного лечения гиперплазии предстательной железы и рецидива РПЖ.
В дальнейшем 32 человека были исключены из анализа в связи с отказом от участия в исследовании, наличием сужения уретры, не позволившего установить уродинамический катетер. В итоге были учтены 158 пациентов, распределенных по группам в зависимости от метода лечения: группа I – 32 пациента, получивших лечение с помощью HIFU; группа II – 46 пациентов после ПРПЭ; группа III – 80 пациентов, перенесших РАРП.
Средний возраст пациентов в группе I составил 71,8±3,68 года, в группе II – 69,5±4,63, в группе III – 65,8±3,4 года соответственно (p<0,01). При выполнении КУДИ сроки после операции варьировались от 6 мес. до 4,6 года (в среднем 2,7±1,3 года), составив 3,1±1,3, 3,2±1,8 и 1,8±0,6 года в группе I, II и III соответственно.
Обследование пациентов, перенесших оперативное лечение РПЖ, включило общий осмотр, общеклиническое и инструментальное обследование, определение уровня общего простатспецифического антигена в крови, пальцевое ректальное исследование, трансректальное УЗИ, урофлоуметрию, заполнение опросника ICIQ-SF в русском варианте, тест с прокладкой.
Всем включенным в исследование пациентам было выполнено КУДИ, включившее цистометрию, накожную электромиографию, исследование давление–поток, стоп-тест, уретропрофилометрию и пробу на порог абдоминального давления. Для оценки уродинамических параметров использовались уродинамические системы MMS Solar (Нидерланды). Все термины и методики, использованные при выполнении КУДИ, были основаны на стандартах ICS (Международного общества по удержанию мочи) [13]. Для оценки внутрипузырного и абдоминального давления использовали асептический катетер типа Тиммана 8 Ch и ректальный датчик 12 Ch. Электромиографию мышц тазового дна проводили перианально поверхностными электродами в положениях на 3.00 и 9.00 условного циферблата. Инфузию физиологического раствора комнатной температуры при заполнении мочевого пузыря осуществляли со скоростью 50 мл/мин. При выявлении у пациентов высокоамплитудной ДГ скорость наполнения снижали до 20–30 мл/мин.
С целью определения истинной сократительной способности детрузора во время микции выполнялся стоп-тест. Для оценки типа снижения эластичности останавливали наполнение и оценивали адаптационную способность детрузора.
Профиль уретрального давления измеряли в состоянии покоя со скоростью протяжки 2 мм/с и со скоростью перфузии физиологического раствора 2 мл/с.
Снижение чувствительности мочевого пузыря определяли как уменьшение ощущения мочевого пузыря или отсутствие сильного позыва при цистотонометрии наполнения. Эластичность мочевого пузыря (комплаенс) считалась сниженной, если ΔV/ΔPdet (отношение разницы объема к изменению детрузорного давления) составляло ≤ 20 мл/см водн.ст. Детрузорной гиперактивностью считали любое спонтанное или провоцированное непроизвольное сокращение детрузора. Гипоконтрактильность детрузора описывали, если индекс контрактильности мочевого пузыря был меньше 100. Инфравезикальную обструкцию (ИВО) выявляли по номограмме ICS.
Пробу на порог абдоминального давления выполняли в положении пациента стоя (если возможно) при наполнении мочевого пузыря на 30% от максимальной цистометрической емкости. В отсутствие подтеканий с установленным уродинамическим катетером пробу повторяли после удаления катетера, при этом измеряли абдоминальное давление с помощью ректального датчика. К сожалению, при такой методике невозможно выявить провоцированную ДГ, однако с учетом проводимого перед этим исследования с установленным уретральным катетером с достаточной степенью достоверности можно судить об отсутствии подобных эпизодов.
Результаты. Статистическую обработку результатов проводили с помощью программного обеспечения Statistica 10.0. При статистической обработке осуществляли попарное сравнение исследуемых групп с использованием непараметрического критерия Манна–Уитни, в качестве критического уровня значимости принимали значение p<0,05.
Средний балл по опроснику ICIQ-SF (русская версия) составил 14.
В целом ДГ была диагностирована 110 (69,6%) обследованным (см. таблицу). При этом у 14% пациентов с ДГ проба на порог абдоминального давления была отрицательной как с катетером, так и после его удаления. Необходимо отметить, что почти половина (47,6%) пациентов с выявленной ДГ не отмечала ургентности ни в жалобах при опросе, ни в ходе выполнения КУДИ.
Снижение эластичности стенки мочевого пузыря (комплаенса) выявилось у подавляющего большинства пациентов – 75,9% (см. таблицу). Однако при остановке наполнения мочевого пузыря и изучении адаптации его стенки к объему выяснено, что только у 14 (8,8%) пациентов снижение эластичности носило истинный анатомический характер (см. таблицу). В остальных случаях снижение этого параметра было функциональным и выявлялось на фоне повышенного тонуса детрузора при относительно быстром заполнении мочевого пузыря.
Средние показатели максимального детрузорного давления, измеренные при изометрическом сокращении мочевого пузыря, были снижены у всех пациентов (см. таблицу). Несмотря на более выраженное снижение детрузорного давления в группе ПРПЭ, разница оказалась статистически незначимой (p>0,1). Снижение индекса контрактильности отмечено более чем в половине случаев в каждой из групп (p>0,1, см. таблицу).
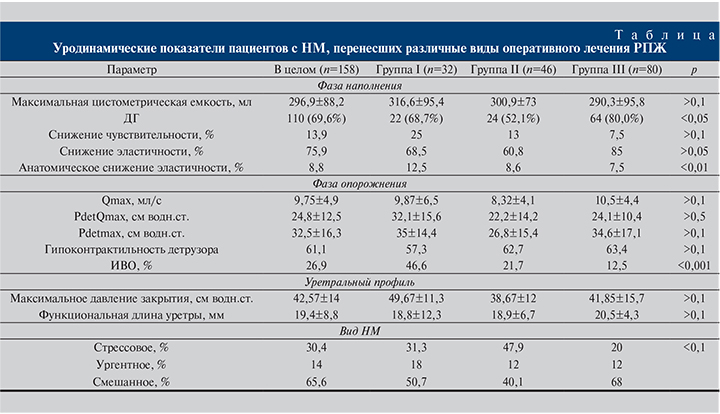
Инфравезикальная обструкция той или иной степени выраженности была выявлена у 46,6, 21,7 и 12,5% пациентов групп I, II и III соответственно (p<0,001).
Максимальное уретральное давление закрытия было умеренно снижено у всех пациентов и в среднем составило 42,57±14 см водн.ст., статистически значимо не различаясь в группах (p>0,1, см. таблицу). Кроме того, отмечалась достоверная разница этого показателя у пациентов с отрицательной пробой на порог абдоминального давления и ДГ (p<0,05; k=0,87).
Остальные уродинамические параметры отражены в сводной таблице.
Обсуждение. На сегодняшний день проведено немало исследований, посвященных изучению уродинамики нижних мочевыводящих путей после РПЭ. Однако многие работы основаны на небольшом числе наблюдений и, как правило, без деления на группы по методам оперативного лечения. Еще меньше работ оценивают уродинамику после фокальной терапии РПЖ.
В настоящем исследовании мы проанализировали уродинамические параметры пациентов с НМ в зависимости от метода лечения РПЖ.
Детрузорная гиперактивность оказалась одним из самых частых уродинамических феноменов, описанных в работах по НМ после РПЭ. Так, по данным различных авторов [14], частота ДГ у пациентов с НМ, перенесших РПЭ, варьируется от 3 до 71%. Подобный разброс говорит о большой вариабельности данных, совершенно различных критериях отбора и оценки исследователей. Такие результаты сложно считать корректными. В нашей работе частота ДГ среди всех пациентов, подвергшихся радикальному оперативному лечению РПЖ, составила 69,6%. Однако при детальном анализе оказалось, что реже всего ДГ развивалась после ПРПЭ (52,1%), что полностью соответствует данным нашего же исследования 2016 г. [15], в котором оценивались уродинамические параметры только после ПРПЭ. Выявленная наибольшая (80%) частота ДГ в группе РАРП, по нашему мнению, не имеет объяснения и требует дальнейшего изучения. Вместе с тем более высокая частота ДГ у пациентов, получавших HIFU, вполне объяснима частотой ИВО, составившей в этой группе 46,6%, с высокой степенью достоверности, превосходившей частоту ИВО в других группах.
Высокая частота изолированного ургентного НМ нами выявлена в группах HIFU (18%) и ПРПЭ (14%) (показатели, полученные в группе ПРПЭ согласуются с опубликованным нами раннее исследованием [15]). При этом отмечена высокая степень корреляции ургентного НМ и уровня максимального уретрального давления закрытия, в то время как у остальных пациентов статистически достоверной разницы в уровне давления или протяженности функциональной длины уретры вне зависимости от полученного вида оперативного лечения РПЖ выявлено не было. Эти данные указывают, что именно изменения уретры служат основной причиной развития НМ после оперативного лечения РПЖ без корреляции с его видом и объемом оперативного лечения, что подтверждается результатами исследования H. Lee et al. [14], показавшими, что в группе пациентов, перенесших РПЭ, не имевших НМ, уретральное давление в среднем на 10 см водн.ст. выше, чем у пациентов с НМ. Кроме того, обращает на себя внимание, что 47,6% пациентов с ДГ не отмечали симптомов ургентности. В связи с этим установление диагноза ургентного НМ вышеуказанной группе пациентов крайне затруднительно и без уродинамического исследования может привести к неправильной тактике лечения. Недержания мочи от переполнения в чистом виде в исследуемых нами группах пациентов выявлено не было. Между тем у пациентов со смешанной формой НМ в подавляющем большинстве случаев преобладали симптомы стрессового НМ. Кроме того, необходимо помнить, что в ходе КУДИ не всегда удается выявить подтекание мочи при напряжении вследствие невозможности в точности повторить условия повседневной деятельности пациента, поэтому указанное выше разделение не может носить характер категорического утверждения.
Еще одним параметром, указывающим на дисфункцию мочевого пузыря и способствующим персистированию НМ, является снижение эластичности (или комплаентности) стенки мочевого пузыря. Снижение эластичности de novo наблюдается у 32% пациентов [16], перенесших РПЭ. По нашим данным, снижение эластичности имело место у 75,9% пациентов с НМ после оперативного лечения РПЖ. Однако только у 8,8% пациентов нарушение эластичности носило анатомический характер, т.е. было вызвано непосредственным снижением растяжимости тканей мочевого пузыря, а не стало результатом повышенного тонуса гладкой мускулатуры детрузора. При этом достоверно больший процент органических поражений отмечен в группе пациентов после HIFU. На наш взгляд, данный факт можно связать как непосредственно с самим воздействием высокоинтенсивного фокусированного ультразвука, так и с большим процентом персистирующей ИВО в данной группе.
Противоположным изменением детрузора является снижение его сократительной способности (или контрактильности). Так, ряд авторов [17] сообщают о значительном снижении максимального детрузорного давления на фоне нормальной или повышенной максимальной скорости мочеиспускания. Существуют различные методы оценки контрактильности детрузора [18]; мы определяли этот параметр по индексу контрактильности и уровню максимального детрузорного давления, которое измеряли в момент изометрического сокращения мочевого пузыря при выполнении стоп-теста, при котором пациент резко прерывает поток, тем самым создавая условия для изометрического сокращения. Следует отметить, что индекс контрактильности служит параметром, стандартизированным для пациентов с наличием дополнительного сопротивления в виде предстательной железы и, возможно, мало приемлем для пациентов после РПЭ [19]. Вместе с тем стоп-тест может быть недостаточно информативным для пациентов, которые не могут резко прервать поток вследствие значительного снижения функциональной активности сфинктера уретры и мышц тазового дна. В связи с вышеуказанным перспективным направлением научного поиска считается разработка стандартизированного метода определения контрактильности пациентов со сниженным уретральным сопротивлением, в частности, после перенесенной РПЭ.
Известно о наличии прямой корреляции между возрастом пациента и риском развития НМ после РПЭ [14]. Подобная зависимость, вероятно, справедлива и для органосохраняющего лечения РПЖ, в частности, для пациентов после HIFU. Так, показано, что частота развития НМ после HIFU несколько ниже, чем после РПЭ, и составляет порядка 19% [20]. В нашем исследовании пациенты с НМ после HIFU были достоверно старше, чем пациенты групп радикального оперативного лечения, что также косвенно свидетельствует об отрицательном влиянии возраста на частоту развития НМ.
Заключение. Как показали результаты проведенного исследования, у большого процента пациентов, подвергшихся радикальному оперативному лечению РПЖ, выявлены сниженная эластичность стенки мочевого пузыря, ДГ, снижение контрактильности детрузора. Недержание мочи было ассоциировано как с повреждением замыкательного механизма уретры в ходе оперативного лечения, так и с дисфункцией мочевого пузыря. Все эти факторы должны учитываться в диагностике и выборе тактики лечения НМ. Совершенствование хирургической техники и внедрение современных протоколов органосохраняющего лечения в обозримом будущем могут снижать количество пациентов с недостаточностью замыкательного механизма уретры. Однако и дисфункция мочевого пузыря требует детальной оценки для выбора правильной тактики лечения НМ.
В связи с этим считаем необходимым проведение дальнейших исследований с обязательной пред- и послеоперационной уродинамической оценкой состояния нижних мочевыводящих путей пациентов после оперативного лечения РПЖ без НМ.



