Под определением «стеноз шейки мочевого пузыря» подразумевают препятствующее нормальному мочеиспусканию сужение мочеиспускательного канала в области его внутреннего отверстия. Наиболее часто указанное состояние развивается как осложнение оперативных вмешательств на предстательной железе. Для описания его используют несколько терминов. В русскоязычной литературе приняты такие определения, как «стеноз» или «склероз», а в зарубежной часто встречается термин «контрактура» шейки мочевого пузыря (ШМП).
Стеноз шейки мочевого пузыря развивается в 0,3–9,1% случаев после операций на простате [1–3]. К факторам риска развития стеноза ШМП относятся малый объем предстательной железы до операции, необходимость повторной катетеризации после удаления катетера в послеоперационном периоде, а также сочетание ряда сопутствующих заболеваний у оперируемого пациента [4].
Эндоскопическая коррекция является эффективным методом устранения указанного осложнения. По данным A. J. Vanni et al., инцизия шейки мочевого пузыря обеспечивает данный стойкий эффект 72% пациентов [5]. Рецидивы после первичной эндоскопической коррекции являют собой гораздо более серьезную проблему. Есть данные об эффективности использования антипролиферативных лекарственных средств (митомицин, триамцинолон) для снижения вероятности рецидива после повторного вмешательства. В этом случае препарат вводят непосредственно в ткани шейки мочевого пузыря сразу после ее инцизии или резекции [6, 7].
При неэффективности трансуретральной хирургии используют реконструкцию шейки за счет одного (Y-V пластика) или двух (T-пластика) перемещаемых в простатический отдел уретры лоскутов передней стенки мочевого пузыря. Авторы указывают на высокую эффективность данного метода [8, 9].
В 2017 г. da Silva и Flynn описали новую методику реконструкции шейки мочевого пузыря робот-ассистированным трансвезикальным доступом [10]. Для реконструкции использовали буккальный графт треугольной формы c укладкой и фиксацией его на предварительно подготовленное ложе под межмочеточниковой складкой. Площадку для укладки трансплантата формировали путем удаления рубцовых тканей в области мочепузырного треугольника и задней полуокружности шейки мочевого пузыря. Первые результаты оценены авторами как хорошие, тем не менее можно отметить необходимость широкого вскрытия мочевого пузыря для обеспечения доступа к зоне реконструкции и тот факт, что трансплантат перекрывает не более половины окружности стенозированной шейки пузыря.
На основе последней из описанных выше методик нами был предложен модифицированный способ реконструкции шейки мочевого пузыря с использованием буккального графта у пациента с рецидивным стенозом ШМП и короткой (12 мм по данным уретрографии) простатической уретрой.
Пациент Н. 56 лет. Соматически здоровый мужчина нормостенического телосложения с ИМТ 27,5. Жалобы на затрудненное мочеиспускание тонкой вялой струей. Из анамнеза известно, что в течение предшествовавших 2 лет перенес серию операций на мочевывыводящих путях. Хронология, характер вмешательств, их особенности и показания к проведению приведены в табл. 1.

Таким образом, имелась типичная картина рецидивного стеноза шейки мочевого пузыря, по поводу которого ранее выполнено три оперативных вмешательства (инцизия, трансуретральная резекция и трансуретральная резекция с инъекцией митомицина С).
Предоперационное обследование продемонстрировало следующие данные: сумма баллов по шкале IPSS – 20, качество жизни (QоL) – 4, максимальная скорость потока мочи по данным урофлоуметрии (Q max) – 3 мл/с, объем остаточной мочи – 70 мл. При уретрографии передняя уретра хорошо проходима с признаками артифициальных изменений в бульбозном отделе, простатический отдел уретры имеет протяженность до 1,5 см, шейка мочевого пузыря сужена, определяется симптом «фонтанчика».
Техника операции
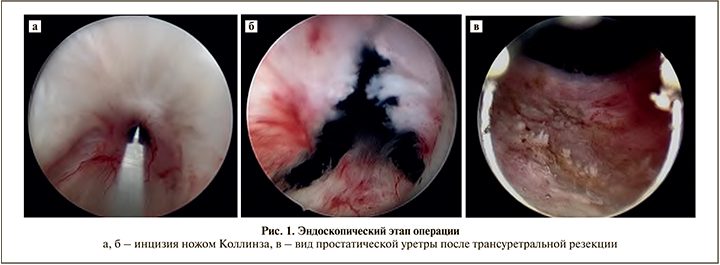
Пациент уложен в литотомическое положение. Резектоскоп проведен в простатический отдел уретры. Шейка рубцово изменена, имеет просвет 2 мм. После инцизии на 12, 5 и 7 ч (рис. 1 а, б) нож Коллинза сменен на петлю и выполнена циркулярная монополярная электрорезекция шейки мочевого пузыря с формированием достаточного ТУР-дефекта (рис. 1 в).
Следующим этапом после перевода пациента в горизонтальное положение осуществлен внебрюшинный лапароскопический доступ к предстательной железе. Расстановка троакаров аналогична той, что используется при простатэктомии. Ультразвуковыми ножницами выполнено продольное вскрытие мочевого пузыря по средней линии, начинающееся в 4 см выше уровня пузырно-простатического перехода и продолжающееся на простатический отдел уретры таким образом, чтобы дистальная граница разреза находилась в 1 см от верхушки предстательной железы. Края рассеченной стенки мочевого пузыря справа и слева на уровне пузырно-простатического перехода прошиты швами-держалками, введенными через переднюю брюшную стенку. После натяжения швов-держалок открыт просвет простатической части мочеиспускательного канала (рис. 2 а). Выполнены аспирация сгустков и финальный гемостаз биполярной коагуляцией, после чего в просвет мочевого пузыря проведен катетер Фолея, баллон которого в простатическом отделе уретры заполнен 35 мл физраствора (рис. 2 б). Далее по стандартной методике осуществлен забор трансплантата слизистой щеки размером 2,5 на 5,0 см.
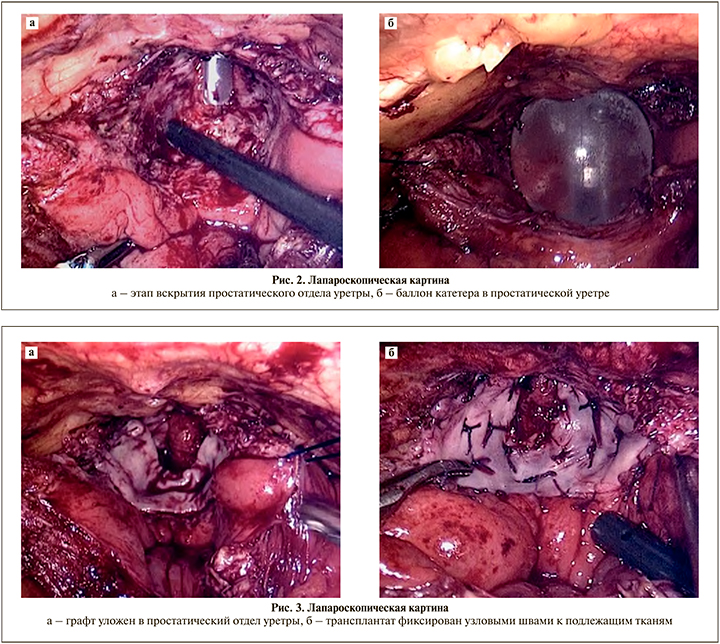
Полученный графт уложен в поперечном направлении в простатический отдел мочеиспускательного канала на эндоскопически сформированный ТУР-дефект (рис. 3 а). Первоначально осуществлена проксимальная фиксация. Графт семью узловыми швами (Викрил 4-0) с шагом 5–6 мм подшит к слизистой мочевого пузыря с захватом подлежащей мышечной стенки. Дистально трансплантат пятью швами (Викрил 4-0) зафиксирован по окружности дистальной границы простатического отдела уретры и в области семенного бугорка. Далее произведена фиксация графта по плоскости к капсуле предстательной железы с использованием 10–12 узловых швов той же нитью с захватом подлежащих тканей на глубину 1–2 мм (рис. 3 б).
После фиксации трансплантата и снятия фиксирующих швов с краев разреза мочевого пузыря установлен трехходовый катетер Фолея и мочевой пузырь с передней поверхностью предстательной железы ушит непрерывным швом полигликолидной монофиламентной нитью 2–0 с насечками (рис. 4 а, б).
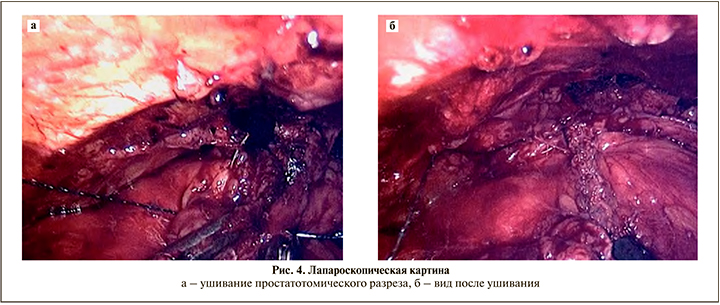
По окончании ушивания оценена герметичность наложенного шва путем введения в мочевой пузырь 150 мл физиологического раствора.
Время операции составило 330 мин, суммарная кровопотеря – 150 мл. Послеоперационный период протекал без особенностей. Страховой дренаж из предпузырного пространства удален на 2-е сутки, пациент выписан из стационара на 5-е сутки, самостоятельное мочеиспускание восстановлено на 15-е сутки.
Контрольное обследование проведено через 11 мес. Получены следующие результаты: сумма баллов по шкале IPSS – 2, качество жизни (QоL) – 1, максимальная скорость потока мочи по данным урофлоуметрии (Qmax) – 19 мл/с, остаточной мочи нет. При гибкой цистоскопии отмечена следующая картина, представленная на рис. 5 (рис. 5).
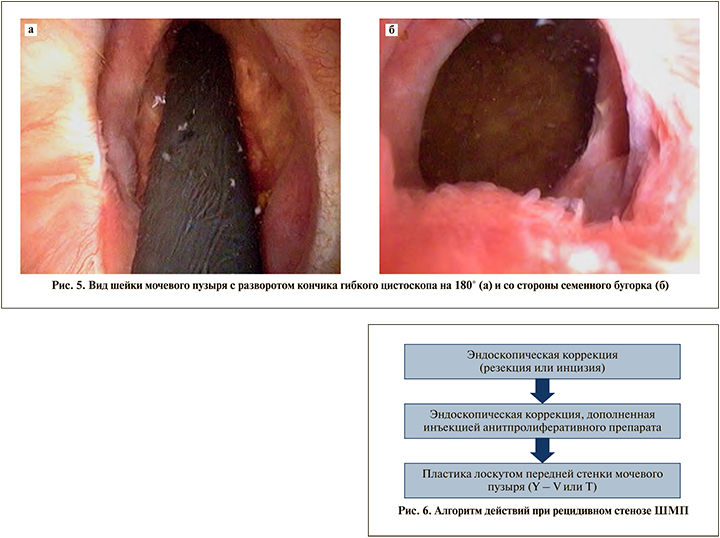
Таким образом, можно трактовать полученный результат как хороший.
Обобщив данные литературы, можно сделать вывод, согласно которому наиболее часто при рецидивном стенозе шейки мочевого пузыря используется следующий алгоритм (рис. 6).
Как видно на представленной схеме, в случае неудач эндоскопической коррекции оптимальным считается использование для реконструкции лоскута передней стенки мочевого пузыря. Эффективность данного метода составляет, по разным данным, от 50 до 100%, а описанные осложнения включают такие состояния, как детрузорная гиперактивность и стрессовая инконтиненция de novo [9]. С точки зрения технической реализации необходимо отметить, что корректная фиксация перемещенного лоскута (или двух лоскутов) в зону верхушки предстательной железы задача непростая и реализация ее значительно затруднена в случае отсутствия значимого просвета простатической уретры и короткой длины последнего. С учетом указанных недостатков предложенный нами вариант хирургической коррекции, сочетающий трансуретральную «подготовку» шейки и простатической уретры, а также последующую inlay-буккальную пластику практически по всей окружности просвета ШМП, может оказаться универсальным, эффективным и надежным методом хирургического лечения рецидивного стеноза шейки мочевого пузыря.



