Введение. Симптомы нарушенного мочеиспускания (СНМ) можно разделить на таковые накопления (наполнения), опорожнения и постмикционные (EAU, 2017). Они распространены, вызывают беспокойство и ухудшают качество жизни [1]. У большинства мужчин СНМП имеют многофакторную природу [2]. К одним из таких факторов относится инфравезикальная обструкция, которая чаще всего вызывалась доброкачественной гиперплазией предстательной железы (ДГПЖ) [2, 3].
Аутопсийные исследования демонстрируют, что морфологические признаки ДГПЖ обнаруживаются у 50% мужчин в возрасте от 40 до 50 лет и у 90% мужчин в возрасте старше 80 лет [4]. Клинически заболевание также имеет достаточно широкое распространение, при этом признаки нарушенного мочеиспускания выявляются у 60% мужчин в возрасте старше 60 лет [5].
Ослабление струи мочи констатируют 25% мужчин в возрасте 55 лет, а среди пациентов старше 75 лет их доля достигает уже 50% [6]. Расчеты, основанные на результатах эпидемиологических исследований, свидетельствуют о том, что у мужчин в возрасте от 50 лет вероятность оперативного вмешательства по поводу ДГПЖ составляет 30% [7].
Симптоматика заболевания при ДГПЖ формируется за счет статического (механического), динамического компонентов, а также нарушения функциональной способности мочевого пузыря [8].
Динамическая составляющая симптомов заболевания связана с повышенным тонусом α1-адренергических рецепторов предстательной железы и шейки мочевого пузыря, что обусловливает сокращение гладкомышечных элементов данной анатомической зоны. Назначение препаратов группы α1-адреноблокаторов, расслабляющих гладкомышечные элементы предстательной железы, приводит к снижению степени обструкции [4]. Как правило, α-адреноблокаторы являются первой линией лекарственной терапии СНМ для мужчин из-за быстрого начала действия, высокой эффективности, а также низкой частоты и тяжести нежелательных явлений [2]. При этом монотерапия препаратами данной группы не позволяет исключать риск развития острой задержки мочи (ОЗМ) и необходимость хирургического лечения пациентов с ДГПЖ [2, 5, 6].
Статический компонент ДГПЖ формируется вследствие разрастания фиброзно-мышечной ткани переходной зоны предстательной железы под влиянием андрогенов. Их влияние на ПЖ опосредовано дигидротестостероном (ДГТ), который образуется из тестостерона под действием 5α-редуктазы 1-го и 2-го типов. Для клинического применения на сегодняшний день доступны два препарата: дутастерид и финастерид [2, 5, 6]. Финастерид подавляет 5α-редуктазу только 2-го типа, тогда как дутастерид одинаково эффективно подавляет оба типа фермента. При длительном приеме финастерида уровень ДГТ снижается на 70%, дутастерида – на 95% [2]. Тем не менее из-за медленного начала действия препараты данной группы подходят только для длительного лечения (в течение многих лет), а их влияние на содержание простатспецифического антигена (ПСА) следует учитывать при скрининге на рак ПЖ.
Цель нашего исследования: изучить эффективность различных вариантов консервативной терапии ДГПЖ с использованием α-адреноблокаторов, ингибиторов 5α-редуктазы и их комбинации.
Материалы и методы. В исследование были включены 90 пациентов с ДГПЖ, подписавших информированное согласие на участие. Возраст больных варьировался от 50 до 70 лет (средний возраст – 59,7±2,1 года).
Всем пациентам при первом визите был проведен комплекс обследований для оценки критериев включения и исключения: сбор жалоб и анамнеза, заполнение шкалы IPSS и оценки качества жизни QoL, дневника мочеиспускания, пальцевое ректальное исследование (ПРИ), урофлоуметрия (с определением максимальной скорости потока мочи – Qmax), трансректальное УЗИ (ТРУЗИ) простаты, УЗИ почек и мочевого пузыря с определением объема остаточной мочи, общеклинические анализы крови и мочи.
Критерии включения в исследование: пациенты с ДГПЖ, которым показана медикаментозная терапия, – суммарный балл IPSS более 12, объем остаточной мочи от 50 до 100 мл, объем предстательной железы более 40 см3, возраст старше 50 лет, уровень ПСА от 1,5 до 4 нг/мл.
Критерии исключения: конкременты мочевого пузыря и дистального отдела мочеточников, гематурия, подозрение на рак простаты, мочевого пузыря, отягощенный аллергический анамнез, оперативные пособия на органах малого таза, инфекции мочевыводящих путей, острый простатит, нейрогенная дисфункция мочевого пузыря.
Методом случайной выборки пациенты были распределены на три группы по 30 человек.
В группу I были включены больные ДГПЖ, которым проводилась монотерапия препаратами группы α-адреноблокаторов (тамсулозин 0,4 мг 1 раз в день). В группе II проведено лечение комбинацией препаратов группы ингибиторов 5α-редуктазы (дутастерид 0,5 мг 1 раз в день) и α-адреноблокаторов (тамсулозин 0,4 мг 1 раз в день). Пациенты группы III получали медикаментозную терапию комбинированным препаратом (дуодарт 5 мг 1 раз в день).
Оценка эффективности лечения проводилась при обращении (визит 1), через 3 мес. (визит 2), 6 (визит 3) и через 12 мес. (визит 4). Она включала заполнение дневников мочеиспускания (частота микций, ноктурия), шкалы IPSS, QоL, урофлоуметрию, ТРУЗИ простаты, УЗИ мочевого пузыря, определение количества пациентов с побочными эффектами (ретроградная эякуляция, эректильная дисфункция, снижение либидо, нарушения со стороны грудных желез, аллопеция, тестикулярная боль, гипотензия, аллергические реакции). Также оценивали комплаентность – приверженность пациентов к проводимой терапии, данный показатель выражался в % больных, соблюдавших рекомендации доктора в периоды между визитами.
Дополнительно был проведен анализ количества пациентов с эпизодами ОЗМ и количества случаев неэффективности медикаментозной терапии с последующим хирургическим лечением за 12 мес. терапии.
Статистическую обработку результатов проводили с помощью программы MSExel 11.0 из стандартного пакета MS Office 2013, а также программного обеспечения IBM SPSS Statistics 21.0. При проверке статистических гипотез применяли методы параметрической (t-test Cтьюдента) статистики. При оценке статистической значимости выявленных различий между средними значениями выборок рассчитывали параметр р, вероятность справедливости нулевой гипотезы была принята равной 5% (р<0,05).
Результаты. Результаты исследований, полученные в течение 12-месячного периода наблюдения, представлены в таблице.
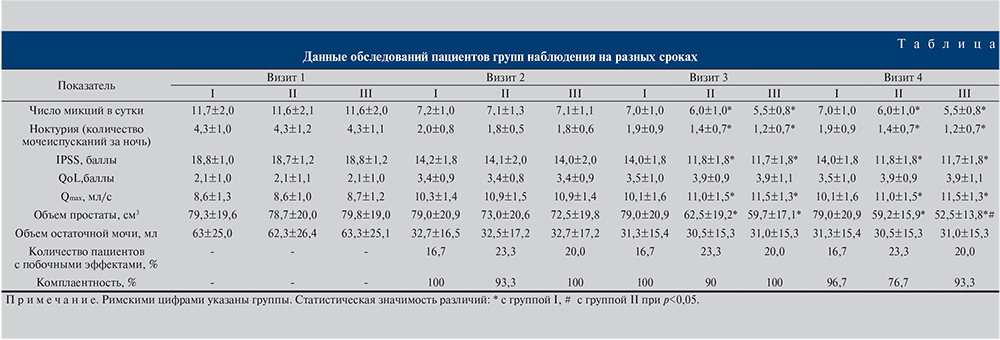
Исходно группы не различались по изучаемым показателям, что свидетельствует об их однородности.
Через 3 мес. терапии отмечена положительная динамика у пациентов всех трех групп. Статистически значимо (р<0,05) уменьшились частота мочеиспусканий и ноктурия по данным дневников мочеиспусканий, увеличилась Qmax, повысился средний балл по шкалам IPSS и QoL. Результаты УЗИ демонстрировали значимое (р<0,05) уменьшение объема остаточной мочи во всех группах и тенденцию к уменьшению объема простаты в группах II и III.
Доля пациентов с побочными эффектами в группе I была ниже и составила 16,7%. В группах II и III было выявлено больше случаев нежелательных явлений, частота которых составила 23,3 и 20% соответственно.
Следует отметить достаточно высокую приверженность пациентов предложенному лечению. Тем не менее в группе II два пациента не выполняли назначения врача, т.е. комплаентность составляла 93,3%.
По прошествии 6 мес. терапии в группе I не было выявлено значимых изменений исследуемых показателей по сравнению с предыдущим визитом (р>0,05). У пациентов групп II и III отмечено снижение частоты мочеиспусканий, число ночных мочеиспусканий, среднего балла по шкале IPSS, увеличение Qmax (см. таблицу). Объем простаты в группе II составил 62,5±19,2, в группе III – 59,7±17,1 см3. Различия были статистически значимыми по сравнению как с визитом 2, так и с группой I (р<0,05).
Новых случаев нежелательных явлений не отмечено.
Комплаентность лечения в группах I и III составила 100%, тогда как в группе II снизилась еще на 3,3% и достигла 90%.
К визиту 4 показатели в группе I также значимо не изменились (p>0,05). В группах II и III сохранялись статистически значимые различия по сравнению с группой I (p<0,05). Среднее значение объема простаты в группе III было достоверно меньше, чем в группе II (р<0,05).
Новых наблюдений побочных явлений выявлено не было.
Комплаентность во всех трех группах снизилась. Наиболее низкое значение данного показателя отмечено в группе II – 76,7%, в то время как в группах I и III оно составило 96,7 и 93,3% соответственно.
За 12 мес. терапии в группе I у 13,3% пациентов возникли эпизоды ОЗМ. В группе II данный показатель был ниже и составил 6,7%. Наименьшее количество пациентов с эпизодами ОЗМ зарегистрировано в группе III – 3,3%. Хирургическое лечение в группе I потребовалось в 20% наблюдений, в группе II – в 10%, в группе III – 3,3%.
Заключение. По сравнению с монотерапией комбинированная терапия α-адреноблокаторами и ингибиторами 5α-редуктазы более эффективно снижает выраженность СНМ, повышает показатель Qmax и предупреждает прогрессирование заболевания, что проявляется в меньшей частоте эпизодов ОЗМ и хирургических вмешательств в группах II и III. Однако комбинированная терапия может сопровождаться большим числом побочных эффектов. В связи с этим ее следует назначать прежде всего мужчинам с СНМ умеренной или тяжелой степени и риском прогрессирования заболевания.
Кроме того, необходимо отметить, что в группе больных, получавших комбинированный препарат Дуодарт, степень комплаентности была стабильно выше по сравнению с пациентами, получавшими комбинацию препаратов, чем, на наш взгляд, и обусловлена меньшая частота наблюдений ОЗМ и необходимости оперативного вмешательства.
Таким образом, результаты данного исследования демонстрируют, что применение Дуодарт больными ДГПЖ эффективно позволяет устранять СНМ и снижать риск прогрессирования заболевания, что проявляется в снижении количества осложнений и тем самым способствует повышению качества жизни пациентов.



