Введение. Прямое применение низких температур в медицине используется давно в качестве хирургического инструментая: в косметологии и для создания очаговых зон деструкции в опухолевых клетках-мишенях [1—3]. Криоабляция — процесс глубокого, локального замораживания и девитализации тканей, позволяющий прицельно создавать зону крионекроза необходимой формы и размера для деструкции пораженной опухолью ткани и прилежащих здоровых клеток [2]. Технический прогресс в медицине привел к созданию нескольких типов криоаппаратов, использующих эффект дросселирования газов. В качестве хладагента применяются жидкий азот, углекислый газ, закись азота, гелий или аргон. В современной урологической практике криоабляция выполняется при раке почки и раке предстательной железы с помощью установок третьего и четвертого поколений на основе аргона и гелия [4—6]. В некоторых экспериментальных и клинических исследованиях продемонстрировано, что криоабляция ткани почки с применением чрескожных открытых или лапароскопических хирургических доступов может быть хорошо переносима [7-9].
Цель исследования. В настоящем исследовании мы стремились оценить влияние низких температур углекислого газа на «живой» кровоснабжаемый орган (свиная почка), определить возможность выполнения криоабляции ткани почки при помощи углекислого газа (карбоксикриоабляция), а также установить опытным путем режимы карбоксикриоабляции почки.
Материалы и методы. В данном эксперименте для карбоксикриоабляции почки нами использовалась свиная самка линии мини-пиг весом 35 кг, возрастом 6 мес. Криоабляция ткани почки нами выполнялась лапароскопическим доступом на «живом» органе с помощью гибкого криозонда Erbecryo-2 компании ErbeElectromedizin (Германия), сконструированного и зарегистрированного для применения в торакальной хирургии для криоэкстракции (опухоль, биопсия ткани, удаление инородного тела, сгустков крови и слизистых пробок), для криореканализации, а также для криодевитализации 10-12]. Холод приводит к кристаллизации внутриклеточной и внеклеточной жидкости. Стенки клеток разрушаются за счет образования кристаллов и перекристаллизации в процессе оттаивания, что способствует девитализации (деструкции) тканей [13-15]. Опыта применения карбоксикриоабляции почечной ткани на установке Erbecryo-2 на момент проведения данного эксперимента в мире не существует.

В настоящем эксперименте для проведения криоабляции ткани почки нами использован гибкий криозонд Erbecryo-2 диаметром 2,4 мм и длиной 1,15 м компании ErbeElectromedizin (Германия). Замораживающий эффект Erberyo-2 основан на эффекте Джоуля-Томсона. Эффект Джоуля-Томсона состоит в изменении температуры газа в результате медленного его протекания под действием постоянного перепада давления сквозь дроссель - локальное препятствие газовому потоку, например через пористую перегородку на пути потока. Температура физического замерзания CO2 составляет минус 78,5°C [16]. Углекислый газ под высоким давлением подается из газового баллона в криозонд (рис. 1) через криохирургическую установку (рис. 2).

Криоустановка позволяет регулировать поток углекислого газа и время замораживания. Проходя через узкую трубку зонда (рис. 3а), углекислый газ попадает в полый наконечник зонда (рис. 3б). В момент перехода из узкой части трубки криозонда в широкую часть наконечника углекислый газ за счет большой разницы давления подвергается резкой декомпрессии. В тот момент за счет эффекта Джоуля-Томсона газ очень быстро охлаждает кончик зонда (рис. 4, фото кончика зонда с ледяным шариком). В зависимости от давления СО2 в системе и размера зонда на кончике гибкого криозонда возможно создание температуры от -35°C до -50°C.
Накануне эксперимента животное не кормили. После премедикации атропином 0,05 мг/кг анестезию вызывали с помощью 10 мг/кг золетил и 0,2 мг/кг ксилазина, введенного внутримышечно. Устанавливалась канюля для ушной вены и после чего животное было интубировано. Анестезию индуцировали следующими препаратами: пропофол 5 мг/кг в/в, веро-пипекуроний 0,02 мг/кг в/в, аерран с кислородом, ингаляционно концентрация - 1,3-3,0%.
Пневмоперитонеум был достигнут при помощи установки иглы Вереша в околопупочное пространство и достижения давления 12 мм рт.ст. После установки 12-мм лапароскопического троакара около пупка животное перемещали в боковое положение, устанавливали два дополнительных порта диаметром 5 мм латеральнее прямой мышцы живота, проксимальнее и дистальнее пупка. После этого по 5 мм троакарам последовательно мы проводили иглу, эндоскопическую пунктирующую (ИЭП), диаметром 3 мм (рис. 5), проводили последовательно пункцию почки в нижнем, среднем и верхнем сегментах почки на глубину 2 см. В последующем по просвету ИЭП проводили в паренхиму почки криозонд (рис. 6). Время криоэкспозиции в нижнем сегменте составило 120 с, время оттаивания - 80 с (рис. 7).
Аналогичные манипуляции выполнены в среднем и верхнем сегментах почки. Время криоабляции в среднем сегменте составило 90 с, время оттаивания криодатчика - 70 с. Время криоабляции в верхнем сегменте составило 60 с, время оттаивания - 60 с. В последующем выполнены нефрэктомия и извлечение почки через разрез по средней линии (рис. 8). По завершении эксперимента животное подверглось эвтаназии введением препаратов, останавливающих сердечную деятельность. Удаленная почка была направлена на гистологическое исследование.
Результаты эксперимента
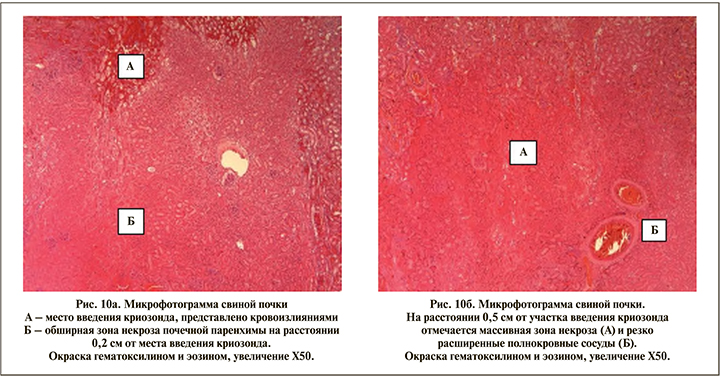
По данным патоморфологического исследования, во всех зонах введения криозонда отмечены массивные кровоизлияния, представленные скоплениями эритроцитов. По периферии участка проникновения криозонда наблюдались массивные зоны необратимой гибели ткани почки (некроз). Зоны некроза включали отдельные клубочки и канальцы с явлениями кариопикноза (ядра в эпителиальных клетках определялись, но резко сморщены и уменьшены) и кариолизиса (местами отмечалось исчезновение ядер в эпителиальных клетках канальцев).
Зона некроза сохранялась на расстоянии 1,0 см от мест внедрения криозонда на всех участках почечной ткани, подвергшейся криоабляции. На всех представленных участках почечной ткани зону некроза окружало демаркационное воспаление — фокусы кровоизлияний, отдельные резко расширенные полнокровные сосуды (рис. 10 а, б).
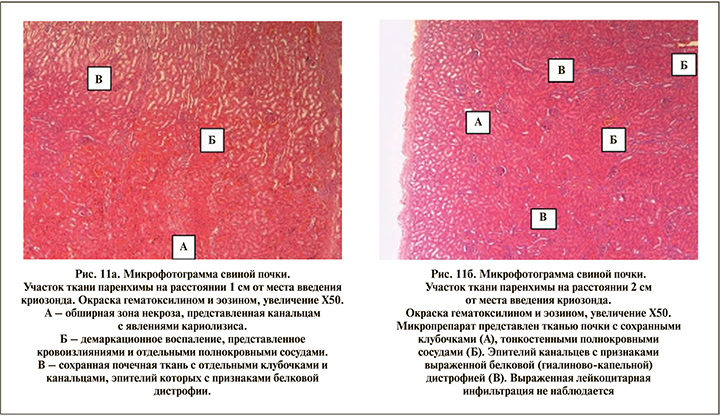
Эпителий канальцев в демаркационной зоне в состоянии белковой (гиалиново-капельной и гидропической) дистрофии. Необходимо отметить, что выраженная инфильтрация полиморфноядерными лейкоцитами, обычно характерная для воспалительной инфильтрации при различных формах некроза, в данном случае не наблюдалась. Присутствовали единичные лейкоциты. На расстоянии 2 и 3 см от мест введения криозондов сохранялись дистрофические изменения эпителия канальцев и присутствовала очаговая лимфомакрофагальная инфильтрация. Кровоизлияния и некроз не распространялись на область почечной лоханки. В некоторых участках переходного эпителия, выстилающего лоханку, отмечены явления гиперплазии. Стенка лоханки инфильтрирована лимфо-макрофагальными элементами с единичными лимфоидными фолликулами в толще стенки.
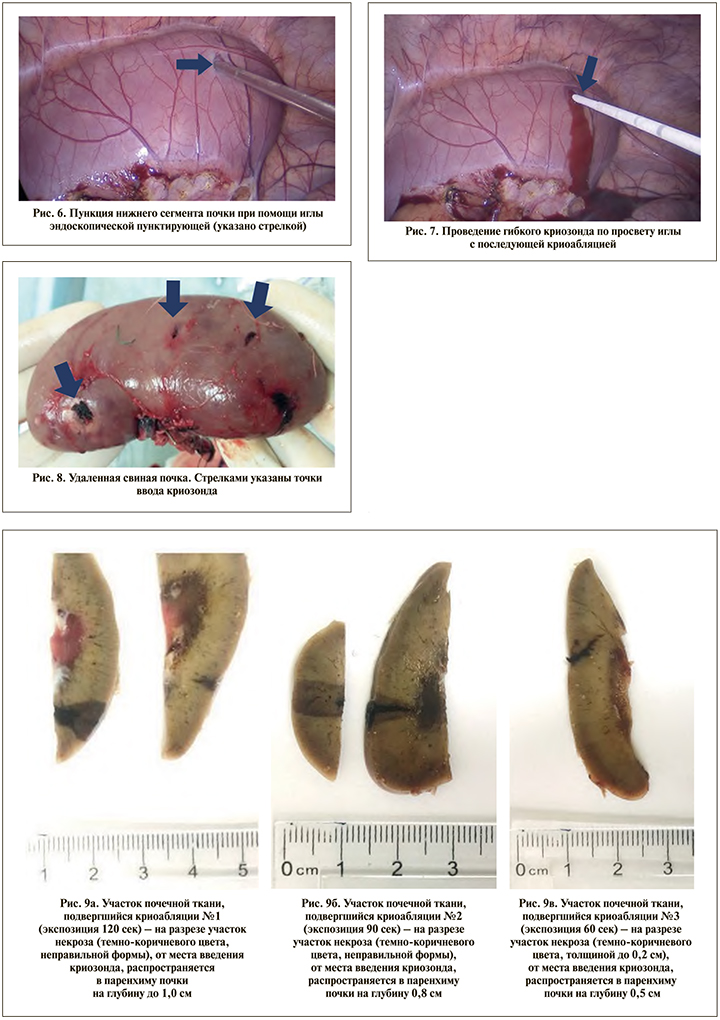
Наиболее обширная зона некроза представлена в нижнем сегменте почки с режимом экспозиции 120 с (участок № 1) — на препарате участок некроза темно-коричневого цвета. От места введения криозонда данные изменения распространяются в паренхиму почки на глубину от 0,3 до 1,0 см. Фрагменты толщиной 0,2 см — зона некроза сохраняется на всех фрагментах.
Выводы. Криоабляция на основе углекислого газа (карбоксикриоабляция) приводит к необратимой гибели (некрозу) и деструкции пораженной почечной ткани. Отмечена прямая взаимосвязь между режимом экспозиции и размерами зоны некроза. Так, наиболее обширная зона некроза диаметром 10 мм достигнута при выполнении криоабляции режимом экспозиции 120 с.
Заключение. Данный эксперимент показал, что криоабляция на основе углекислого газа является выполнимой процедурой, позволяет получать необходимую по размерам зону некроза почечной ткани. Однако считаем, что требуются дальнейшие исследования ее безопасности и эффективности.



