Введение. Уретральный болевой синдром (УБС) – это состояние, при котором без видимых причин появляется персистирующая или рецидивирующая боль в уретре в отсутствие подтвержденной инфекции и других очевидных местных патологических изменений [1]. Считают, что до трети женщин всех возрастов предъявляют жалобы на боли в области уретры, малого таза, дискомфорт при мочеиспускании, половой жизни [2], при этом в 40% наблюдений жалобы обусловлены уретритом и УБС [3]. Как правило, симптомокомплекс УБС считают синонимом клинического диагноза и этот диагноз – диагноз «исключения». Изучение патогенетических аспектов важно в первую очередь для понимания причин возникновения недуга, для назначения эффективного лечения, поскольку четкие рекомендации к профилактике и лечению данного заболевания отсутствуют.
УБС является компонентом хронической тазовой боли, определяющим признаком которой считают отсутствие доказанной инфекции или другой очевидной локальной патологии, которая может объяснить боль [1]. Если в 2010 г. в рекомендациях EAU отмечено, что исследования, которые могли бы ответить на вопрос, как часто может иметь место дизурия в присутствии строго негативных результатов исследований мочевого пузыря и уретры, не проводились [4], то в настоящее время стереотипы, принятые в диагностике заболеваний мочеполовой системы, меняются.
В 2012 г. опровергнут факт наличия стерильности мочи у человека. Геномные подходы к диагностике показали, что традиционные микробиологические методы не позволяют идентифицировать все разнообразие видов микробов, присутствующих в моче [5, 6]. По результатам бактериологического исследования мочи даже у здоровых мужчин и женщин в 100% наблюдений доказано присутствие многокомпонентных аэробно-анаэробных ассоциаций микроорганизмов. Кроме микробиоты в моче показано присутствие в небольшом проценте виробиоты [5]. Не исключается роль микрофлоры в развитии гиперактивности мочевого пузыря [7]. Выявлены отличия микробиот мочи здоровых добровольцев и пациентов с синдромом хронической тазовой боли [8]. Работами Г. А. Осипова (2016) показано, что местом обитания анаэробов могут быть плотные мукопептиды слизистых оболочек кишечника, дыхательных путей, а также урогенитального тракта [9]. Вопрос о локализации вирусо-бактеральных ассоциаций мочеполовой системы остается открытым, не исключена вероятность нахождения этих микроорганизмов непосредственно в тканях мочевого пузыря и уретры, что при неблагоприятном фоне может провоцировать хронический воспалительный процесс и, соответственно, служить фоном для развития функциональных нарушений. Есть основания полагать, что причина развития воспалительного процесса при УБС находится в самих тканях уретры (показано нашими исследованиями ранее [10]) и служит дополнительным стимулом нарушения микроциркуляции, иннервации, функционирования уретры, оказывая косвенное влияние на появление болей.
Поскольку УБС как компонент хронической тазовой боли является полиэтиологическим синдромом, соответственно, и анализ состояния нижних мочевыводящих путей, поиск оптимального подхода к лечению требуют от врача мультимодального подхода [11, 12]. Диагностический арсенал для пациенток с подозрением на УБС включает физикальный осмотр, бимануальное исследование на кресле с пальпацией уретры и стенок влагалища, УЗИ-исследование органов малого таза, в том числе уретры. Причем, при широко применяемом методе исследования нижних мочевыводящих путей (цистоскопии) уретра остается неосмотренной.
Многообещающим методом исследования изменений в структуре уретральной стенки является оптическая когерентная томография (ОКТ) [13]. Будучи методом прижизненной визуализации, ОКТ имеет пространственное разрешение порядка 10–15 мкм при глубине зондирования 1–1,5 мм.
ОКТ относится к методам так называемой мезоскопии и позволяет характеризовать изменения нормальной структуры тканей при развитии патологии на уровне их общей архитектоники (по свойствам общего обратного рассеяния зондирующего излучения). Использование поляризационно-чувствительных разновидностей метода (поляризционно-чувствительная (ПЧ) ОКТ и кросс-поляризационная (КП) ОКТ), дает возможность регистрировать изменения состояния волокнистых компонентов тканей (например, коллагеновых волокон) по свойствам двулучепреломления и кросс-рассеяния, позволяя прицельно анализировать только эти структуры [14, 15].
Несмотря на значительный мировой опыт применения метода ОКТ во многих областях медицины, в том числе в урологии (для дифференциации воспалительных и опухолевых процессов мочевого пузыря [16], выявления рака простаты и определения границ резекции [17], рака мочеточников [18]), для исследования стенок женской уретры у больных с УБС метод ранее не применялся.
В работе представлены передовой опыт нашей исследовательской группы по изучению состояния уретры прижизненным методом визуализации – КП ОКТ и результаты проведенного анализа микрофлоры тканей уретры.
Цель работы: поиск пусковых факторов возникновения УБС и характера изменений тканей уретры с использованием данных: 1) о сопутствующих заболеваниях, 2) о структурных изменениях тканей уретры при УБС по сравнению с их состоянием при хронических воспалительных заболеваниях нижних мочевыводящих путей, 3) о составе микрофлоры тканей уретры.
Материалы и методы. Изучено состояние уретры 109 пациенток: из них 55 с УБС (гр. УБС), не имевших клинических проявлений воспаления; 41 – с воспалительными заболеваниями нижних мочевыводящих путей инфекционного генеза (гр. В); у 13 пациенток с камнями верхних мочевыводящих путей без явлений пиелонефрита уретра принята за норму (гр. Н). Всем выполняли клинический минимум исследований, включивший анализ крови, мочи, посев мочи на флору, УЗИ мочевыводящих путей; осмотр на гинекологическом кресле наружного отверстия уретры, пальпацию уретры через переднюю стенку влагалища, пальпацию стенок влагалища, пробу О´Доннела–Хиршхорна; цистоскопию, совмещенную с КП ОКТ исследованием шейки мочевого пузыря и уретры. Для определения возможной роли фоновых заболеваний в развитии УБС, у пациенток выполнен анализ сопутствовавших заболеваний, которые по анамнезу предшествовали развитию УБС.
Для сравнительного анализа изменений тканей уретры при воспалительных заболеваниях и при УБС применили метод прижизненного исследования тканей уретры – КП ОКТ. В работе использован прибор «ОКТ-1300У», работающий на длине волны 1300 нм и обеспечивающий получение изображений размером 1,7 (ширина) х 2,4 (высота) мм. Каждое изображение состоит из двух частей: на нижнем изображении (в ко-поляризации) видна общая слоистая структура ткани, сигнал на верхнем изображении (в кросс-поляризации) появляется только в случае наличия в ткани анизотропных компонентов (коллагеновых и эластических волокон). По нижнему изображению легче судить о состоянии эпителия (определять норму, атрофию, дисплазию и малигнизацию). Состояние подэпителиальных слоев (слизистого и подслизистого) проще оценить по характеру и интенсивности сигнала на верхнем изображении. Анализ обоих изображений позволяет выявлять признаки воспаления, фиброза, опухолевого перерождения и другие состояния ткани [16, 19]. КП ОКТ исследование тканей уретры проводили одновременно с цистоскопией. Гибкий эндоскопический зонд с внешним диаметром 2,7 мм вводили через рабочий канал цистоскопа («Karl Storz», Germany) размером 8 Ch. В среднем у каждой пациентки получено по 3–4 КП ОКТ изображения уретры и шейки мочевого пузыря; всего проанализировано 303 изображения. На КП ОКТ изображениях проксимального, среднего и дистального сегментов уретры, а также шейки мочевого пузыря измерены толщины эпителиального и соединительнотканного слоев. Измерения проведены независимым респондентом с использованием стандартных функций программы Image J ручным способом. Ранними проявлениями болезни считали длительность УБС до года, поздними – более 1 года. Статистический анализ данных по изменению толщины слоев тканей уретры в связи с длительностью заболевания и в зависимости от возраста пациенток выполнен по стандартной методике с использованием пакета «Statistica-12». Анализ групповой линейной динамики возрастных изменений толщины тканей уретры (ВИТТУ) для эпителия и соединительной ткани выполнен в трех сегментах уретры и в шейке мочевого пузыря. Графическая аппроксимация линейного группового тренда ВИТТУ выполнена в приложении MS Excel.
Для анализа связи изменений в тканях уретры с составом ее микрофлоры выполнено ПЦР-исследование биоптатов из проксимального сегмента уретры – наибольшего по протяженности отдела уретры, расположенного выше структур тазового дна. Это позволило минимизировать функциональные нарушения травматического генеза после манипуляции взятия биопсии, поскольку наряду со щипковой в процессе цистоскопического исследования некоторым пациенткам выполняли петлевую биопсию резектоскопом. Фрагменты тканей от 13 больных УБС помещали в транспортную среду для биопроб «Стор-Ф» (ДНК-Технология, Россия). Накопление образцов происходило в холодильнике при температуре заморозки -70°С. Для ПЦР-исследования использовали набор реагентов ФЕМОФЛОР®-16 для исследования биоценоза урогенитального тракта у женщин методом ПЦР в режиме реального времени («НПО ДНК-Технология», Россия).
Результаты
1. Роль фоновых заболеваний в развитии УБС
Результаты анализа сопутствующих заболеваний у пациенток с УБС, выявленных в анамнезе, представлены в табл. 1.

Из данных табл. 1 следует, что каждая пациентка, страдавшая УБС, имела 2,94 (162/55) случая сопутствовавшей патологии. Преобладающими были гинекологические заболевания (70,9%): гормональные отклонения выявлены у 37(94,8%) пациенток, из них 24 сексуально активных женщин доменопаузального периода и 13 женщин менопаузального периода; воспалительные заболевания женской половой сферы бактериальной и вирусной этиологии были зафиксированы у 30 (76,9%) пациенток.
Заболевания верхних дыхательных путей в анамнезе, чаще в юности, зафиксированы у 67,2% женщин, из них основная масса (64,9%) пациенток отмечали частые вирусные заболевания (ОРВИ), герпетическую инфекцию. Преморбидным фоном для пациенток с УБС были/есть неврологические заболевания (63,6%), причем это заболевания, связанные с вовлечением периферической нервной системы и, что немаловажно, с состоянием психоэмоциональной сферы.
Таким образом, роль факторов наличия в организме очагов хронической инфекции и снижение факторов иммунной защиты как коморбидного фона для развития УБС отрицать нельзя, поскольку наличие в анамнезе воспалительных заболеваний дыхательных путей, желудочно-кишечного тракта, урологических и гинекологических органов выявлено у 55 больных в 146 из 162 эпизодов.
2. Изменения в тканях уретры при УБС и хроническом воспалении, выявленные методом КП ОКТ
Качественное сравнение толщины слоев уретральной стенки и характера КП ОКТ сигнала в исследуемых группах пациенток позволило установить, что состояние эпителия и соединительнотканных структур слизистой оболочки у больных УБС не является нормой, изменения схожи с таковыми при хроническом воспалении (рис. 1). Изменения характера ОКТ-сигнала при патологии зафиксированы во всех отделах уретры, однако в средней трети они наиболее выражены (зона локализации мышечных структур, входящих в состав сфинктерного механизма), поэтому для демонстрации типичных нарушений в структурной организации слоев уретральной стенки на рис. 1 представлены КП ОКТ изображения именно этого отдела для трех сравниваемых групп. Нижняя часть каждого изображения – ко-поляризация, верхняя часть – кросс-поляризация.

В норме (рис. 1а) в ко-поляризации хорошо различим верхний эпителиальный слой (на рисунке обозначен звездочкой), подлежащий яркий соединительнотканный слой в ко- и кросс-поляризациях имеет одинаковую толщину, повторяемый рисунок и ровную нижнюю границу (сигнал с глубиной затухает равномерно вдоль изображения). На изображениях (рис. б, в) в ко-поляризации наблюдаются истончение эпителиального слоя, в кросс-поляризации – фиброз подэпителиальных структур; на (рис. г) в ко-поляризации заметна частичная атрофия эпителия, в кросс-поляризации – экссудативный отек соединительной ткани (существенное снижение сигнала); на (рис. д, е) в ко-поляризации выявлена резкая атрофия эпителиального слоя, в кросс-поляризации – значительное утолщение и уплотнение соединительнотканных структур, эффект двулучепреломления (указан стрелками) – свидетельство их выраженного фиброза.
В случаях патологического изменения стенки уретры (рис. 1 б–е) соединительнотканный слой имеет в ко- и кросс-поляризациях разную толщину (рис. 1 в–д), не совпадающий рисунок структур (рис. 1 д, е) и неровную нижнюю границу (рис. 1 б–е). Таким образом, при УБС ярко выражена реорганизация компонентов соединительнотканной стромы. Выраженный фиброз подэпителиальных структур (увеличение яркости сигнала в кросс-канале по сравнению с нормой) с их утолщением зафиксирован в 48,2% наблюдений, а истончение/отсутствие визуализации эпителиального слоя выявлено в 20,5% (рис. 1 г, д). При хронических воспалительных заболеваниях, по данным КП ОКТ, в структуре уретры явления фиброза выявлены в 55,5% наблюдений, а гипо- и атрофия эпителия – в 40,6% (рис. 1 б, в). При сравнении изображений в ко- и кросс-поляризациях (нижняя часть с верхней) при патологическом изменении стенки уретры (рис. 1 б–д) видно, что соединительнотканный слой во всех случаях имеет неровную нижнюю границу (сигнал с глубиной затухает неравномерно вдоль изображения) (рис. 1 б–д), а также либо разную толщину (рис. 1 в, г), либо несовпадающий рисунок структур (рис. 1 г, д).
У женщин репродуктивного возраста (до 49 лет), имевших УБС, по результатам КП ОКТ исследования обнаружен факт различий в состоянии проксимальной 1/3 уретры и ее дистальных 2/3. В проксимальной части по КП ОКТ, как правило, выявлялись такие же изменения, как в шейке мочевого пузыря, вплоть до гиперплазии эпителия, при этом в дистальных 2/3 уретры чаще наблюдалась гипо- и атрофия эпителия.
Анализ эффекта возрастных изменений толщины тканей уретры, проведенный во всех трех категориях исследуемых групп, показал, что имеет место уникальный характер их групповых изменений. Так, для группы УБС эти изменения соответствуют промежуточному положению относительно нормы и группы воспаления. При этом эпителий тоньше нормы, а соединительнотканная строма значительно утолщена. На рис. 2 представлен пример графиков линейной аппроксимации ВИТТУ в среднем сегменте уретры при УБС, воспалении и норме для эпителия и соединительнотканной стромы в зависимости от длительности заболевания.
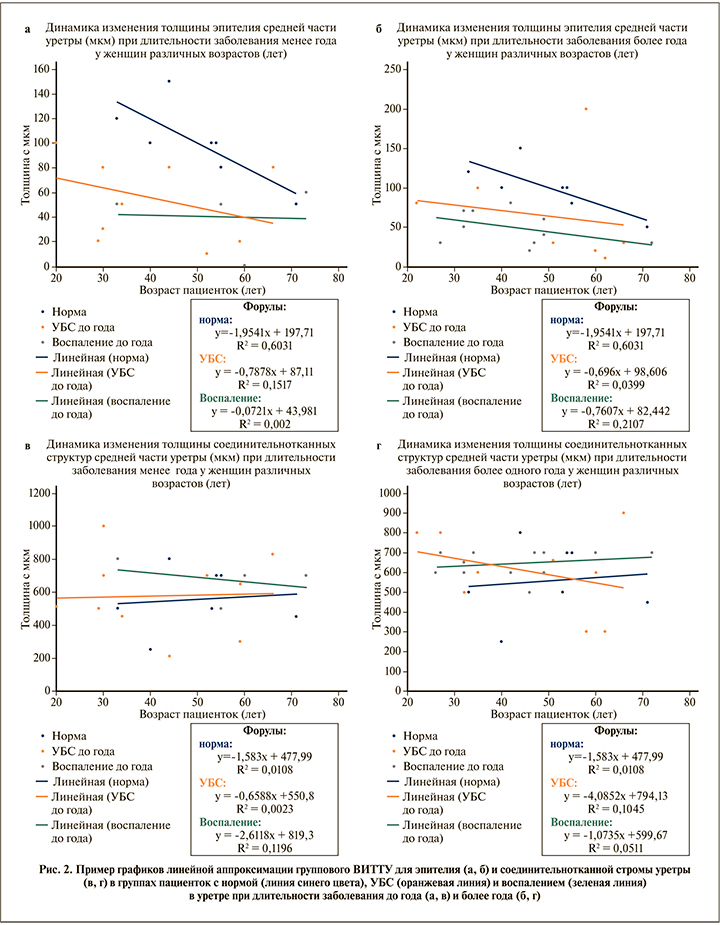
Прослеживается общая тенденция истончения эпителия и увеличение толщины соединительнотканных структур и при воспалении, и при УБС, и эти изменения зависят от возраста во всех группах, что, несомненно, связано с гормональными процессами в организме женщин (рис. 2 а, б).
3. Исследование микрофлоры тканей проксимального сегмента уретры
Результаты ПЦР-исследования биоптатов из проксимального сегмента уретры представлены в табл. 2.
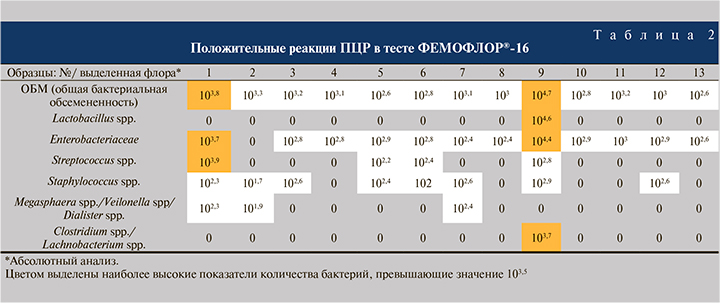
Полученные результаты свидетельствуют о том, что только у одной пациентки (№ 9) выявлена существенная бактериальная обсемененность биоптата (ОБМ=104,7). Основные виды, составившие общую обсемененность у этой пациентки, оказались Lactobacillus spp. (104,6) и бактерии, относящиеся к семейству Enterobacteriaceae (104,4). Более того, у пациентки №9 найдены облигатные анаэробы из группы Clostridium spp./Lachnobacterium spp. (103,7), которые могут участвовать в развитии бактериального вагиноза, тогда как у остальных 12 пациенток бактерии этой группы не обнаружены. Еще у одной пациентки (№ 1) в биоптате уретры были определены бактерии в меньшем, но значимом количестве (ОБМ=103,8). Основную массу бактерий у этой пациентки составили Streptococcus spp. (103,9) и бактерии, относящиеся к семейству Enterobacteriaceae (103,7). Во всех остальных случаях общая бактериальная обсемененность биоптатов была на уровне отрицательного контроля (образец, в который не добавлялась ДНК от пациентов). Низкие значения по отдельным показателям теста ФЕМОФЛОР®-16, представленные в табл. 2, также не могут быть расценены как достоверно положительные.
Обсуждение
Уникальным современным методом неинвазивного исследования структуры тканей является метод ОКТ, имеющий разрешение, близкое к клеточному (порядка 10–15 мкм). Метод дает возможность оценить состояние биологических тканей на глубину до 2 мм. Использование в качестве зондирующего излучения поляризованного света в варианте КП ОКТ позволяет оценивать состояние соединительнотканных структур мочевого пузыря и уретры [20, 21].
Возрастные изменения толщины тканей уретры при УБС свидетельствуют об их промежуточном положении относительно нормы и воспаления. Показанный нами ранее факт значительной скорости изменений толщины эпителия при хроническом воспалении по сравнению с незначительными изменениями при УБС в ранние сроки заболевания и факт преобладающих изменений толщины соединительнотканной стромы при УБС в поздние сроки заболевания по сравнению с изменениями при хроническом воспалении [10] стали стимулом к проведению настоящего исследования. Выявлено, что на структурном уровне патогенез УБС связан с наличием изменений в соединительнотканной строме. Это выражается в повышении глубины и уровня кросс-рассеяния на КП ОКТ изображениях (выраженный фиброз), которые встречаются в 48,2% наблюдений, вплоть до появления эффекта двулучепреломления [22, 23]. При этом в 32,5% наблюдений выявлено снижение сигнала на КП ОКТ изображениях, что, вероятно, связано с латентно текущим воспалительным процессом.
В свою очередь анализ сопутствующих заболеваний у пациенток с УБС свидетельствует о наличии у женщин в анамнезе воспалительных процессов различных локализаций, которые могли создать преморбидный фон для развития УБС. Известно, что в основе хронизации любого воспалительного процесса лежит транзиторная дисфункция иммунной системы, в том числе функциональная недостаточность фагоцитарного звена [24]. Причем инфекционный агент способен персистировать внутри макрофага. Макрофаги же служат эффектором хронического воспаления с преобладанием пролиферативно-склерозирующего компонента [25]. В настоящее время значительное количество работ выполнено по изучению микросимбиоценоза репродуктивного тракта женщин. Совместное влияние доминантных микроорганизмов в репродуктивном тракте женщин и факторов эндогенной защиты хозяина продолжают изучаться [26]. Группой ученых получены данные о значимых коэффициентах корреляции между видами микроорганизмов, выделенных из мочи и толстого кишечника одного и того же пациента, что косвенно подтверждает наличие у микроорганизмов транслокационного механизма [27]. Кроме того, исследования Ю. Л. Набока и соавт. (2019) пациенток с инфекцией мочевыводящих путей показали микробные взаимосвязи органов мочевой системы с соседними биотопами (кишечник и влагалище). Полученные авторами значимые коэффициенты корреляции между различными таксонами микробиоты в трех изучаемых биотопах доказывают связь этих локусов [28].
В работе [6] представлен обзор современной литературы по исследованию микробиоты органов мочеполовой системы методами хромато-масс-спектрометрии и секвенирования мочи, который отражает случаи заражения потенциально-патогенными микроорганизмами, при том что рутинные исследования мочи были отрицательными. Данные о микробиоценозе тканей уретры (в частности, проксимального фрагмента) в доступной нам литературе не выявлены.
В проведенном исследовании микробного состава биоптата из уретры у 2 (15%) пациенток из 13 обнаружена значимая бактериальная обсемененность (103,8 и 104,7). У пациентки №1 с ОБМ=103,8 наибольший вклад в общую обсеменность был связан со Streptococcus spp. и Enterobacteriaceae. У этой пациентки в возрасте 59 лет, находившейся в менопаузе, в качестве сопутствовавшего заболевания отмечен рецидивирующий бактериальный вагинит. У другой пациентки (№9) в возрасте 31 года, с наибольшей бактериальной обсемененностью биоптата уретры (ОБМ=104), связанной с Lactobacillus spp. (104,6), Enterobacteriaceae (104,4) и Clostridium spp./Lachnobacterium spp. (103,7), в анамнезе имел место хламидиоз, пациентка в течение многих лет предъявляла жалобы на жжение в уретре. В качестве сопутствовавшего заболевания у пациентки выявлен кондиломатоз вульвы. Таким образом, обе женщины имели симптоматику и сопутствовавшие заболевания, связанные с генитальным трактом.
Проведенное пилотное исследование (ПЦР-анализ тканей проксимального отдела уретры) свидетельствует о возможном участии бактерий в развитии воспалительных процессов в урогенитальном тракте, по крайней мере у части пациенток. В двух наблюдениях бактерии выявлены в значимых количествах (>103,5). Причем у этих пациенток прослеживается связь с гинекологическими инфекционно-воспалительными заболеваниями. В 85% наблюдений присутствие бактериальной флоры выявлено в столь незначительных количествах, что участие их в патогенезе развития УБС маловероятно. Установление роли бактерий в инициации патогенеза заболевания у части пациенток требует дополнительных исследований.
Выводы
У пациенток с УБС выявлено наличие нескольких сопутствовавших, часто хронических заболеваний, что может служить преморбидным фоном и одним из пусковых факторов возникновения, а главное – поддержания УБС.
Примененный в данной работе метод КП ОКТ – на сегодняшний день единственный прижизненный метод визуализации слизистой оболочки уретры, который в режиме реального времени дает представление о структурных изменениях в эпителиальном (атрофия или гиперплазия) и соединительнотканном (активное или латентное воспаление с клеточной инфильтрацией или фиброз) слоях уретры, позволяя лучше понимать патогенез заболевания и проводить мониторинг проводимой терапии.
Проведенные пилотные ПЦР-исследования биоптатов из проксимального сегмента уретры свидетельствуют о том, что бактерии в тканях уретры присутствуют, но в 85% наблюдений их концентрация расценена как крайне несущественная – не способная влиять на патогенетические процессы. Однако для части пациенток значение бактериального фактора не исключается. Бесспорно, необходимы дальнейшие исследования для понимания патогенеза этой социально значимой группы заболеваний.



