Введение. Инфекции мочевыводящих путей занимают значимое место среди всех бактериальных инфекций.
В структуре урологических заболеваний одним из наиболее интересных и сложных вопросов остается проблема острого пиелонефрита, его серозной и гнойной фаз воспаления. Высокая распространенность, риск рецидивов и реинфекций, а также не всегда гладкое течение острых воспалительных процессов в почках требуют скрупулезного эпидемиологического, этиологического и патогенетического изучения [1]. Около трети всех эпизодов острого воспаления вызывают рубцовое замещение здоровой ткани паренхимы и в итоге приводят к сморщиванию почки. Острому пиелонефриту отводится значительное место в структуре всех случаев госпитализации в стационары. Жизнеугрожающая форма гнойного воспаления встречается в 16% наблюдений. Неправильная диагностика и лечение могут быть причиной сепсиса и приводить к летальному исходу [2].
Врачу исключительно важно понимать и уметь дифференцировать воспаление почечной ткани по форме (серозная или гнойная), выявлять нарушения уродинамики (осложненный или неосложненный пиелонефрит). В патогенезе воспалительных заболеваний почек огромное значение имеют расстройства иммунологического статуса [3].
В ходе эволюции в организме произошло становление систем газообмена и транспорта питательных веществ. Необходимая потребность в обеспечении питательными веществами достигается за счет ряда механизмов [4, 5].
У позвоночных эритроциты осуществляют функцию переноса газов посредством гемоглобина, а перенос биологически активных молекул (полипептидов, цитокинов, гормонов и др.) происходит в сорбированном виде на поверхности мембраны или с помощью включений в билипидном слое мембраны, что свидетельствует о многогранности данной системы транспорта в организме [6–8].
У эритроцитов отсутствуют ядра и органеллы, способность к транскрипции и трансляции. В то же время у них имеются механизмы для связывания продуктов воспаления и компонентов патогенов, для выделения собственных биологически активных соединений, а также удаления циркулирующих иммунных комплексов и т.д. Кроме того, гемоглобин и гем, способных генерировать активные формы кислорода, а также потенцировать воспалительные и аутоиммунные реакции, участвуют в функционировании врожденного иммунитета [9, 10].
Способность эритроцитов противостоять различным патогенам в условиях сепсиса, избытке эндотоксинов и медиаторов воспаления свидетельствует об их важнейшей роли в защите организма. В различных условиях эритроциты способны демонстрировать про- или противовоспалительную активность [11].
Красные кровяные клетки способны меняться не только при гематологической патологии, но и при заболеваниях другой этиологии. Сравнительно простое строение эритроцитов позволяет довольно легко исследовать строение и функцию мембраны, что дает возможность шире трактовать известные научные факты о данной клетке [12, 13].
Отсутствие значительных публикаций о структуре и функции эритроцитов при воспалительных заболеваниях почек определяет необходимость их исследования с целью разработки способов коррекции выявленных изменений.
Цель исследования: изучить особенности структуры и функциональных свойств эритроцитов при остром серозном и гнойном пиелонефрите до и после стационарного лечения.
Материалы и методы. В исследовании участвовали 78 женщин в возрасте 52,7±3,8 года, проходивших стационарное лечение в урологическом центре ЧУЗ «Центральная клиническая больница "РЖД-медицина"» (Москва) с установленным диагнозом: острый серозный (ОСП) или острый гнойный (ОГП) пиелонефрит. Критерии включения: информированное согласие на участие в исследовании, подтвержденный клинический диагноз ОГП или ОСП, односторонний воспалительный процесс, переносимость использованных в исследовании фармакологических препаратов. Критерии невключения: отказ от участия в исследовании; двусторонность воспалительного процесса; сопутствующие заболевания в стадии неполной ремиссии или обострения; инфекции, передаваемые половым путем; аллергические реакции на препараты.
Диагностика форм острого пиелонефрита основывалась на обнаружении системной воспалительной реакции в виде повышения температуры тела, озноба, увеличения частоты дыхательных движений, тахикардии; лейкоцитоза с палочкоядерным сдвигом лейкоцитарной формулы; лейкоцитурии; бактериурии более 104 КОЕ/мл; расширения чашечно-лоханочной системы и обнаружении блокированной почки (по данным УЗИ, экскреторной урографии или МСКТ).
Пациентам с ОСП (1-я группа, n=48) проводились антибактериальная инфузионная терапия, включившая изолированный или комбинированный прием препаратов различных групп (цефалоспорины, фторхинолоны, аминогликозиды), а также лечение с дезинтоксикационной и противовоспалительной целью.
Больным ОГП (2-я группа, n=30) выполняли чрескожную пункционную нефростомию (ЧПНС) под ультразвуковым контролем. По завершении дренирования начинали лечение, аналогичное таковому, которое получали пациентки 1-й группы.
Забор образцов биологического материала (кровь) осуществляли дважды общепринятым методом: при госпитализации в лечебное учреждение и при выписке (7-е-10-е сутки).
Контрольная группа представлена 15 здоровыми женщинами того же возраста.
В исследовании определяли сорбционную способность эритроцитов (ССЭ) и сорбционную емкость их гликокаликса (СЕГ) [14]. Перекисное окисление липидов (ПОЛ) оценивали по общепринятым методикам, определяя в плазме крови уровень ацилгидроперекисей (АГП) и малонового диальдегида (МДА). Антиоксидантную систему красных кровяных клеток исследовали с помощью иммуноферментного анализа («Bender Medsystems» – для определения активности фермента супероксиддисмутазы (СОД) и «Cayman Chemical» – каталазы). Оценку антиокислительной активности (АОА) проводили с помощью метода, основанного на уровне ингибирования различных видов окисления твина-80 до МДА. Для определения уровня стабильных метаболитов оксида азота (СМNO) применяли спектрофотометрический метод с использованием реактива Грисса [15].
Для получения мембран эритроцитов использовали метод G. T. Dodge [16]; метод U. K. Laemli применяли для электрофореза белков мембран [17]; окрашивание электрофореграмм проводили по методике G. Fairbanks с использованием красителя Кумасси R250 [18].
Для денситометрирования электрофореграмм использовали лазерный денситометр «Ultroscan XL». Программу OneDscan применяли для идентификации и расчета фракций белка. Расчет количественного содержания белковых фракций выполняли с учетом полученной площади изучаемого белка, а также с учетом площади и известной массы сывороточного альбумина человека – маркерного белка. По установленной массе (в мкг) проводили расчет во фракциях концентрации белка с последующим выражением результата в микрограммах на 1 мкл общего белка мембраны (в мг%). Метод жидкостной тонкослойной хроматографии использовали для определения липидов в мембране эритроцитов. Для идентификации фракций липидов применяли стандарт компании «Sigma» (США). Полученные хроматограммы оценивали с помощью программы OneDscan денситометрическим методом [19].
Статистический анализ результатов проводили на основании критериев вариационно-статистического анализа (вычисление средних величин (M), ошибки средней арифметической (m), с использованием для сравнения количественных данных U-теста Манна–Уитни). Статистически значимыми считали различия при p=0,05.
Результаты исследования. У пациентов с ОСП до старта терапии выявлен рост уровня лишь одного представителя исследованных белков мембраны циркулирующих эритроцитов из 12, а именно тропомиозина. После проведенного лечения представительность его в мембране эритроцитов не отличалась от таковых здоровых доноров. При ОГП перестройка белков мембраны красных кровяных телец была существенно более выраженной, так как установлено уменьшение в эритроцитарной мембране количества β-спектрина на 13%, анионтранспортного белка (АТБ) на 17,1%, белка полосы 4,1 на 11,9%, белка полосы 4,5 на 7,8%, глицеральальдегид-3-фосфатдегидрогеназы (Г-3-ФД) на 20,8%, актина на 17,2%, глутатион-S-трансферазы (Г-S-Т) на 22,2%, увеличение представительности α-спектрина на 16,5%, еще статистически значимо большее по сравнению с серозной формой увеличение содержания тропомиозина на 19,7%, при этом уровни анкирина, паллидина и белка 4,9 (дематина) оставались на уровне здоровых. После проведенного стандартного лечения ОГП в мембране эритроцитов нормализовалось содержание β-спектрина, белка полосы 4,1, дематина, Г-S-Т и приближалась к значениям здоровых представительность актина и тропомиозина (рис. 1).

У больных серозной формой острого пиелонефрита при госпитализации в отделение урологии определено уменьшение в эритроцитарной мембране количества фосфатидилхолина (ФХ) на 37,6%, глицерофосфолипидов (ГФЛ; это сумма ФХ, лизофосфатидилхолина (ЛФХ), фосфатидилэтаноламина (ФЭ), фосфатидилсерина (ФС), фосфатидилинозитола (ФИ)) на 6,4%, рост содержания свободного холестерола (Х) на 32,9%, эфиров холестерола (ЭХ) на 13,9%, ЛФХ на 44,8%, неэстерифицированных жирных кислот (НЭЖК) на 25%, триацилглицеролов (ТАГ) на 24,4%, при сохранении представительности на уровне здоровых доноров фосфатидилэтаноламина (ФЭ), фосфатидилсерина (ФС), фосфатидилинозитола (ФИ), сфингомиелина (СМ), фосфолипидов (ФЛ – сумма ГФЛ и СМ), суммы моно- и диацилглицеролов (ДАГ+МАГ). При рассмотрении липидных фракций установлено увеличение соотношений Х/ФС+ФИ, Х/ФЛ, ЛФХ/ФХ при снижении ФХ+СМ/ФЭ+ФС+ФИ и ФХ/ФЭ. После проведенного лечения нормализовались все измененные показатели фракций липидов, за исключением НЭЖК и коррекции содержания ФХ, ЛФХ соотношения ЛФХ/ФХ, без изменений остальных измененных до лечения соотношений фракций липидов (рис. 2, табл. 1).

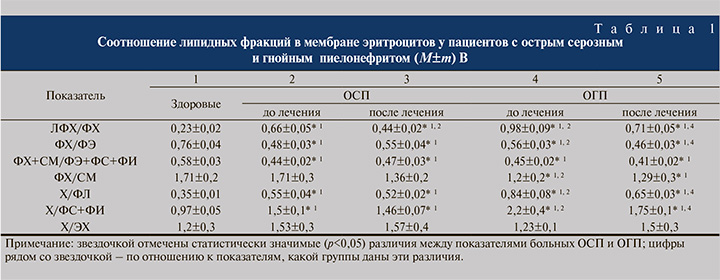
При изучении спектра липидов в мембране красных клеток периферической крови пациентов с гнойной формой острого пиелонефрита выявлены более значительные изменения по сравнению с серозной формой заболевания: снижение содержания ФЭ на 30%, ФХ на 50,9%, ФС на 16,8%, ФИ на 22,5%, ГФЛ на 20%, ФЛ на 22%, СМ на 28%, рост количества Х на 46,2%, ЛФХ на 49,9%, ЭХ на 44,3%, ТАГ на 35,1%, НЭЖК на 13,2% при сохранении представительности на уровне доноров ДАГ+МАГ. При изучении фракций липидов выявлен значительный рост соотношения ЛФХ/ФХ, Х/ФЛ, Х/ФС+ФИ при снижении ФХ/СМ. После общепринятой терапии нормализовалась представительность ФЭ, ФС, ГФЛ, корригировалось содержание ФХ, ЛФХ, ФИ, СМ, ФЛ, Х, ЭХ, соотношения ЛФХ/ФХ, ФХ/ФЛ, Х/ФЛ, Х/ФС+ФИ, остались без изменения по сравнению с параметрами до лечения значения ТАГ, НЭЖК, сумма ДАГ и МАГ, отношение ФХ+СМ/ФЭ+ФС+ФИ, ФХ/СМ и Х/ЭХ (рис. 2, табл. 1).
Как вероятную причину нарушений белково-липидной мембраны эритроцитов считают усиление процессов ПОЛ на системном и локальном (в эритроцитах) уровне [20–22].
До лечения у больных ОСП установлено усиление ПОЛ внутри эритроцитов (увеличение уровня АГП и МДА в эритроцитах). Показано уменьшение общей ССЭ, не выявлено нарушений антиоксидантной защиты (ОАА, активность ферментов СОД и каталазы) (табл. 2).
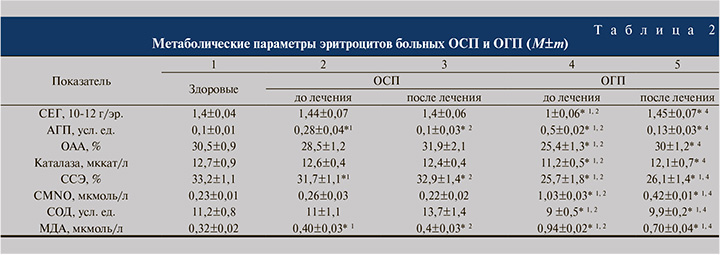
У пациентов с гнойной формой пиелонефрита выявлено более значительное усиление процессов ПОЛ (МДА и АГП возросли в 2,7 и 3,5 раза соответственно), ослабление антиоксидантной системы организма (ОАА в 1,3 раза, СОД и каталаза соответственно в 1,3 и 1,4 раза), увеличение уровня СМNO в 4 раза и уменьшение адсорбционных характеристик эритроцитов (СЕГ и ССЭ соответственно в 1,5 и 1,3 раза). Проведенное стандартное лечение улучшило показатели внутриэритроцитарного метаболизма следующим образом: нормализовало ОАА, СЕГ, уровень АГП, активность каталазы, корригировало, но не нормализовало ССЭ, концентрацию МДА, СМNO и активность СОД (см. табл. 2).
Обсуждение. Анализируя полученные в наших исследованиях данные, можно резюмировать: при серозной, особенно гнойной формах острого пиелонефрита внутри эритроцитов возникает «окислительный стресс» с уменьшением сорбционной способности эритроцитов, в мембране отмечается выраженное снижение ФЛ при повышении Х, ТАГ, ЛФХ, НЭЖК, увеличивается соотношение Х/ФЛ, ЛФХ/ФХ, Х/ФС+ФИ, уменьшается соотношение ФХ/СМ, ФХ+СМ/ФЭ+ФС+ФИ, ФХ/ФЭ, отмечается изменение фракций белков, определяющих форму и гибкость плазматической мембраны (актин, тропомиозин), внутриэритроцитарный метаболизм (Г-3-ФД, белок полосы 4,5, Г-S-Т, АТБ), стабильность и структуру каркаса мембраны (белок полосы 4,1, анкирин, α- и β-спектрин, АТБ, паллидин, дематин).
Транспортные функции эритроцита должны соответствовать ряду характеристик. К ним относятся сохранение высокого уровня и полной функции гемоглобина, структуры и функции мембраны, взаимодействия различных форм гемоглобина и структур мембраны, способность к формообразованию и обратимой деформируемости, которые позволяют красным кровяным клеткам достаточно быстро перемещаться в сосудистом русле и межклеточном пространстве, осуществлять поддержание структуры и архитектоники эпитопов. Помимо сохранения данных характеристик эритроцит должен иметь способность к обратимым трансформациям в постоянно изменяющихся условиях. Выполнение этих функций гарантируется структурой плазматических мембран эритроцитов, а также особенностями проходящих в них биохимических процессов [23].
Каркас плазматической мембраны эритроцитов составляет двойной слой фосфолипидов с белками, встроенными в асимметричном порядке. ФЛ стабилизируют расположение в мембране белков (периферических и интегральных). Нарушение соотношений фосфолипидов имеет огромное значение для реализации функции мембран клеток. Липидные молекулы в мембране определяют условия для функции белков, которые принимают нативное состояние. Интегральные белки играют роль ферментов для гидролиза, рецепторов клеток, компонентов окислительно-восстановительных процессов системы транспорта электронов, специализированных переносчиков аминокислот, ионов и т.д. Кроме того, белки мембраны воздействуют на липидную основу, влияя на структуру с ограничением движения жирнокислотных радикалов [24, 25].
Ведущее значение в поддержании двуслойного строения плазматических мембран лежит на сфингомиелине, фосфатидилхолине и фосфатидилэтаноламине. Фосфатидилэтаноламин и фосфатидилхолин – специализированные активаторы ферментов биомембран, способных воздействовать на стволовые клетки, усиливать кроветворную функцию, активировать мононуклеары, а также способствовать антиокислительной функции липидного слоя плазматических мембран эритроцитов. Сфингомиелин, содержащий остатки в основном насыщенных жирных кислот, обеспечивает наличие микровязкости липидов мембраны. Отношение ФХ/СМ предопределяет ряд функций эритроцитов: гемолитическую и осмотическую устойчивость, термостабильность и длительность циркуляции в кровеносном русле.
При повышении содержания ЛФХ и отношения ЛФХ/ФХ возникает цитолиз, сопровождающийся повышением проницаемости плазматических мембран и усилением агглютинации эритроцитов, при увеличении отношения Х/ФС+ФИ происходит активация ПОЛ.
Холестерин, как и ФЛ, является важной частью липидной фазы плазматических мембран. СМ и Х связаны с белками, которые участвуют в передаче сигнала между клетками. Важнейшей функцией холестерина является влияние на состояние мембран. Высокий уровень холестерина способствует уменьшению мобильности жирных кислот, снижению диффузии белков и липидов, а также увеличению объема и изменению формы эритроцитов. Повышение отношения холестерин/фосфолипиды в плазматических мембранах вызывает снижение проницаемости для воды, ухудшение реологии крови, уменьшение времени циркуляции эритроцитов [26–28].
Заключение. Выявленные данные дают право говорить о нарушении представительности белковых фракций мембран эритроцитов, отвечающих за сохранение упругости мембраны, метаболизм внутри клеток, поддержание стабильности структуры каркаса мембран красных кровяных клеток при остром серозном и особенно при остром гнойном пиелонефрите. Что касается липидного профиля мембран эритроцитов, выявлено уменьшение содержания сфингомиелина и глицерофосфолипидов, определяющих основу липидной составляющей каркаса плазматической мембраны и имеющих главное значение в расположении белковых структур, сохранении правильного метаболизма красных кровяных клеток. Эти изменения в сочетании с нарушениями фракций белков плазматической мембраны и ведут к функциональным перестройкам эритроцитов при остром пиелонефрите. Нарушения структуры и функции мембран эритроцитов могут оказывать влияние на реологические и гемостатические свойства крови, метаболизм, вызывать гипоксические изменения, что может дополнительно потенцировать воспалительный процесс в почечной ткани. Выявленные изменения полноценно не корригируются стандартным лечением при гнойной форме пиелонефрита, что может обусловливать системные его последствия.
Выводы. У пациентов с ОСП до лечения выявлен рост уровня лишь одного представителя исследованных белков мембраны циркулирующих эритроцитов из 12, а именно тропомиозина, что может быть использовано в дифференциальной диагностике форм пиелонефрита.
У пациентов с гнойной формой пиелонефрита выявлено более значительное усиление процессов ПОЛ, ослабление антиоксидантной системы организма и уменьшение адсорбционных характеристик эритроцитов.
С учетом недостаточной эффективности базисного лечения в отношении большинства показателей структурных и функциональных свойств эритроцитов необходимо включение в комплексное лечение иммуномодулирующих и антиоксидантных препаратов при серозной и гнойной формах острого пиелонефрита, что будет способствовать снижению осложнений и усилению регенерационных процессов.
Рекомендации. С учетом результатов проведенного нами исследования считаем целесообразным рекомендовать врачам-специалистам использовать в сложных случаях дифференциальной диагностики форм острого пиелонефрита изучение показателей структурных и функциональных свойств эритроцитов.



